曲靖市某医院女性患者人乳头瘤病毒检测及基因分型结果分析
毛德超 孙继芹 陶娅琳 冷丽 包锐
人乳头瘤病毒(human papillomavirus,HPV)的感染与宫颈癌的发生密切相关。有研究显示,在宫颈癌患者中,有99.7%检出HPV 感染[1],故检测HPV 已成为宫颈癌筛查的重要指标。目前已发现超过150 种HPV 基因型,根据与宫颈癌发病风险关联程度的不同分为高危型和低危型[2]。专家共识提出,HPV 高危型主要包括HPVl6、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82等;低危型主要包括HPV6、11、40、42、43、44、54、61、70、72、81、83 等[3]。本研究采用聚合酶链反应(polymerase chain reaction,PCR)-反向点杂交技术,定性检测HPV 并进行HPV 基因分型,为临床诊治HPV 感染提供依据,现报告如下。
1 资料和方法
1.1 研究对象 选取2016 年1 月1 日—2018 年11月30日在本院检测HPV及基因分型的3 221例女性受检者,年龄20~78 岁,平均(40.46±10.16)岁。
1.2 仪器和试剂 基因扩增仪(7300 Real Time PCR System)购自Applied Biosytems 公司;人乳头瘤病毒基因分型检测试剂购自广州安必平医药科技股份有限公司,该试剂可检测18 种高危型基因和10 种低危型基因;宫颈分泌物一次性使用采样盒(内含无菌采样毛刷和装有无菌盐水的无菌试管)购自江苏健友医疗科技有限公司;HPV16 型、18 型等质控样品购自广州邦德盛生物科技有限公司。
1.3 实验方法
1.3.1 标本采集 用采样毛刷按要求采集宫颈口部位的分泌物,置入无菌试管中,送检验科备检。当天不能检测的标本4 ℃冰箱中保存,1 周内测完。
1.3.2 检测方法 采用PCR-反向点杂交技术,实验操作和结果判读严格按照仪器和试剂说明书进行,每次实验同步监测HPV16 型与HPV18 型的室内质控。检测步骤主要包括:① 样本处理和DNA提取;② PCR 扩增;③ 杂交;④ 结果分析。
1.4 统计学方法 采用SPSS 17.0 软件进行统计学分析,计量资料以均数±标准差(x±s)表示,采用t 检验;计数资料以例(率)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 HPV 感染患者来源分布 门诊和住院患者的感染率均明显高于体检人群(χ2=36.24,χ2=11.59,均P<0.05),而门诊患者和住院患者的感染率无明显差异(χ2=1.05,P>0.05)。见表1。
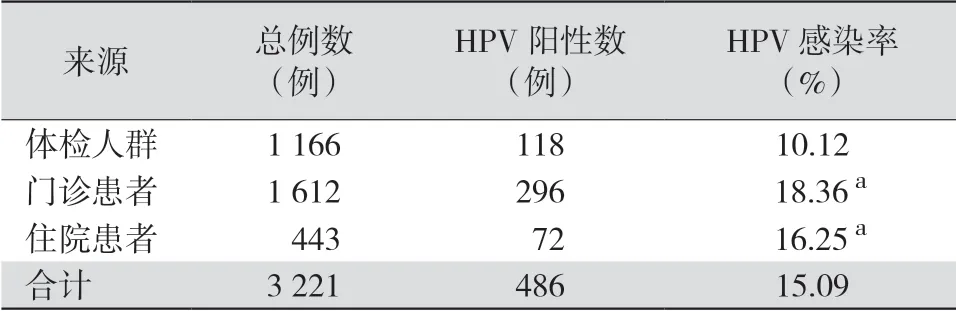
表1 486 例HPV 感染患者的来源分布
2.2 HPV 感染及高危型HPV 感染患者在各年龄段的分布 共检出HPV 感染486 例,感染率15.09%。其中18 种高危型基因408 例,占所有受检者的12.67%(408/3 221)。≥60 岁年龄段的感染率最高,与30~39 岁、40~49 岁年龄段人群比较有明显差异(χ2=5.23,χ2=4.27,P<0.05),其他年龄段之间的感染率比较均无明显差异(均P>0.05)。见表2。

表2 HPV 感染阳性及高危型HPV 感染患者在各年龄段的分布情况
2.3 HPV 感染患者基因检出情况 486 例HPV 感染患者中,358 例检出1 种HPV 基因型,占73.66%;128 例检出2 种及以上基因型,占26.34%。其中有1 例患者共检出9 种基因型。见表3。
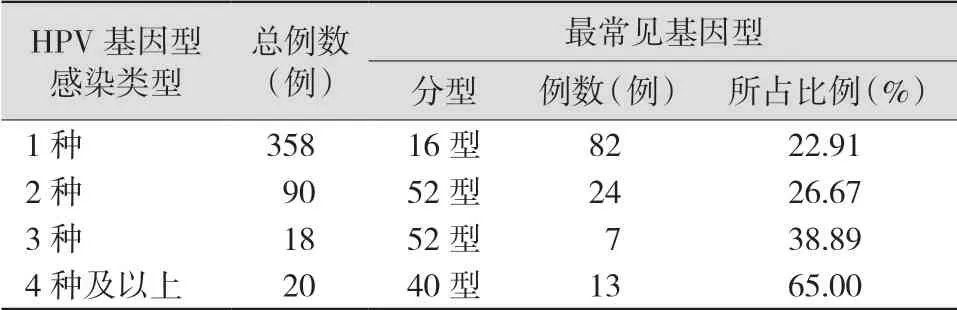
表3 486 例HPV 感染患者的基因检出情况
2.4 HPV 基 因 分 型 及 亚 型 分 布 486 例HPV 感染患者覆盖28 种基因型,包括18 种高危型基因(HPV16 型、18 型、26 型等)以及10 种低危型基因(6 型、11 型、40 型等)。除73 型外,其他27 型均在患者中单独检出;最常见基因型依次为16型、52型、58 型、40 型、44 型。检出2 种及以上基因的最常见亚型依次为52 型、40 型、16 型、44 型、56 型、53 型。见表4。
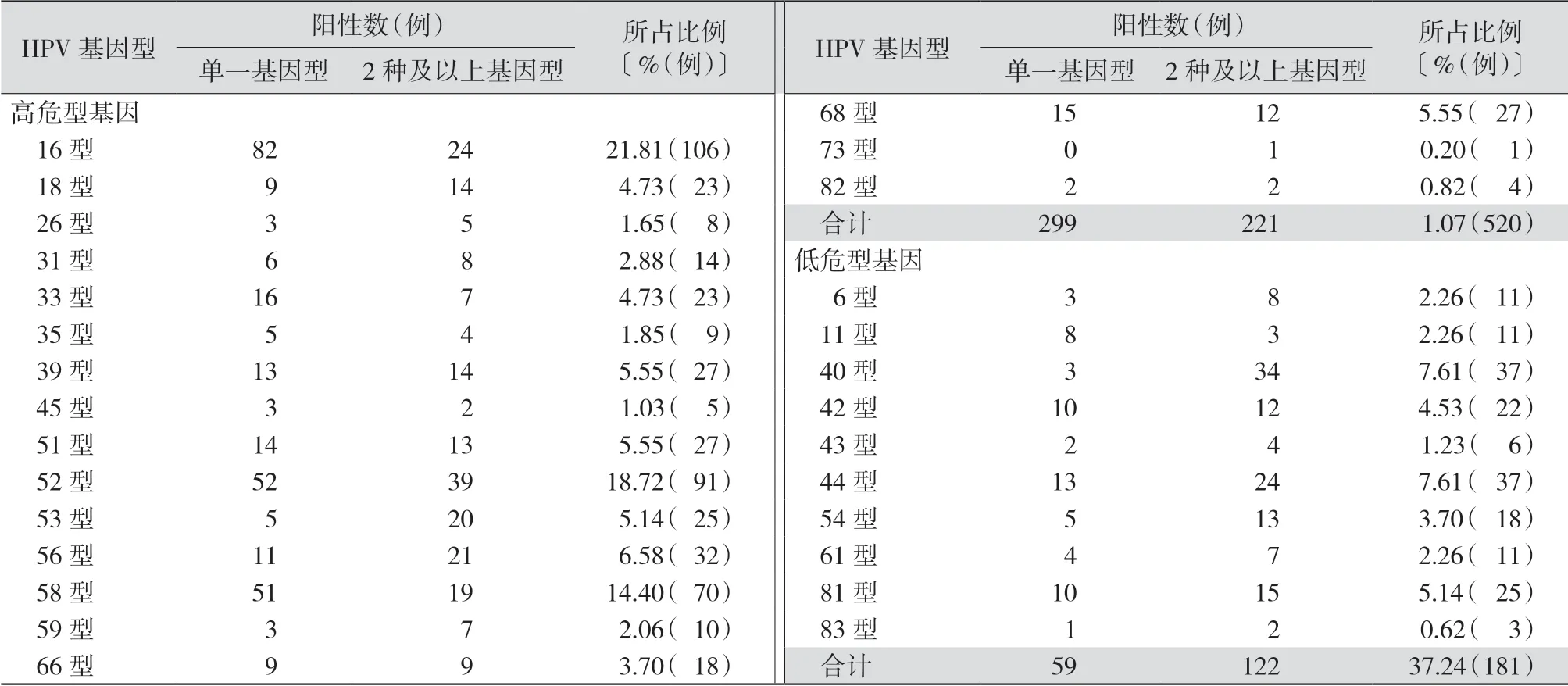
表4 486 例患者的HPV 基因分型及亚型分布情况
3 讨论
宫颈癌是女性生殖道三大恶性肿瘤之一,目前在我国有发病率高、病死率高、普查率低等特点[4]。很多研究表明,HPV 感染与宫颈癌有因果关系,HPV 感染已明确为导致宫颈癌的病因[5-6]。HPV 分为高危型和低危型,目前发现的HPV 亚型有150 余种[2],低危型主要与尖锐湿疣密切相关,高危型主要与宫颈癌前病变及宫颈癌密切相关[7]。因此,HPV的检测和基因分型对治疗HPV 感染以及预防宫颈癌都尤为重要。
本研究分析我院2016—2018 年3 221 例20 岁及以上女性患者的HPV 检测结果,其中486 例检出感染HPV,感染率为15.09%。低于杨君等[8]报道的重庆HPV 感染率(17.30%)和雷春菊[9]报道的佛山HPV 感染率(20.7%)。究其原因,可能与本研究将体检人群纳入分析有关,HPV 检测费用高导致普查率较低,普通人群参与检测多导致阳性率较低。另外,HPV 感染地区差异、不同实验室检测HPV 项目数量差异、各医院HPV 检测人群选择差异等都可能导致不同地区HPV 感染率的差异,这也反映了我国HPV 普查率低的现状。
本研究3 221 例受检者中,体检人群、门诊患者、住院患者的HPV 感染率分别为10.12%、18.36%、16.25%,体检人群的HPV 感染率明显低于门诊和住院患者,这说明普通人群检测数量增加,感染率会有所降低。30~39 岁与40~49 岁人群的HPV 感染率相近,在分析样本中的感染率最低;20~29 岁与50~59 岁人群的HPV 感染率相近,高于30~39 岁与40~49 岁的感染率;≥60 岁人群的HPV 感染率最高(21.64%)。各地区报道的HPV 感染率在不同年龄段人群中差异较大,可能由该项目的普及率较低以及各医院就诊人群差异大等原因所致[8-10]。
HPV 基因分型的相关研究较多,表现为不同地区之间存在差异。赵健等[11]发现北京地区HPV 的主要基因型依次为HPV16、58、52、33、53 等;吴玉萍等[12]发现江西省HPV 的主要基因型依次为HPV16、58、33、31 等;杨君等[8]发现重庆地区HPV主要基因型依次为HPV16、43、58、52、6 等;蒋卫平等[13]发现浙江丽水HPV 的主要基因型依次为HPV16、52、58、33、53 等;本院HPV 主要基因型依次为HPV16、52、58、40、44 等,HPV16 型检出率最高,与上述各地区的研究结果相同。说明HPV16 型是我国各地区主要存在的基因型,无明显地区差异;上述各地区研究还显示,高危型基因以HPV16、52、58 等为主,除HPV16 型外,其他分型的感染率有地区差异;各地区HPV 低危型基因的感染率差异很大,说明HPV 基因型存在地区差异。
本研究检出1 种基因型的HPV 感染患者以HPV16 型最常见;检出2 种和3 种基因型的HPV感染患者均以HPV52 型最常见;检出4 种及以上基因型的HPV 感染患者以HPV40 型最常见。
本研究只能定性检测HPV 及进行HPV 基因分型,无法对HPV 病毒负荷量进行定量检测。李肖甫等[14]的研究显示,高危型HPV-DNA 阳性患者中,宫颈部位细胞学异常者占79.01%,细胞学正常者占20.99%,说明不是所有高危型HPV 都会导致宫颈部位细胞学异常;另外,在细胞学异常组的宫颈组织中,高危型HPV-DNA 负荷量明显高于良性病变组,证明高危型HPV 与宫颈病变存在密切关系。该研究提示本实验室的方法存在局限性,还需要继续完善;同时提示临床在诊断高危型HPV 阳性患者时,不能仅考虑HPV 基因分型结果,还需要结合患者体征、宫颈细胞学和HPV 病毒负荷量等进行判断。
本研究3 221 例受检者的HPV 检测结果显示,HPV 感染率为15.09%;门诊患者HPV 感染率最高,其次为住院患者和体检人群;各年龄段中,≥60 岁人群感染率最高,其次为50~59 岁、20~29 岁、40~49 岁、30~39 岁人群。上述情况反映了我院2016—2018 年HPV 检测的实际情况。HPV16 型、52 型、58 型、40 型、44 型等明显高于其他基因分型,可反映曲靖市HPV 感染的主要基因型。

