不同Bt蛋白对捕食性天敌大草蛉的生态安全性评价
赵曼,汤金荣,牛琳琳,陈琳,梁革梅
(1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;2河南农业大学植物保护学院,郑州 450002)
0 引言
【研究意义】目前商业化种植转基因抗虫植物中表达的多为苏云金芽孢杆菌(Bacillus thuringiensis,Bt)蛋白,对鳞翅目(Lepidoptera)、鞘翅目(Coleoptera)或双翅目(Diptera)等一些重要农林害虫具有显著毒杀作用[1-2]。虽然转基因抗虫作物的种植有效地控制了靶标害虫的发生危害,减少了广谱性化学杀虫剂的使用,但其对非靶标生物(尤其是捕食性天敌和寄生性天敌)的潜在影响也一直被大家所关注[3]。大草蛉(Chrysopa pallens)是我国农田广泛分布的一种重要捕食性天敌,主要以蚜虫、粉虱、鳞翅目昆虫卵及低龄幼虫等为猎物,在害虫生物防治方面具有非常重要的生态学价值,其幼虫、成虫皆可捕食,且食性广、食量大,加上成虫具有取食植物花粉和花蜜的习性,因此在转基因作物田能通过取食植物花粉、花蜜或捕食 Bt蛋白靶标昆虫而直接或间接地接触到抗虫植物中表达的 Bt蛋白[4-5]。研究转基因抗虫植物中广泛表达的Bt蛋白对大草蛉的生态安全性,对目前及未来新型转基因抗虫植物在我国的科学推广应用具有重要意义。【前人研究进展】任何一种转基因抗虫植物在任何一个国家或地区商业化推广应用前,都需要针对当地具有重要生态功能且在田间可能接触到 Bt蛋白的非靶标节肢动物,建立严格的生态安全性评价体系来研究抗虫作物中表达的杀虫物质对这些重要非靶标生物的潜在影响[6-7]。之前关于Bt作物或Bt蛋白对捕食性天敌瓢虫或草蛉潜在影响的研究结果差异较大,有些报道认为,Bt作物对捕食性自然天敌是安全的,另一些研究则认为 Bt作物对天敌昆虫的生长发育具有不利影响,然而进一步分析造成不利影响的原因,发现天敌昆虫通常通过取食对 Bt蛋白敏感的猎物而接触到Bt蛋白,Bt蛋白影响靶标猎物的营养质量,从而进一步影响天敌昆虫的生长发育[8-11]。因此,在研究Bt蛋白或转基因抗虫植物对非靶标生物的生态安全性时,为了避免猎物营养质量而导致的假阳性评价结果,可以利用直接试验体系通过在天敌昆虫食物源中加入高剂量Bt蛋白来评价Bt蛋白对捕食性天敌生长发育的直接影响,比如可以利用一些瓢虫或草蛉成虫具有取食植物花粉的习性,在植物花粉中混入 Bt蛋白,或在天敌昆虫人工饲料中加入Bt蛋白的方法来研究取食Bt蛋白对捕食性天敌生长发育的直接影响[12-14]。【本研究切入点】尽管之前有一些研究报道了Bt作物或Bt蛋白对北欧草蛉(Chrysoperla carnea)和中华草蛉(Chrysoperla sinica)等草蛉类昆虫的直接或间接影响,但关于Bt蛋白对我国棉田重要捕食性天敌大草蛉是否有不利影响尚未见系统的报道[15-16]。目前我国推广应用的转基因抗虫棉仍然为第一代抗虫棉,只表达一种Bt蛋白,即Cry1Ac蛋白。杀虫谱更广、可以延缓靶标害虫抗性发展的能够同时表达两种 Bt蛋白的二代抗虫棉已在美国、澳大利亚等多个国家商业化推广种植[17]。未来能够同时表达两种或多种Bt蛋白的转基因抗虫棉在我国可能也会商业化推广种植,因此,本研究通过建立合适的生物测定体系,综合评价目前转基因抗虫棉中广泛表达的几种 Bt蛋白对大草蛉的生态安全性。【拟解决的关键问题】建立Bt蛋白对大草蛉的安全性评价体系,明确目前转基因抗虫棉中广泛表达的Bt蛋白对大草蛉的生态安全性,为未来在我国可能商业化推广应用的二代转基因抗虫棉的生态安全性提供理论依据。
1 材料与方法
试验于 2017年在中国农业科学院植物保护研究所完成。
1.1 供试材料
供试大草蛉采自中国农业科学院河北廊坊基地,在实验室内以蚕豆蚜(Aphis craccivora)作为猎物进行继代饲养,蚕豆蚜以室内培养的鲜嫩蚕豆苗作为寄主植物;棉铃虫(Helicoverpa armigera)敏感品系(96S)是在室内用人工饲料饲养多代的敏感昆虫,未接触任何杀虫剂,饲养方法参照文献[18]。饲养环境条件为温度(27±1)℃,相对湿度(75±5)%,光周期14 h∶10 h(L∶D)。
阳性对照物质砷酸二氢钾 PA(KH2AsO4)购自Sigma-Aldrich,使用前储存于-20℃冰箱;供试 Bt蛋白Cry1Ac和Cry1F购自Envirologix,Cry2Ab蛋白来源于中国农业科学院植物保护研究所生物技术组,使用前均保存在-80℃超低温冰箱备用。
1.2 供试Bt蛋白对大草蛉的生物学影响
PA对多种草蛉生长发育均具有胃毒作用,因此常被用作测定有毒物质对草蛉生长发育潜在影响的阳性对照物质[13]。本研究以添加PA的大草蛉人工饲料[19]作为阳性对照处理,通过在大草蛉人工饲料中添加不同Bt蛋白来研究供试3种Bt蛋白单独作用或混合作用下对大草蛉生命表参数的影响。具体步骤:在准备的新鲜大草蛉人工饲料中添加一定量单独或混合的Bt蛋白,使蛋白在饲料中的最终浓度为500 µg·g-1FW(每克饲料鲜重),充分混匀后,参照王英丽等[20]所述方法将饲料加工成饲料囊,提供给初孵大草蛉幼虫。试验设置处理包括:(1)大草蛉纯人工饲料(空白对照);(2)Cry1Ac处理(饲料中 Cry1Ac浓度 500 µg·g-1FW);(3)Cry1F 处理(饲料中 Cry1F 浓度 500 µg·g-1FW);(4)Cry2Ab 处理(饲料中Cry2Ab浓度500µg·g-1FW);(5)Cry1Ac和 Cry1F 蛋白混合处理(饲料中 Cry1Ac和 Cry1F 浓度均为 500 µg·g-1FW);(6)Cry1Ac和Cry2Ab蛋白混合处理(饲料中Cry1Ac和Cry2Ab浓度均为500 µg·g-1FW);(7)PA处理(饲料中PA浓度为30 µg·g-1FW)。将初孵大草蛉幼虫(<12 h)单头放置于大小为9.0 cm×1.5 cm的塑料培养皿中,第1天提供给大草蛉的食物为各处理人工饲料,第2天提供给大草蛉的食物为各处理人工饲料加蚕豆蚜(培养皿中同时提供饲料囊和剪成2 cm覆满蚕豆蚜的蚕豆苗),之后照此方法重复交替提供给测试大草蛉。此外,培养皿中还放置一个湿润的脱脂棉球作为大草蛉水源。每个处理重复 4次,每个重复包含 25头大草蛉幼虫,提供给大草蛉的各处理人工饲料囊每2 d更换一次。每日定时调查大草蛉幼虫存活及蜕皮情况,并称量4龄幼虫和蛹的体重。待成虫从蛹中羽化后,对大草蛉成虫进行性别鉴定并称量雌、雄虫体重。之后将同一处理的雌、雄虫随机配对,每对单独饲养,人工饲料和蚕豆蚜的供给方法与幼虫期相同。饲养成虫的塑料培养皿中每日放入一段叠加的滤纸条(1 cm×5 cm)作为雌虫产卵介质,每天除调查雌、雄虫存活情况外,还要记录雌虫产卵情况,成虫期试验持续20 d(因大草蛉成虫寿命长且产卵期较为分散,因此该生物学试验在成虫期仅记录含产卵高峰在内的前20 d)。
1.3 大草蛉体内Bt蛋白含量检测
将另外一组大草蛉幼虫,按照1.2所述人工饲料和蚕豆蚜混合交替饲养的方法,饲养在处理(1)至处理(6)的人工饲料上。饲养过程中,人工饲料和蚕豆蚜供给大草蛉的方式同1.2。在大草蛉生长发育过程中,收集不同处理中不同时期的大草蛉(4龄幼虫、蛹和羽化4 d后成虫)的样品,用于测定大草蛉体内不同Bt蛋白的含量。每个处理每个时期的大草蛉收集3个样品,每个样品包含5头大草蛉。不同样品中大草蛉体内Bt蛋白浓度检测方法为双抗体夹心酶联免疫吸附法(double-antibody sandwich enzyme-link immunosorbent assay,DAS-ELISA),具体测定方法参照各Cry蛋白定量测定试剂盒(Envirologix)说明书。
1.4 Bt蛋白稳定性和生物活性检测
为了明确不同处理饲料中混入 Bt蛋白的稳定性和生物活性,分别取新鲜准备的和在试验环境条件下暴露2 d的不同Cry蛋白处理饲料,每种处理饲料包含3次重复,其稳定性利用ELISA法来测定,具体方法同1.3;生物活性测定方法参照文献[21],用敏感棉铃虫品系(96S)进行测定。
1.5 取食Bt蛋白对大草蛉消化酶、解毒酶和保护酶活性的影响
大草蛉取食3种不同Bt蛋白处理饲料后,测定其体内主要代谢酶系(消化酶、解毒酶和保护酶)的活性水平。测定的消化酶包括总蛋白酶(T-pro)、类胰蛋白酶(TPS)、类凝乳蛋白酶(CTP)和氨肽酶(AP);解毒酶包括α-乙酸萘酯酯酶(α-NAE)、羧酸酯酶(CES)、谷胱甘肽-S-转移酶(GST)、乙酰胆碱酯酶(AChE)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP);测定的保护酶包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)。大草蛉样品收集方法同1.3,除收集取食空白对照饲料和Bt处理饲料的大草蛉样品,还需收集取食PA处理饲料的大草蛉各时期样品。具体测定方法参照酶活测定试剂盒说明书(北京路远生物科技公司和南京建成生物研究所)。
1.6 数据统计与分析
数据统计分析采用SPSS 19.0软件完成,不同处理间大草蛉的幼虫发育历期、蛹重和成虫体重等生命表参数以及酶活性在SPSS软件中进行单因素方差分析后,再利用Dunnett's test进行不同处理间的差异性比较,其中化蛹率和羽化率需转换后再进行数据统计分析;大草蛉人工饲料中Bt蛋白的稳定性和生物活性采用Student's test进行分析。
2 结果
2.1 取食Bt蛋白对大草蛉生长发育的影响
与对照纯人工饲料相比,取食Bt蛋白处理饲料对大草蛉4龄幼虫体重、幼虫发育历期、化蛹率、蛹重、蛹发育历期、羽化率、成虫体重和单雌总产卵量无显著性影响(P>0.05);但取食PA处理饲料却能够使大草蛉幼虫和蛹发育历期极显著延长,其他各测定生长发育参数则极显著降低(P<0.01)(表1)。
2.2 大草蛉体内Bt蛋白含量检测
在取食对照纯人工饲料的大草蛉体内(幼虫、蛹及成虫)未检测到Bt蛋白;在取食不同Bt蛋白处理饲料的大草蛉幼虫及成虫体内均检测到了一定量的Bt蛋白,蛹内也检测到了少量的Bt蛋白,说明本研究生测体系所用的大草蛉人工饲料能够将混入饲料中的这3种Bt蛋白有效地传递给大草蛉(表2)。
2.3 大草蛉人工饲料中 Bt蛋白稳定性和生物活性检测
在新鲜和暴露2 d的大草蛉对照饲料中,未检测到Bt蛋白;而Bt蛋白处理的饲料,在试验环境条件下暴露 2 d后,饲料中的 Cry1Ac浓度显著降低(P=0.04),Cry1F和 Cry2Ab浓度降低不显著(Cry1F:P=0.19;Cry2Ab:P=0.20)(图 1-A)。敏感昆虫生测结果表明(图1-B),新鲜和在试验环境条件下暴露2 d的Bt蛋白处理大草蛉人工饲料的提取液加入棉铃虫饲料后饲喂敏感棉铃虫幼虫,两者死亡率差异不显著(P>0.05),但均极显著高于无添加的棉铃虫人工饲料饲养的敏感棉铃虫的死亡率(P<0.01)。
2.4 大草蛉取食Bt蛋白后体内主要消化酶、解毒酶和保护酶活性
由图2可知,空白对照组和Bt蛋白处理组间的大草蛉幼虫和成虫体内 4种消化酶活性无显著差异(P>0.05),但阳性对照物质(PA)处理组的大草蛉氨肽酶活性极显著低于空白对照组,其他3种消化酶的活性则显著或极显著高于空白对照组(P<0.05或P<0.01)。取食纯人工饲料和取食 Bt蛋白处理饲料的大草蛉各解毒酶和保护酶活性差异也不显著(P>0.05),但取食 PA处理饲料的大草蛉体内主要解毒酶和保护酶活性显著或极显著高于空白对照组(P<0.05或P<0.01)(图3—图5)。

表1 大草蛉取食纯人工饲料、含有Bt蛋白或PA的人工饲料的生命表参数Table 1 Life-table parameters of C. pallens fed on pure artificial diet or artificial diet containing different Bt proteins or PA

表2 大草蛉体内Bt蛋白浓度Table 2 Bt protein concentration in C. pallens
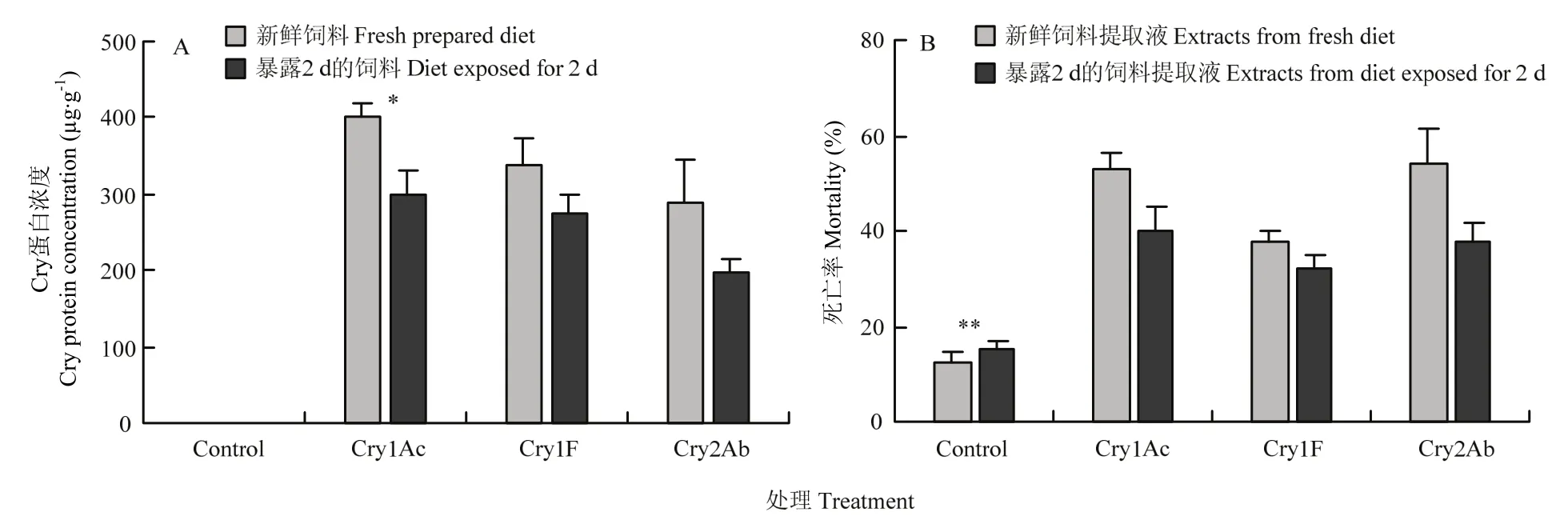
图1 新鲜饲料和暴露2 d的饲料中Bt蛋白浓度和生物活性Fig. 1 Concentration and bioactivity of Bt proteins in the artificial diets that were freshly prepared or had been exposed to C.pallens for 2 d

图2 取食不同饲料的大草蛉体内消化酶活性Fig. 2 Digestive enzyme activity of C. pallens fed on different diets
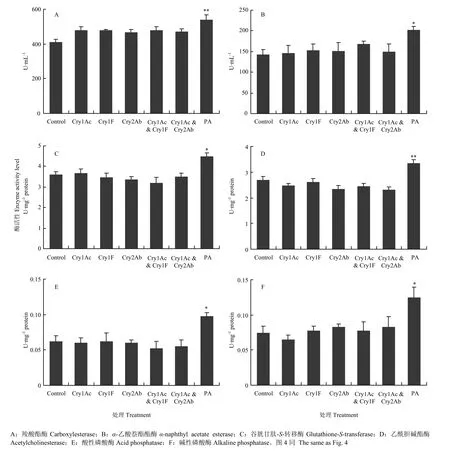
图3 取食不同饲料的大草蛉4龄幼虫体内解毒酶活性Fig. 3 Detoxifying enzyme activity of C. pallens 4th instar larvae fed on different diets
3 讨论
草蛉作为我国农田生态系统中常见的杂食性捕食天敌,其幼虫和成虫均能捕食害虫,且食性广、食量大,是一种具有重要生态功能的天敌昆虫。草蛉成虫具有补充营养的习性,在作物开花期或捕食猎物对象种群数量不足的情况下,还可取食农田作物花粉,因此在转基因抗虫作物田,可以通过捕食Bt蛋白靶标害虫或取食转基因抗虫植物的花粉而直接或间接地暴露于转基因抗虫植物表达的Bt蛋白[22]。因此,常把草蛉这类捕食性自然天敌作为转基因抗虫植物环境安全性评价中对其非靶标生物生态安全性评价的重要指示性物种[7,13]。

图4 取食不同饲料的大草蛉成虫体内解毒酶活性Fig. 4 Detoxifying enzyme activity of C. pallens adults fed on different diets
在转基因抗虫植物对其非靶标生物的安全性评价中,一般采用从实验室试验(lower-tier)到半田间试验(middle-tier),再到田间试验(higher-tier)的分层次评价系统,根据前一评价阶段的评价结果来决定是否终止评价或进入下一评价阶段。实验室评价作为转基因抗虫植物对其非靶标生物生态安全性评价的第一步,一般是在实验室理想可控环境条件下,通过将选择的非靶标生物暴露于高浓度杀虫化合物下,来研究受试物种对转基因抗虫植物中表达杀虫蛋白的敏感性。试验中所用杀虫蛋白的浓度至少为其在田间环境中可能接触量的10倍,甚至100倍以上。在实验室评价中,一般利用人工饲料试验(Tier-1),通过将高剂量杀虫蛋白混入到评价生物的合适人工饲料中,来研究杀虫蛋白对供试生物的直接毒性[19,23]。但 Tier-1生测体系的建立需要满足3个条件:(1)合适的杀虫蛋白载体,一般指待测生物的人工饲料,该饲料既能够满足供试生物正常的生长发育,又能将杀虫化合物传递给供试生物(待评价昆虫在该人工饲料上的幼虫存活率≥80%);(2)选择一种与待评价杀虫物质作用方式相同的杀虫化合物,作为转基因植物对非靶标生物生态安全性评价生测体系中的阳性对照物质,用于验证所建立的Tier-1生测体系是否能够检测到杀虫化合物对受试非靶标生物的不利影响;(3)寻找一种能够有效检测杀虫物质在生测试验过程中稳定性和生物活性的方法,以便于评估供试生物暴露于杀虫化合物的实际程度[24]。

图5 取食不同饲料的大草蛉体内保护酶活性Fig. 5 Antioxidant enzyme activity of C. pallens fed on different diets
单纯的人工饲料饲喂难以使大草蛉幼虫存活率达到80%[25],因此本试验采用人工饲料和蚕豆蚜交替混合饲喂的方式来饲养大草蛉,结果表明大草蛉在该饲养体系上能够完成正常的生长发育,且幼虫存活率>80%,满足Tier-1生测体系建立的基本要求。LI等[13]研究表明,砷酸二氢钾(PA)对多种草蛉均具有胃毒作用,因此常被用作测定Bt蛋白对草蛉潜在毒性生测试验体系中的阳性对照物质。本研究也利用 PA作为评价供试 Bt蛋白对大草蛉生长发育直接影响的阳性对照物质,结果显示饲料中添加 PA能够显著抑制大草蛉生长发育,说明试验所用Tier-1生测体系能够检测到对照杀虫物质对大草蛉的负面影响,而该体系的评价结果表明供试的3种Bt蛋白单独或混合作用对大草蛉生长发育均无显著性直接不利影响,这与之前其他 Bt蛋白对草蛉类昆虫的生态安全性评价结果相一致[26]。
在Tier-1直接试验中,虽然杀虫化合物以高于田间实际表达量至少 10倍的剂量混入到待评价生物人工饲料中,但并不代表选择的非靶标生物实际暴露于这么高的浓度,因为待评价的杀虫物质在试验过程中可能会发生降解,从而失去毒性。因此,需要选择一种合适的方法来监测受试生物人工饲料中混入 Bt蛋白的浓度和生物活性,如利用蛋白免疫印迹法(Western blot)或ELISA法来检测Bt蛋白在试验过程中的浓度变化[27-28],后者与前者相比,其操作更简便、测定更精确;试验过程中Bt蛋白的生物活性变化则利用对Bt毒素敏感的昆虫来检测[14]。本研究中大草蛉人工饲料每2 d更换一次,Bt蛋白稳定性和生物活性测定结果显示,Bt蛋白处理大草蛉饲料在试验环境条件下暴露2 d后,虽然其中的Bt蛋白浓度有一定程度降低,但其生物活性无显著变化;大草蛉取食 Bt蛋白处理饲料后,在其幼虫及成虫体内均检测到了较高浓度的Bt蛋白,蛹内也检测到了少量Bt蛋白,说明该试验体系能将混入的杀虫蛋白传递给大草蛉,大草蛉在整个试验过程中接触到的均为高浓度的、具有生物活性的Bt蛋白,但对其生长发育并无显著性不利影响。
在本研究建立的安全性评价体系中,Cry1Ac、Cry1F和Cry2Ab这3种Bt蛋白以单独或组合的方式高剂量混入大草蛉人工饲料,对大草蛉生长发育无显著性不利影响。进一步测定了在昆虫生长发育过程中起重要作用的主要代谢酶系的活性,发现直接取食含有高浓度Bt蛋白的大草蛉人工饲料,对大草蛉体内主要消化酶、解毒酶和保护酶的活性均无显著性影响,但取食 PA处理的饲料却能显著影响大草蛉体内所测酶的酶活性。王英丽等研究表明,捕食性天敌取食转基因抗虫作物后,其体内某些酶活性会发生变化,如蛋白酶、谷胱甘肽-S-转移酶、过氧化物酶及超氧化物歧化酶等[20,29-30]。有报道认为一些捕食性天敌取食转基因抗虫作物后,其体内某些酶活性发生变化可能是由于转基因抗虫作物中次生物质或营养物质引起的,而非Bt蛋白所导致。综合上述生物学及生理生化方面的评价结果,说明Cry1Ac、Cry1F和Cry2Ab对大草蛉是安全的。
4 结论
本研究所建立的直接试验评价体系可用于评价新型杀虫蛋白或转基因抗虫植物对大草蛉的生态安全性,大草蛉取食高浓度活性Bt蛋白,对其生长发育及体内主要代谢酶活性均无显著不利影响,因此,目前转基因抗虫棉中广泛表达的Cry1Ac、Cry1F和Cry2Ab对大草蛉是安全的。

