芹菜素对慢性肾功能衰竭大鼠贫血和电解质代谢紊乱的影响*
杨 杰
(河北北方学院附属第一医院药学部,张家口 075000)
慢性肾功能衰竭(CRF)是各种慢性肾脏疾病持续进展的共同结局,电解质代谢紊乱、内分泌失调、酸碱失衡以及贫血是其早期主要的临床表现[1-3]。芹菜素(APG)是一种具有广泛生物学活性的天然存在的黄酮类化合物,在多种水果蔬菜中均含量丰富,王珂等[4]和王强等[5]研究发现黄酮类化合物对CRF大鼠具有一定的保护作用,本实验将通过复制CRF模型大鼠并腹腔注射给予APG进行治疗,通过相关指标检测并对比正常对照组、模型组实验数据,探讨APG对CRF大鼠贫血和电解质代谢紊乱的影响。
1 材料与方法
1.1 实验动物 健康无特定病原体(SPF级)雄性SD大鼠(8周龄,220~260 g)购自河北省实验动物中心[SCXK(冀)2013-1-003]。饲养环境:23~25℃、相对湿度 55%~60%,光照周期 12 h:12 h。
1.2 药物与试剂 芹菜素(陕西慧科植物开发有限公司,批号:170329);血清铁(SI)、总铁结合力(TIBC)测定试剂盒(北京博奥森生物技术有限公司,批号:071128、070916);铁蛋白(FER)酶联免疫吸附法(ELISA)测定试剂盒(美国R&D公司,E01627);血尿素氮(BUN)、血肌酐(SCr)、尿素(UA)测定试剂盒(深圳迈瑞生物医疗电子股份有限公司,批号:201711012、201710025、201705023);腺嘌呤(国药集团化学试剂有限公司)。
1.3 实验方法
1.3.1 分组、造模与给药 取100只实验用大鼠按照随机数字表法随机分为正常对照组、模型组、APG低剂量组[10 mg/(kg·d)]、APG中剂量组[20 mg/(kg·d)]、APG高剂量组[40 mg/(kg·d)]组,每组20只。复制CRF大鼠模型[6]:制备25%腺嘌呤溶液,连续灌胃21 d[250 mg/(kg·d)]以制备CRF大鼠模型,造模结局判断[7]:SCr水平高于正常高值,肾脏组织呈现炎性细胞浸润、肾间质纤维化等病理性改变,即造模成功。造模完成后,APG各剂量组腹腔注射给药治疗(1次/日),正常对照组和模型组同步腹腔注射给予生理盐水,疗程28 d。
1.3.2 肾功能指标检测 麻醉后经腹主动脉取血(不做抗凝处理),1 500 r/min离心10 min取血清,通过生化分析仪测定血清中BUN、SCr、UA含量。
1.3.3 肾脏指数的计算 称量各组大鼠体质量,麻醉后开腹摘取两侧肾脏组织,生理盐水冲洗干净后称量左侧肾脏质量,然后进行计算,肾脏指数=左侧肾脏质量/体质量。
1.3.4 贫血监测指标 参照1.3.2方法取血,血常规分析仪测定全血红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT);1 500 r/min离心10 min取血清,通过生化分析仪测定各组大鼠血清中SI、TIBC、FER含量。
1.3.5 电解质测定 经腹主动脉取血并分离血清后通过化分析仪测定血清 K+、Na+、Ca2+、P3+含量。
1.3.6 肾脏组织病理学检查 取右侧肾脏组织,置4%多聚甲醛溶液进行固定,72 h后进行石蜡包埋和切片,脱蜡水化处理后行常规HE染色[依次进行乙醇梯度脱蜡、磷酸盐缓冲液(PBS)洗涤、苏木素染色5 min、0.5%乙醇盐酸分色、伊红染色 20s等步骤],通过光学显微镜观察肾脏组织形态。
1.4 统计学处理 运用软件SPSS18.0进行数据统计分析,实验数据采用均数±标准差(±s)方式表示,多组间均数比较采用单因素方法分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾功能检测结果比较 模型组大鼠血清BUN、SCr、UA含量较正常对照组均显著升高(P<0.01);与模型组比较,APG 中、高剂量组 CRF 大鼠血清经治疗28 d后BUN、SCr、UA含量均显著降低,差异有统计学意义(P<0.05 或 P<0.01)。见表 1。
2.2 各组大鼠体质量和肾脏指数结果比较 模型组大鼠体质量、肾脏指数较正常对照组显著升高(P<0.01);与模型组比较,APG 高剂量组 CRF大鼠经治疗 28 d后体质量升高(P<0.05),APG 中、高剂量组肾脏指数显著降低(P<0.01)。见表 2。
2.3 各组大鼠贫血监测指标测定结果比较 模型组大鼠 RBC、HGB、HCT、SI、TIBC、FER 较正常对照组均显著降低(P<0.01);与模型组比较,APG 中、高剂量组 CRF大鼠经治疗 28 d后 HGB、HCT、SI、TIBC、FER显著升高,且高剂量组RBC显著升高,差异具有统计学意义(P<0.05 或 P<0.01)。见表 3。
2.4 各组大鼠电解质测定结果比较 模型组大鼠血清Ca2+含量较正常对照组显著降低且K+、Na+、P3+含量显著升高(P<0.01);与模型组比较,APG 中、高剂量组CRF大鼠经治疗28 d后血清Ca2+含量显著升高(P<0.05),P3+含量显著降低且高剂量组 K+、Na+含量显著降低(P<0.05 或 P<0.01)。见表 4。
表1 各组大鼠BUN、SCr、UA测定结果比较(±s)Tab.1 The measurement resultsof BUN,SCr,UA(±s)
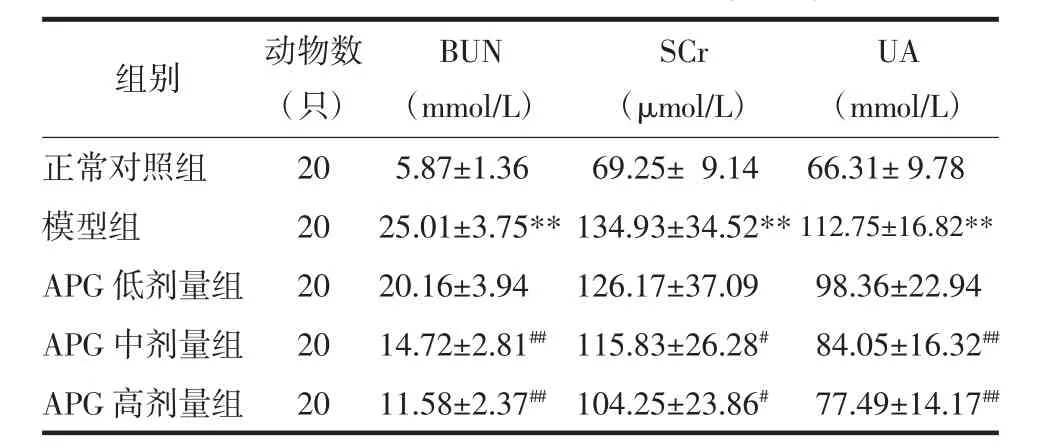
表1 各组大鼠BUN、SCr、UA测定结果比较(±s)Tab.1 The measurement resultsof BUN,SCr,UA(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
UA(mmol/L)正常对照组 20 5.87±1.36组别 动物数(只)BUN(mmol/L)69.25± 9.14 66.31± 9.78模型组 20 25.01±3.75**134.93±34.52**112.75±1 126.17±37.09 98.36±2 115.83±26.28# 84.05±1 6.82**APG 低剂量组 20 20.16±3.94 2.94 APG 中剂量组 20 14.72±2.81##6.32##APG 高剂量组 20 11.58±2.37##104.25±23.86# 77.49±14.17##SCr(μmol/L)
表2 各组大鼠体质量、肾脏指数测定结果比较(±s)Tab.2 The measurement resultsof body weight and kidney index(±s)

表2 各组大鼠体质量、肾脏指数测定结果比较(±s)Tab.2 The measurement resultsof body weight and kidney index(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
表3 各组大鼠贫血监测指标测定结果比较(±s)Tab.3 The measurement resultsof anemia monitoring index(±s)

表3 各组大鼠贫血监测指标测定结果比较(±s)Tab.3 The measurement resultsof anemia monitoring index(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
?
2.5 各组大鼠肾脏组织病理学检查结果 正常对照组大鼠肾脏组织结构和细胞形态均未见异常;与正常对照组比较,模型组大鼠肾脏组织呈现明显的病理性改变,主要表现为肾小球数量减少、球囊粘连、囊腔扩大、肾小管坏死、大量炎症细胞和出现、中性粒细胞浸润等;较模型组,经APG中、高剂量组治疗28 d后CRF大鼠肾脏组织病变明显改善,改善效果以高剂量组最为显著。见图1。
表4 各组大鼠电解质指标测定结果比较(±s)Tab.4 The measurement resultsof electrolyte index(±s)

表4 各组大鼠电解质指标测定结果比较(±s)Tab.4 The measurement resultsof electrolyte index(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
(mmol/L)正常对照组 20 4.79±0.46 140.62±1.46 2.38±0.31 1.57±0.11模型组 20 6.05±0.72**143.24±1.79**1.56±0.19**2.24±0.18**APG 低剂量组 20 5.86±0.97 142.93±2.08 1.72±0.15 2.09±0.35 APG 中剂量组 20 5.37±0.85# 142.05±1.63# 1.99±0.42# 1.91±0.27#APG 高剂量组 20 5.18±0.69##139.98±1.52# 2.02±0.29# 1.68±0.19##组别 动物数(只)K+P3+(mmol/L)Na+(mmol/L)Ca2+(mmol/L)

图1 肾脏组织病理学检查结果(HE,×400)Fig.1 The histopathological examination resultsof renal tissue(HE,×400)
3 讨论
流行病学调查发现CRF发病率达568/100万,具有不可逆及持续进展的特点,是主要致死原因之一[8],是临床上亟待解决的医学难题之一。高浓度腺嘌呤持续摄入是常用的CRF大鼠模型造模方法[7],该方法制作的CRF大鼠模型异常新陈代谢与人类CRF临床表现及病理改变相似[9];该制作方法的机制主要与腺嘌呤代谢形成极难溶于水的2,8-二羟基腺嘌呤,沉积于肾小管并堵塞肾小管腔,影响氮质化合物的排泄,导致氮质血症、毒素蓄积、电解质代谢紊乱而最终引起肾功能衰竭[10],此外还可能与2,8-二羟基腺嘌呤阻塞肾小管而引发肾脏组织炎症反应和氧化应激有关[11]。肾功能指标(BUN、SCr、UA)异常、电解质(P3+、K+、Na+、Ca2+)代谢紊乱、贫血以及肾脏组织病变是CRF的主要临床表现[12]。本实验结果显示,模型组大鼠血清BUN、SCr、UA显著升高,Ca2+含量显著降低且 K+、Na+、P3+含量显著升高,贫血监测指标明显异常,肾脏组织病理性改变,提示造模成功。
本实验采用腺嘌呤连续灌胃21 d的方法复制CRF模型大鼠,腹腔注射给予APG进行干预治疗,实验结果显示,经APG 20~40 mg/(kg·d)治疗28 d能够有效改善CRF大鼠肾功能(降低血清BUN、SCr、UA含量),降低肾脏指数,抑制肾脏组织形态和细胞结构病变,提示APG对CRF大鼠肾脏组织损伤具有抑制作用。
肾性贫血主要表现为RBC数量降低,HGB、HCT 降低,SI、TIBC、FER 含量降低[13-14]。SI是 HGB合成的必需元素[15],贫血的发生与HGB合成受阻密切相关,因此HGB水平是评价人体是否贫血的重要指标[16]。本实验结果显示,经APG 20~40 mg/(kg·d)治疗28 d能够有效提高CRF大鼠全血RBC、HGB、HCT水平和血清中SI、TIBC、FER含量,提示APG具有抑制CRF大鼠贫血症状的作用。
电解质代谢紊乱也是CRF患者常见并发症之一,其中钙磷代谢紊乱最常见并形成低钙高磷血症[17],此外电解质代谢紊乱还可诱发继发性甲状旁腺功能亢进、血管钙化等[18]。本实验结果显示,经APG 20~40 mg/(kg·d)治疗28 d能够升高CRF大鼠血清Ca2+水平并降低 P3+、K+、Na+水平,说明 APG 具有抑制CRF大鼠电解质代谢紊乱的作用。
综上所述,APG具有改善CRF大鼠贫血、电解质紊乱的药理学作用,可能是APG对CRF能够起到一定保护作用的机制之一。

