茯苓的化学成分与生物活性研究进展*
张 年,李兆星,李 娟,刘 靖,戴甲木,李豫伟**,李顺祥**
(1.湖南中医药大学药学院 长沙 410208;2.哈佛医学院附Mclean医院生物有机和天然产物研究实验室 波士顿MA 02478;3.西南大学药学院 重庆 400715;4.湖南省中药活性物质筛选工程技术研究中心 长沙 410208;5.湖南补天茯苓研究院 长沙 410208)
茯苓PORIA为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf菌核,药食两用大宗中药材,临床运用最多的四大传统药材之一,有“十方九苓”之说,我国干茯苓年需求量达3万多吨,是我国中成药的主要原料药材,茯苓产业产值超过100亿元。
我国早在2000多年前的汉代即有茯苓的应用,《神农本草经》将其列入“轻身益气,不老延年”的“上品”[1]。茯苓主产于湖北、安徽、福建、云南、湖南、贵州、四川等省,味甘、淡,性平,具有利水渗湿、健脾、宁心的功效,主治水肿尿少、痰饮眩悸、脾虚食少、便溏泄泻、心神不安、惊悸失眠等[2]。可见,茯苓即具有较高的经济价值又具有重要的药用价值。本文通过对茯苓的化学成分和生物活性进行综述,以期为今后茯苓的开发和利用提供参考。
1 化学成分
迄今为止,从茯苓中发现的化学成分主要有多糖类、三萜类、甾醇类、氨基酸、脂肪酸等,其中报道的具有生物活性的化合物主要集中在三萜类和多糖类化合物。目前共分离鉴定了三萜类成分84种,多糖类成分60余种。
1.1 三萜类
茯苓菌核和茯苓皮中都含有三萜类,结构类型主要包括:羊毛甾-8-烯型、羊毛甾-7,9(11)-二烯型、3,4-开环-羊毛甾-8-烯型、3,4-开环-羊毛甾-7,9(11)-二烯型等。迄今共分离鉴定了羊毛甾-8-烯型三萜19种,羊毛甾-7,9(11)-二烯型三萜30种,3,4-开环-羊毛甾-8-烯型三萜7种,3,4-开环-羊毛甾-7,9(11)-二烯型三萜19种,环二氧四环三萜2种,4,5-开环-羊毛甾型1种,四环其他型三萜3种,五环三萜3种。其名称和结构(表1,图1-8)。
1.2 二萜类化合物
茯苓中除了含有三萜类化合物外,还含有二萜类型的化合物。Akihisa等[9]从茯苓皮中分离得到1个二萜类化合物7-oxo-15-hydroxydehydroabietic acid(85),Ukiya等[16]从茯苓菌核中分离得到1个二萜类化合物dehydroabietic acid methyl ester(86)。
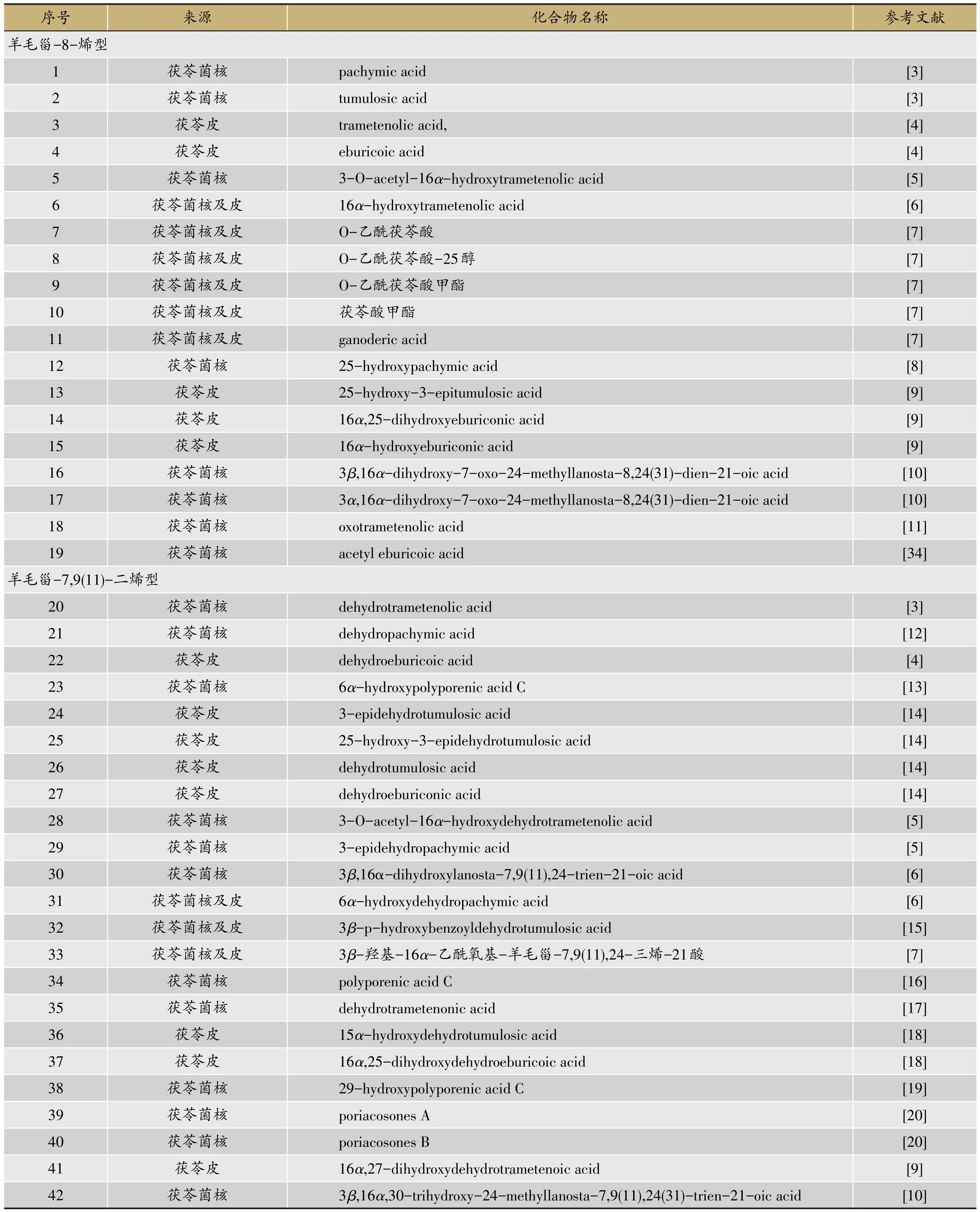
表1 茯苓的三萜类成分
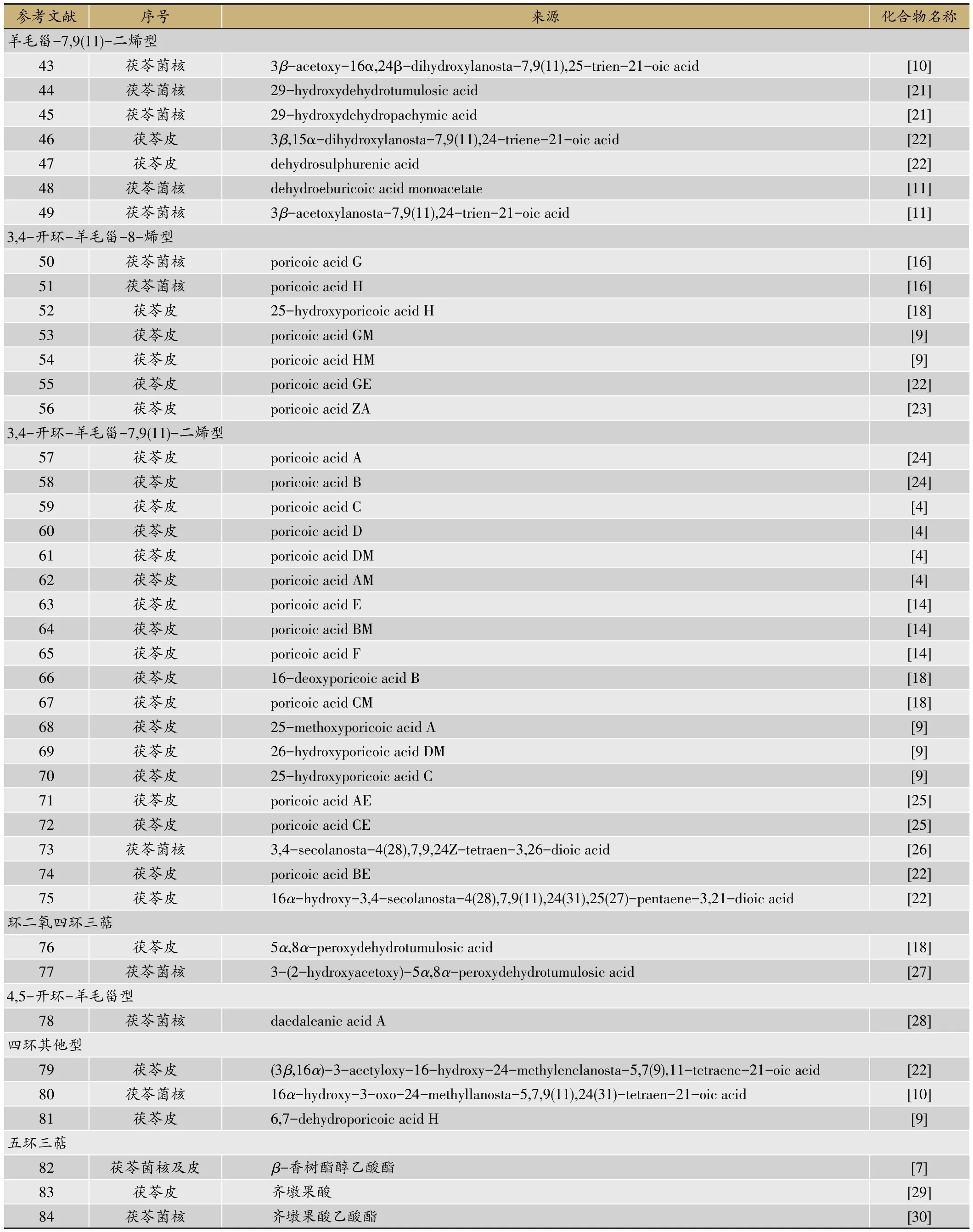
续表1
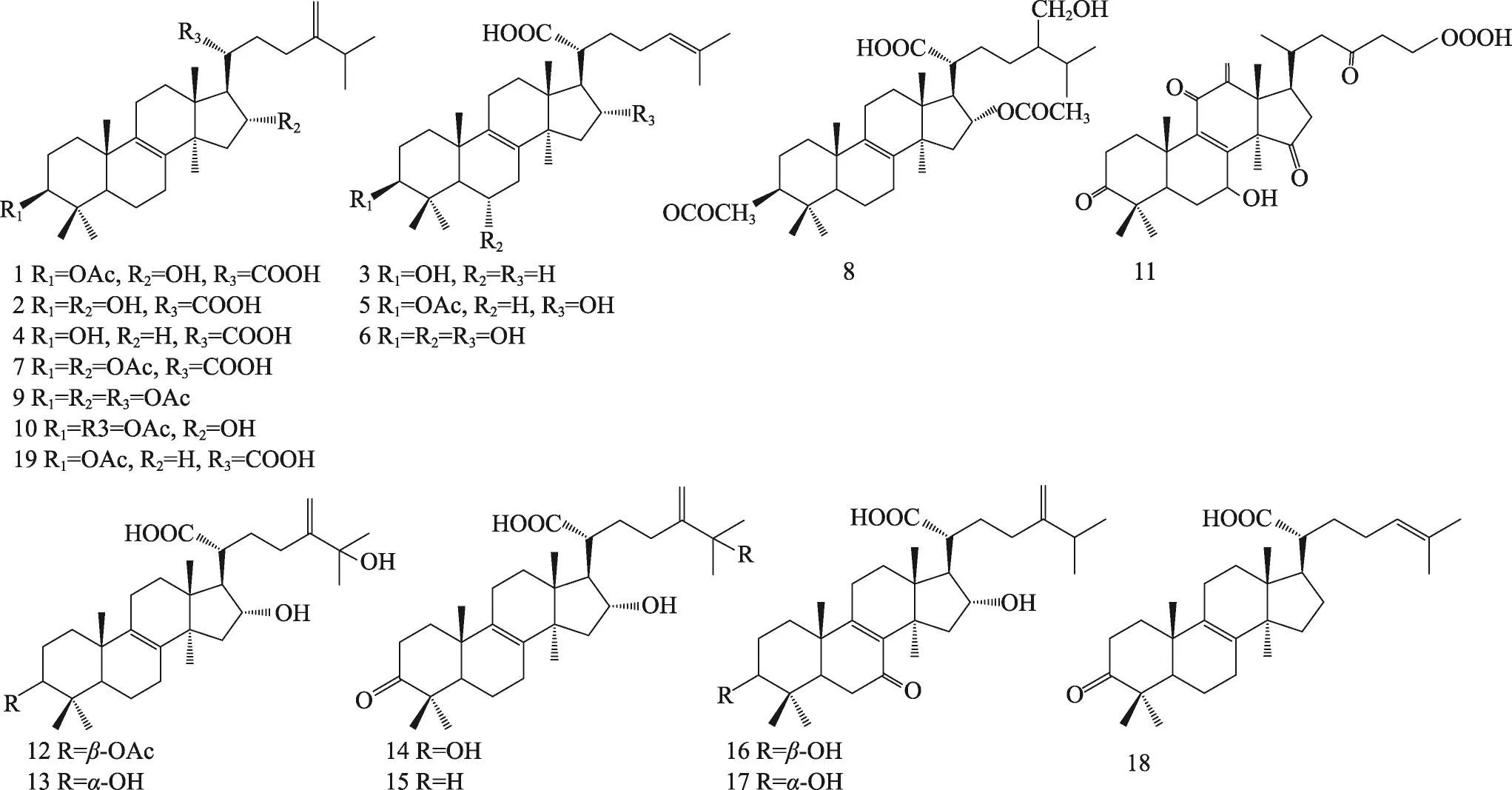
图1 茯苓中羊毛甾-8-烯型三萜类的结构
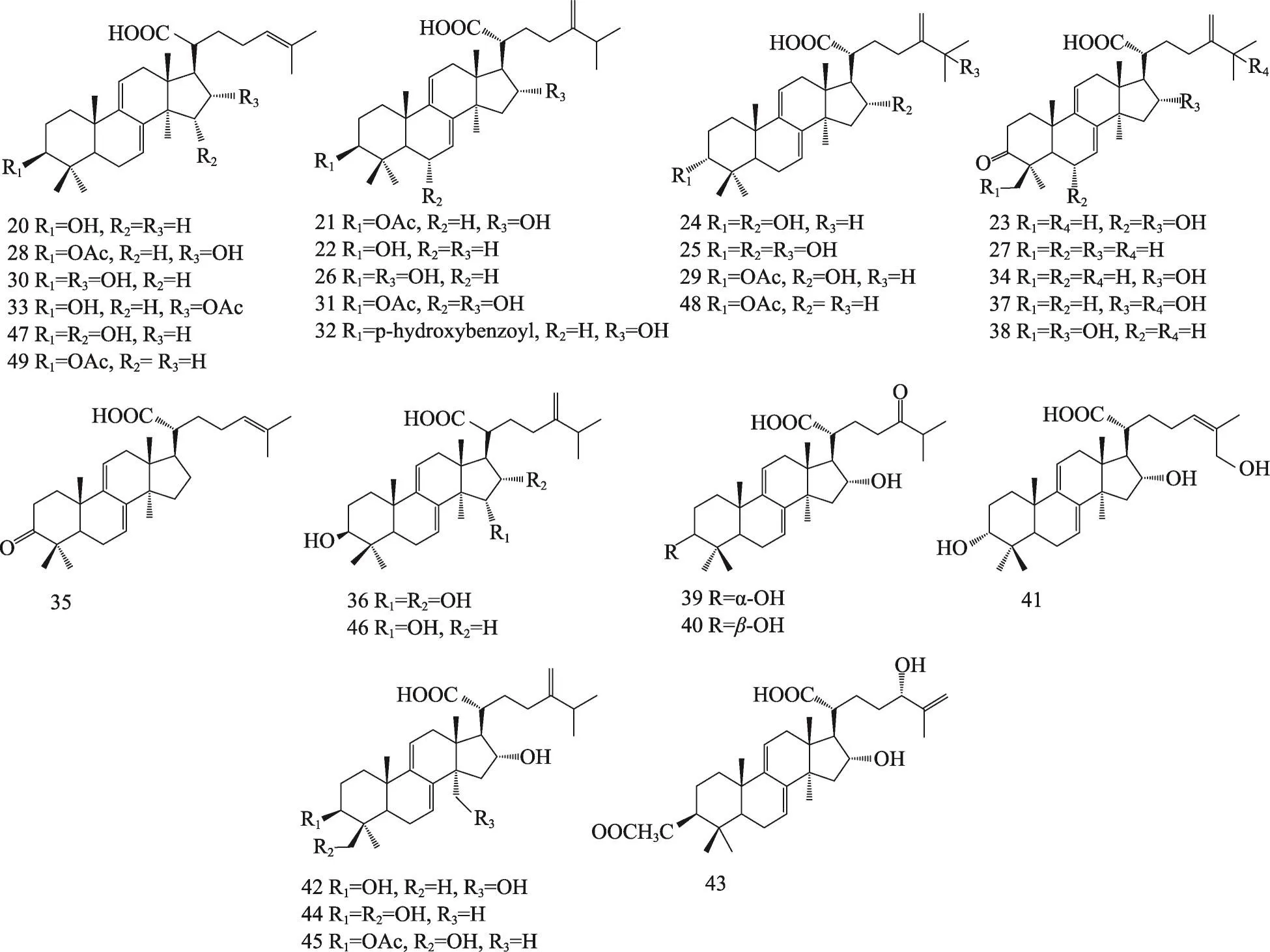
图2 茯苓中羊毛甾-7,9(11)-二烯型三萜类的结构
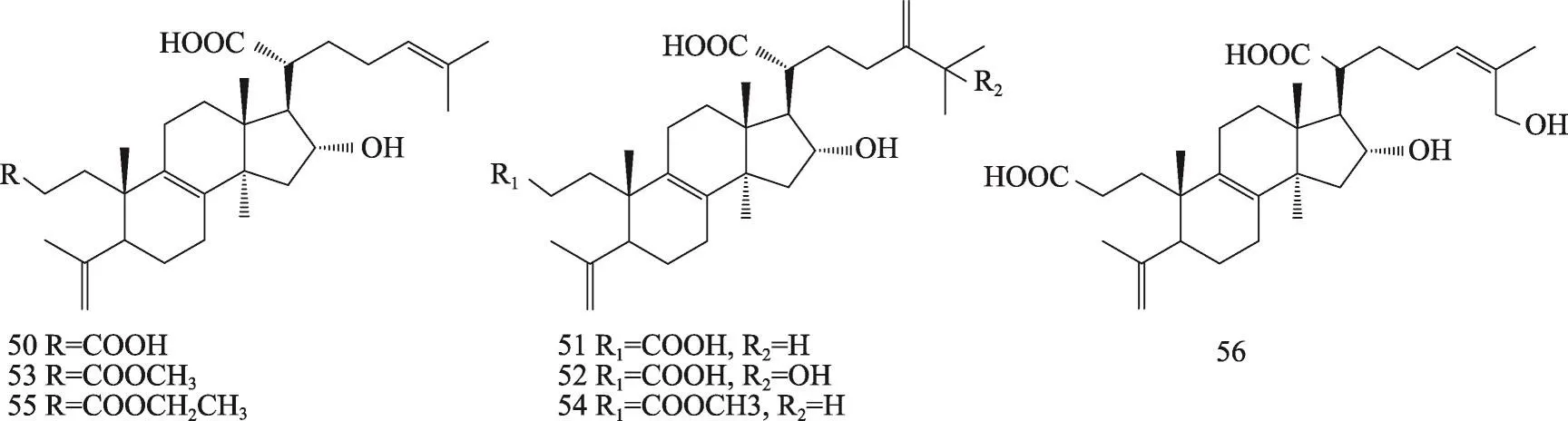
图3 茯苓中3,4-开环-羊毛甾-8-烯型三萜类的结构
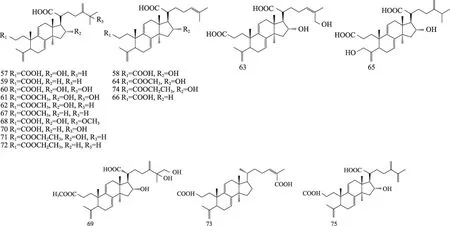
图4 茯苓中3,4-开环-羊毛甾-7,9(11)-二烯型三萜类的结构
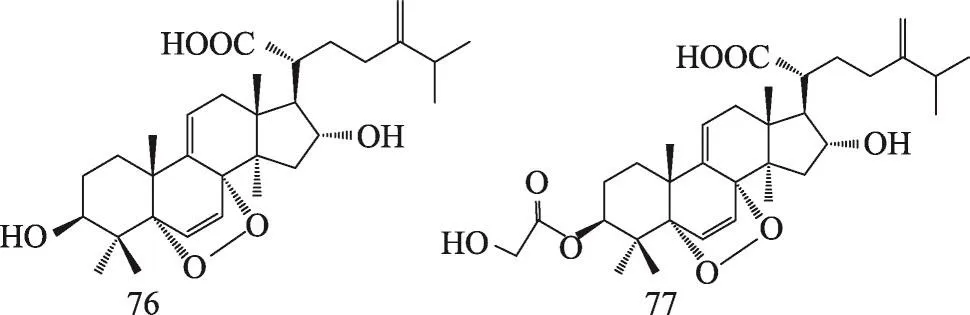
图5 茯苓中环二氧四环三萜型三萜类的结构
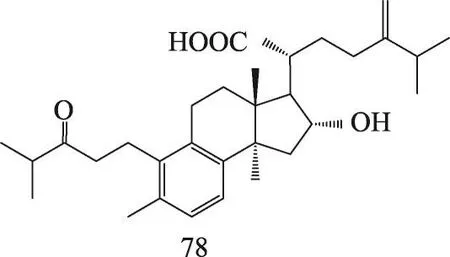
图6 茯苓中4,5-开环-羊毛甾型三萜类的结构

图7 茯苓中四环其他型三萜类的结构
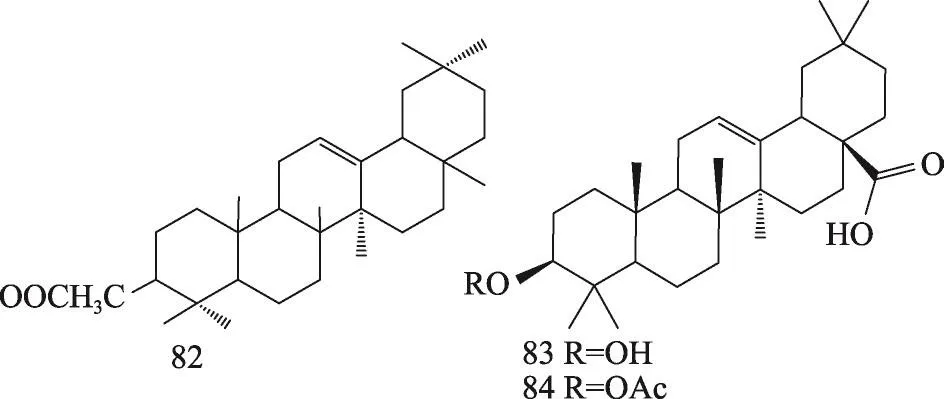
图8 茯苓中五环三萜类的结构

图9 茯苓中的二萜类的结构
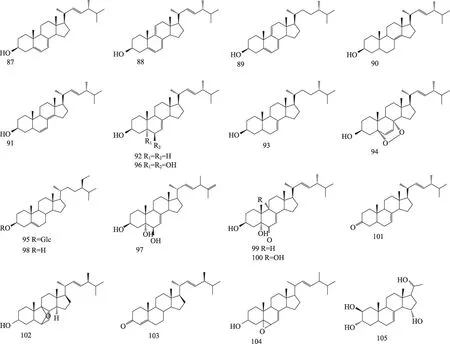
图10 茯苓中甾醇类的结构
1.3 甾醇类化合物
Yaoita等[31]从茯苓菌核中分离得到7个甾醇类化合物,它们分别为ergosterol(87),(22E)-ergosta-5,7,9(11),22-tetraen-3β-ol(88),ergosta-5,7-dien-3β-ol(89),(22E)-ergosta-8(14),22-dien-3β-ol(90),(22E)-ergosta-6,8(14),22-trien-3β-ol(91),(22E)-ergosta-7,22-dien-3β-ol(92),ergost-7-en-3β-ol(93)。Li等[32]从茯苓菌核分离得到ergosterol peroxide(94)。胡斌等[33]从茯苓块中分离得到daucosterol(95)。王帅等[34]从茯苓菌核中分离得到cerevisterol(96)。杨丹[35]等从茯苓皮中分离得到biemnasterol(97)和β-sitosterol(98)。杨鹏飞等[30]从茯苓菌核中分离得到3β,5α-dihydroxy-ergosta-7,22-dien-6-one(99),3β,5α,9α-trihydroxy-ergosta-7,22-diene-6-one(100),ergosta-7,22-diene-3-one(101),6,9-epoxy-
ergosta-7,22-diene-3-ol(102),ergosta-4,22-diene-3-one(103),ergosta-5,6-epoxy-7,22-dien-3-ol(104)。Chen等[36]从茯苓菌核中分离得到pregn-7-ene-2β,3α,15α,20-tetrol(105)。
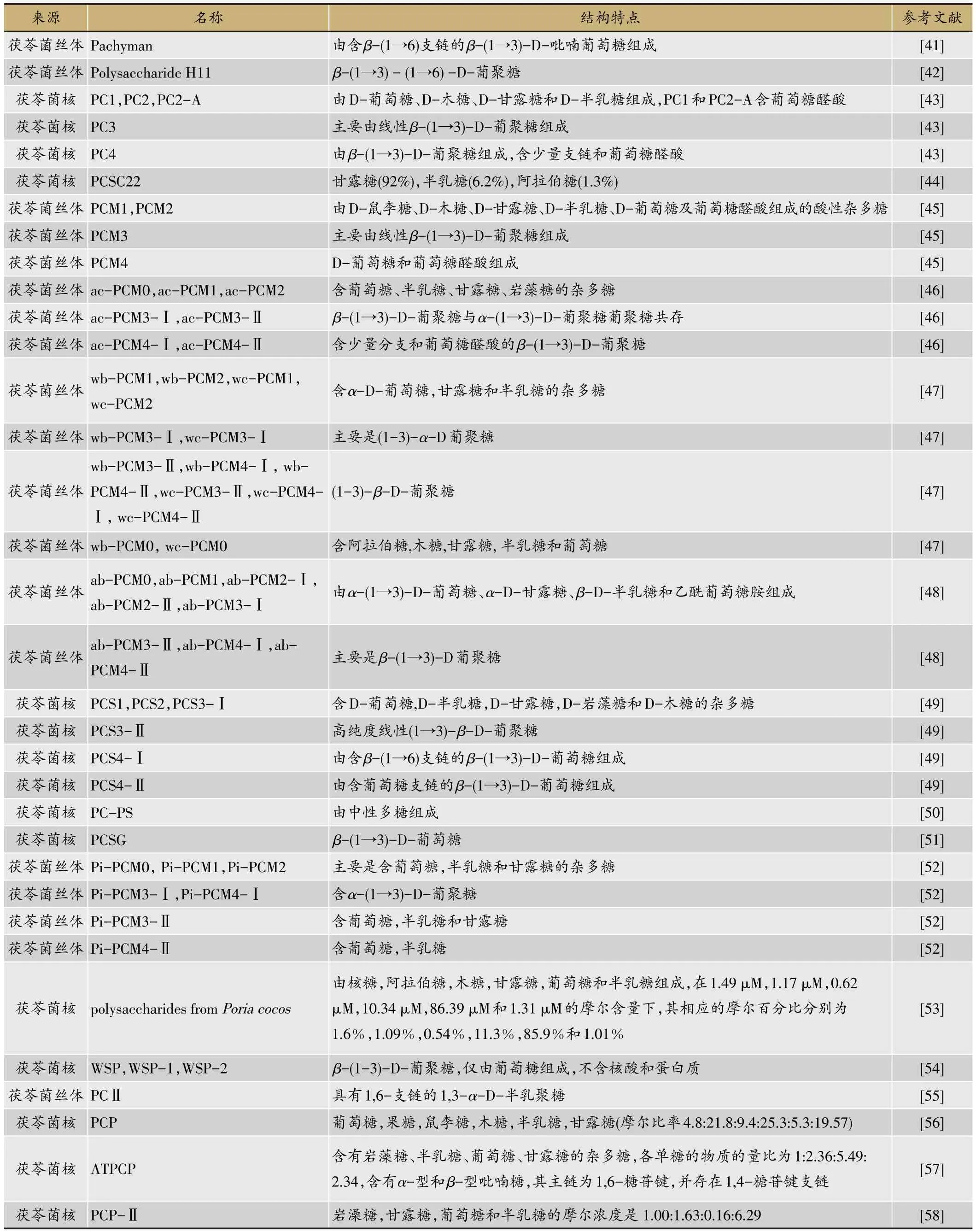
表2 茯苓的多糖类成分
1.4 其他类化合物
从茯苓中还分离得到了氨基酸、脂肪酸等其他类化合物,包括(S)-(+)-turmerone[32],乙基-β-D-吡喃葡萄糖苷、L-尿苷、柠檬酸三甲酯、(R)-苹果酸二甲酯[33],octadecanoic acid、triacontanol、octacosyl acid、pentacosanoic acid[35],(5-formylfuran-2-yl)methyl 2-hydroxypropanoate、(5-formylfuran-2-yl)methyl 2-(4-hydroxyphenyl)acetate、5-hydroxymethylfurfural(3S,6S)-3-[(1R)-1-hydroxyethyl]-6-(phenylmethyl)-2,5-piperazinedione,thymine和adenosine[36],2,4,6-triacetylenic octane diacid、2,4,5,6-tetrahydroxyhexanoic acid、3,4-dihydroxy-2-keto-n-butyl 2,4,5,6-tetrahydroxyhexanate[37],邻苯二甲酸二(2-乙基-己基)酯、邻苯二甲酸二丁酯[38],酪氨酸、苯丙氨酸、3-吲哚乙醇[39],亚油酸[40],核糖醇、甘露醇[30]。
1.5 多糖类化合物
茯苓中的多糖是茯苓的主要成分,含量约占茯苓干燥菌核的80%左右,包括水溶性多糖和碱溶性多糖。近年来分离得到的多糖及其结构特点(表2)。
1.6 结构改造多糖
茯苓中含有的水溶性多糖没有毒副作用,但含量低,而酸性多糖含量高,但水溶性小或不溶于水。为了充分利用茯苓多糖,有必要对茯苓多糖进行结构改造,以增强茯苓多糖的水溶性和生物活性,提高其临床应用价值。目前,获得的茯苓多糖衍生化产物主要有:羧甲基化茯苓多糖(CMP)[59],硫酸化茯苓多糖(SP)[60],磷酸化茯苓多糖(P-PCS3-II)[61],羧甲基化硫酸化多糖(CS-PCS3-Ⅱ)[62],阿魏酸茯苓多糖(FP)[63]等。
2 生物活性
现代研究表明,茯苓具有抗肿瘤,免疫调节,抗炎,抗氧化,抗衰老,提高记忆力,调节泌尿系统,降血糖,降血脂,镇静,催眠,保肝等生物活性。其主要活性成分是三萜类和多糖。
2.1 抗肿瘤活性
迄今为止,大量文献报道茯苓具有抗肿瘤活性,三萜类和多糖类成分都具有抗肿瘤活性,包括对白血病细胞,胃癌细胞,结肠癌细胞,乳腺癌细胞,膀胱癌细胞,肺癌细胞,肉瘤细胞,肝癌细胞等。
Bian等[54]采用酶解法从茯苓多糖中获得水溶性多糖WSP、WSP-1和WSP-2,研究发现WSP、WSP-1和WSP-2在体内外都能对肉瘤S180表现出抗增殖效应,且效果优于对照组羧甲基茯苓多糖。Cheng[64]等报道硫酸化茯苓多糖(SPSs)能协同阿霉素(DOX)的细胞毒性增强50倍。Chen等[62]研究发现引入羧甲基和硫酸基团的CS-PCS3-Ⅱ在0.15 mol·L-1NaCl溶液中作为扩展柔性链存在,与PCS3-Ⅱ相比,在BALB/c小鼠体内表现出更强的抗肿瘤作用,给予CS-PCS3-Ⅱ治疗,可使小鼠免疫功能增强,通过调节免疫产生抗肿瘤活性;用CS-PCS3-II处理的肿瘤细胞的显微镜检查显示肿瘤细胞有坏死和凋亡的迹象,并且提高了脾脏的免疫能力。
DNA拓扑异构酶是抗癌药物的作用靶点,化疗药物对细胞发挥细胞毒性作用的一个重要机制就是抑制DNA拓扑异构酶活性。Li等[32]研究发现化合物1、2、21对人结肠癌细胞HT-29表现出温和的细胞毒性,其IC50值分别为20.5,29.1和10.4 μmol·L-1;以上3种化合物和化合物34能抑制DNA拓扑异构酶Ⅱ和DNA拓扑异构酶Ⅰ的活性。Ling等[65]研究发现化合物1通过下调MMP-9的表达,抑制乳腺癌细胞的侵袭,有希望用于肿瘤转移干预,其作用机制为化合物1通过阻止上游信号IkB激酶IKK的磷酸化,实现P65核移位减少,导致NF-kB反式激活减弱,最终实现抑制佛波酯(PMA)诱导的NF-kB信号传导途径。He等[66]研究发现8种三萜类化合物(化合物1、20、26、34、57、58、62、64)能增强长春新碱对耐药KBV200细胞的细胞毒性,化合物26的逆转效果最佳,它通过抑制P-gp的药物外排功能而不影响其表达,从而增加细胞内积累和保留的抗肿瘤药物,对多要耐药性表现出良好的逆转效果。Ma等[67]研究发现化合物1在NCI-H23和NCIH460肺癌细胞中表现出抗肿瘤效应,伴随着诱导G2/M期阻滞和细胞凋亡,其作用机制可能是化合物1诱导活性氧(ROS)产生,导致肺癌细胞中c-Jun N端激酶(JNK)和内质网(ER)应激凋亡途径的活化,从而诱导细胞凋亡。此外,化合物1抑制NCI-H23异种移植肿瘤的生长而不引起任何宿主毒性,并在肿瘤异种移植组织中抑制肿瘤细胞的细胞增殖和诱导凋亡。
综上可知,茯苓主要通过抗增殖,细胞毒作用,抑制DNA拓扑异构酶活性,抗侵袭,逆转细胞耐药性,诱导细胞凋亡,阻滞细胞周期,免疫调节等方式发挥抗肿瘤作用。
2.2 免疫调节活性
目前有关茯苓免疫调节功能的研究主要集中在茯苓多糖,尤其是经过结构改造的茯苓多糖衍生物,其通过保护机体免疫器官,防止或减少胸腺萎缩、脾脏增大,激活T淋巴细胞、B淋巴细胞,增强NK细胞活性,调节IL-2、TNF-α等炎症细胞因子来调节机体的免疫力。
Wu等[58]从茯苓菌核中分离得到茯苓多糖(PCP-Ⅱ),研究发现与抗原和铝佐剂相比,PCP-II能够增强H1N1流感疫苗和HBsAg抗原的效应,诱导更好的体液和细胞免疫,可作为人和动物疫苗中的有效佐剂开发。陈群等[60]报道茯苓多糖硫酸酯PS在体外实验中,能显著提高自然杀伤细胞(NK)杀伤小鼠淋巴瘤细胞Yac-1的细胞活性(P<0.001)。Wang等[68]比较3种来自茯苓菌核β-(1→3)-D-葡聚糖的衍生物(S-P,CMP,S-CMP)在体内的免疫活性,研究发现在BALB/c小鼠中,S-CMP能显著增加血清溶血素抗体效价,促进脾脏抗体产生,增强迟发型超敏反应,表现出最佳的免疫活性,对植入的人肝癌细胞HepG2表现出最高抑制率。
茯苓中的三萜类化合物也具有免疫调节活性。谢健航等[69]报道茯苓总三萜(40、20、10 μg·mL-1)体外能减弱由LPS及ConA刺激小鼠脾细胞的代谢(增殖)活力,降低培养上清中IgG、IgM、IL-2、IFN-γ的水平;灌胃给药,茯苓总三萜(400、200、100 mg·kg-1)能降低体液免疫反应模型小鼠血清溶血素和IL-4的水平;大剂量(400 mg·kg-1)和中剂量(200 mg·kg-1)时,能减轻迟发性超敏反应小鼠耳廓肿胀度,降低脾脏指数,改善大鼠佐剂性关节炎模型的足趾肿胀度。
2.3 抗炎活性
目前研究认为在茯苓中,发挥抗炎活性的主要是三萜类化合物。茯苓通过抑制iNOS,COX-2等的表达,抑制NO、PGE2、IL-1、IL-6、TNF-α等炎症介质的产生,发挥抗炎作用。
Li等[70]研究发现化合物1降低LPS诱导的肿瘤坏死因子-α(TNF-α),白细胞介素-1(IL-1)和白细胞介素-6(IL-6)mRNA表达水平增加,也减弱LPS诱导的细胞凋亡,此外,LPS诱导的细胞中,细胞外信号调节激酶1/2和p38的磷酸化被抑制;通过抑制细胞外信号调节激酶1/2和p38途径,保护H9c2心肌细胞免受脂多糖诱导的炎症和凋亡的影响。Lee等[71]从茯苓菌核中分离得到5种化合物(化合物3、5、20、34、57)能抑制LPS刺激的Raw264.7细胞中NO产生和iNOS表达,其中化合物57表现出最高的抑制活性;并且化合物57通过下调COX-2蛋白的表达下调PGE2水平。
2.4 抗氧化和抗衰老活性
活性氧(ROS)如超氧阴离子(·O2-),羟基自由基(·OH)和过氧化氢(H2O2)来自人体正常的新陈代谢,可引发细胞膜脂质的过氧化作用,这些膜脂质的过氧化会引起各种疾病,如衰老,癌症以及心脏疾病等。丙二醛(MDA)是反应机体中自由基含量的指标,而抗氧化酶(如SOD,GPx)能清除机体内自由基。通过检测如上指标的水平有助于评估茯苓多糖和三萜的抗氧化活性。
Wang等[72]分别采用热水提法,超声提取法,酶提法以及微波提取法得到四种水溶性多糖PCPs,通过比较四种多糖的结构特点和抗氧化活性发现,具有较低中性糖含量、较高糖醛酸含量和较低分子量的多糖具有较好的抗氧化活性。
Cheng等[73]报道茯苓皮的甲醇粗提物中三萜类具有抗氧化活性,茯苓皮中三萜类物质能有效清除超氧化物阴离子自由基(·O2-)、羟基自由基(·OH)和过氧化氢(H2O2),IC50值分别为1.01,0.91和0.87 mg·mL-1,且清除力与浓度之间呈剂量依赖性;体外抗氧化试验表明:茯苓皮中的三萜类化合物可以抑制鸡红细胞溶血,对小鼠肝脏脂质过氧化作用产生的MDA有较好的清除作用,1.58 mg·mL-1的茯苓皮甲醇溶液具有最好的抑制效果。
Lee等[74]研究发现在人肺成纤维细胞WI-38细胞中,pachymic acid(1)可以通过调节与自噬有关的蛋白质,通过负调节胰岛素样生长因子1(IGF-1)信号传导途径和抑制老龄细胞中的mTor而诱导自噬,是能够诱导自噬以延缓衰老的有效化合物。
2.5 提高记忆力
茯苓自古以来就是治疗老年痴呆、记忆障碍的常用药,现代研究证明茯苓中的乙酸乙酯部分、石油醚部分、水提物、三萜以及多糖都参与了改善记忆。
Lin等[75]报道一次文献调研,在过去的10个世纪中,从古代药典,古代配方书籍或古代著名中医的历史档案中收集的236种痴呆干预的配方,使用频率最高的中草药是茯苓、远志、甘草、当归和地黄,其中茯苓的使用频率排名第一。
徐煜彬等[76]研究发现茯苓水煎液(生药8.56g·kg-1)、乙酸乙酯组分、石油醚组分、粗多糖组分及精制多糖组分均能改善学习记忆;茯苓改善学习记忆及镇静催眠作用与茯苓味甘入脾、健脾宁心有关,为甘味的作用,而茯苓拆分组分中的乙酸乙酯组分、石油醚组分及多糖组分都为其甘味的物质基础。β淀粉样蛋白(Aβ)被认为是驱动神经退行性疾病最重要的病理因素。Yu等[77]报道dehydropachymic acid(21)可以恢复溶酶体酸化并恢复受巴弗洛霉素A1损伤的自噬流,有效清除巴弗洛霉素A1损伤的PC12细胞中Aβ1-42的积累。
2.6 对泌尿系统的作用
传统中医认为茯苓具有利水渗湿的功效,可用于治疗水肿尿少等症,现代研究很好地解释了茯苓的这一传统功效。茯苓三萜类、多糖类以及粗提物都有一定的效果,其通过抑制肾素-血管紧张素系统,抑制细胞凋亡,抑制水和钠通道,调节水分平衡等方式调节泌尿系统。
Wang等[23]研究发现化合物56是一种新的肾素-血管紧张素系统(RAS)抑制剂,通过抑制RAS和TGF-β 1/Smad轴减轻管间质纤维化和足细胞损伤来治疗慢性肾病。Lee等[11]报道化合物48、49能够抑制LLCPK1肾小管上皮细胞中顺铂诱导的肾毒性,化合物48对肾脏的保护作用可能由其抗凋亡活性介导,与阻断MAPKs-caspase-3信号级联有关。
王司军等[78]研究发现茯苓水溶性多糖溶液灌胃(150 mg·kg-1)可有效预防泌尿系统结石的形成,其预防作用与茯苓水溶性多糖的利尿作用、升高尿镁含量和拟制氧化应激作用有关。
Lee等[79]研究发现茯苓菌核水提物(WPC)通过抑制经典的cAMP/PKA和近来TonEBP/Sgk1信号通路,阻止AQP2表达,调节肾脏水分平衡;此外,WPC通过抑制Bax和caspase-3的活化对肾脏表现出抗凋亡活性。Lee等[80]发现茯苓菌核水提物(WPC)(200 mg·kg-1·天-1)通过抑制蛋白尿和腹水来改善肾病综合征AQP2和ENaC的表达,通过抑制水和钠通道影响体液调节,改善肾脏失调如水肿或肾病。Yoon等[81]报道茯苓水提物能够调节高糖诱导的大鼠肾小球系膜细胞增殖,其作用机制可能与茯苓水提物通过抑制ROS-MAPK信号通路,诱导细胞周期停滞和激活抗氧化特性有关。
2.7 降血糖和降血脂活性
Chen等[36]研究发现化合物105能呈中等强度抑制α-葡萄糖苷酶活性,IC50值为591.29± 4.67 mg·L-1,化合物(3S,6S)-3-[(1R)-1-hydroxyethyl]-6-(phenylmethyl)-2,5-piperazinedione对α-葡萄糖苷酶的抑制较弱,IC50值为883.67±2.62 mg·L-1。Huang等[82]报道从茯苓菌核中分得的化合物1具有显著胰岛素样活性,能够刺激葡萄糖摄取,GLUT4基因表达和易位,诱导甘油三酯积累并抑制分化的脂肪细胞中的脂肪分解,具有治疗代谢综合征或糖尿病的潜力。Miao等[83]研究发现茯苓乙醇提取物(250 mg·kg-1BW)可显著改善高脂血症以及与之相关的脂质代谢物异常。
2.8 镇静、催眠
现有的活性研究中茯苓具有提高记忆力、镇静、催眠的功效,这与传统功效的宁心,主治心神不安、惊悸失眠等相契合。
Shah 等[84]报道化合物 1(1 mg·kg-1,3 mg ·kg-1,5 mg·kg-1)可增强戊巴比妥的催眠作用,这种增强催眠作用可能是通过介导γ-氨基丁酸(GABAA)-能系统来实现的。Gao等[85]研究发现茯苓总三萜具有显着的抗癫痫作用,并能调节大脑中γ氨基丁酸(GABA)和谷氨酸(Glu)的含量,以及GAD65和GABA的表达,其LC50高于6 g·kg-1。
2.9 保肝
何绮微等[86]报道茯苓具有抗肝纤维化作用,其机制可能与茯苓能下调TGFβ1及PDGF表达、抑制HSC增殖活化、促进细胞外基质降解、减少肝纤维结缔组织沉积有关。张先淑等[87]给小鼠腹腔注射CCl4橄榄油溶液造模,以高、中、低剂量(180、90、45 mg·kg-1·天-1灌胃茯苓三萜,发现茯苓三萜能显著减轻小鼠肝损伤的程度。Wu等[88]报道在小鼠中,茯苓多糖可对抗对乙酰氨基酚(APAP)诱导的肝损伤,具有保肝作用,其基本分子机制与抑制肝细胞中NF-κB信号通路为基础的炎症反应和凋亡有关。
2.10 其他活性
此外,茯苓还具有杀线虫[37]、抗菌[89]、调节肠道菌群[90]、抗心脏和肾脏移植排斥[91,92]、抑制肠道平滑肌收缩[93]、抗过敏[94]、退黄疸[95]等活性。
3 小结
过去50年的研究显示,茯苓粗提物以及三萜类和多糖类具有多种药理活性,包括抗肿瘤、免疫调节、抗炎、抗氧化、抗衰老、增强记忆力、调节泌尿系统、降血糖、降血脂、镇静、催眠、保肝等,可见茯苓对人体健康发挥了至关重要的作用,具有开发为抗肿瘤、免疫调节、抗衰老、安神等药品和功能保健食品的潜力。
随着现代分析技术和药理学研究发展,发现多糖具有广泛的生物学功能,多糖的研究已成为国内外研究的热点。而茯苓多糖是茯苓中含有的主要次生代谢产物之一,占菌核干重的80%左右,含量大,安全性高,毒副作用少,具有巨大的研究开发空间。但茯苓多糖多数不溶于水,如何改进工艺,以获得水溶性好、生物活性高的茯苓多糖,以便于人体吸收利用,可作为今后研究的一个方向,从而最大限度地开发茯苓的应用价值。

