基于荧光猝灭法探究EGCG与β-酪蛋白的相互作用机制
曹云刚, 陈星怡, 齐梦恬, 李 颖, 赵倩倩
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
茶多酚(Tea Polyphenols)是茶叶中多酚类物质的总称,是目前应用最广泛的天然抗氧化剂之一,其主要活性成分是儿茶素类化合物(Catechin),约占茶多酚含量的75%~80%.儿茶素类化合物主要分为四种:表儿茶酚(epicatechin EC)、表没食子儿茶酚(epigallocatechin EGC)、表儿茶酚没食子酸(epicatechin gallate ECG)和表没食子儿茶酚没食子酸(epigallocatechin gallate EGCG)[1-3].
其中EGCG是 2-连苯酚基苯并吡喃与没食子酸形成的酯,结构中含有6个邻位酚羟基(如图1所示),是儿茶素中含量最高、抗氧化能力最强的组分.同时现有研究表明EGCG还具有抗菌、抗病毒、抗肿瘤、抗突变、降压、降脂、降血糖、防止消化道和呼吸道感染、预防和治疗癌症、抑制和预防心血管疾病等生理活性功能[4,5].因此,EGCG和其他儿茶素类化合物经常被用做功能性食品(如乳品和饮料等)的添加剂.
然而,研究发现儿茶素类物质在中性和碱性条件下非常不稳定,随着pH、温度和氧气浓度的升高,降解速度逐渐加快[6].EGCG 的氧化物和聚合物会产生一种不期望的黄绿色,诸如此类的不稳定性限制了EGCG在食品工业中的应用[7].如何提高EGCG在加热等过程中的稳定性是当前面临的挑战.
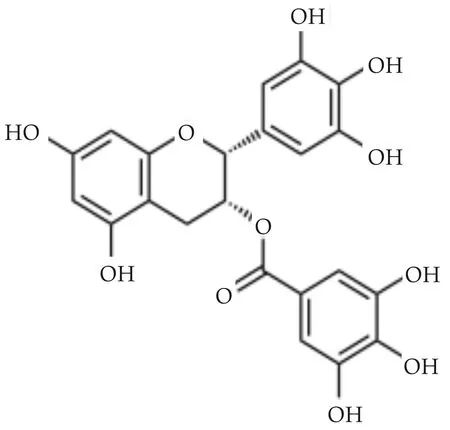
图1 EGCG结构示意图
酪蛋白是牛乳中含量最高的蛋白质,约占牛乳中总蛋白的80%左右,具有较高的营养价值和良好的加工性能.牛乳酪蛋白包含四种主要蛋白质:αs1-酪蛋白,αs2-酪蛋白,β-酪蛋白和κ-酪蛋白,这四种蛋白的摩尔比约为4∶1∶4∶1.3,在酪蛋白中的含量分别为:αs1-酪蛋白≥22%、αs2-酪蛋白≥5.5%、β-酪蛋白≥22%、κ-酪蛋白≥7.15%[7-9].这四种酪蛋白分子量接近(均约为24 kDa),并含有很大比例的脯氨酸残基.其中β-酪蛋白由209个氨基酸组成且不含二硫键,其相对灵活(松散、自然展开)的结构使得其对热更加稳定,且易于与其他物质结合[9].现有研究已经表明,β-酪蛋白可以与疏水性和双亲化合物如维生素D、槲皮素、白藜芦醇、黄酮、姜黄素和丹宁酸等相互作用,从而作为它们的天然纳米运载工具[7].蛋白质与多酚类物质相互作用受蛋白质和多酚结构、温度、pH等因素的影响,二者结合又会影响各自的功能特性及生物利用率.
因此,本研究采用荧光猝灭法探究不同温度下β-酪蛋白与EGCG的相互作用机制,以期为合理控制食品加工条件改善EGCG的稳定性、科学设计天然活性组分的蛋白纳米载体等提供参考.
1 材料与方法
1.1 材料与仪器
(1)主要材料与试剂:β-酪蛋白(≥98%),Sigma-Aldrich公司;EGCG(>98%),上海纯优生物科技有限公司;磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸,天津市天力化学试剂有限公司;纯净水,娃哈哈集团.
(2)主要仪器设备:PHS-25型数显pH计,上海仪电科学仪器股份有限公司;微量移液器,赛多利斯科学仪器(北京)有限公司;DK-98-Ⅱ电热恒温水浴锅,天津市泰斯特仪器有限公司; FS5荧光光谱仪,英国爱丁堡仪器公司;MIX-25P型迷你混合仪,杭州米欧仪器有限公司;TP-350S型智能磁力加热搅拌器,杭州米欧仪器有限公司.
1.2 实验方法
1.2.1 样品溶液的配置
β-酪蛋白存储液(10.0μmol/L):用20 mmol/L磷酸盐缓冲液(PBS,pH6.5)配制浓度为10.0μmol/Lβ-酪蛋白溶液,置于4 ℃冰箱中储存备用.
EGCG工作液(100.0μmol/L):用20 mmol/L磷酸盐缓冲液(PBS,pH6.5)配制浓度为100.0μmol/L EGCG溶液.用PBS溶液稀释出一系列浓度梯度的EGCG溶液:0、1μmol/L、2μmol/L、4μmol/L、10μmol/L、20μmol/L、40μmol/L、60μmol/L、80μmol/L和100μmol/L.所有EGCG溶液现配现用.
1.2.2 荧光猝灭分析
将不同浓度EGCG 溶液(0、1、2、4、10、20、40、60、80和100μmol/L)与β-酪蛋白溶液(10.0μmol/L)按照1∶1比例混合均匀(各2.5 mL),在不同温度(25 ℃、35 ℃和45 ℃)水浴中加热30 min后,迅速冷却至室温.最终混合液中,β-酪蛋白终浓度为:5.0μmol/L,EGCG终浓度梯度为:0、0.5μmol/L、1μmol/L、2μmol/L、5μmol/L、10μmol/L、20μmol/L、30μmol/L、40μmol/L和50μmol/L.同时将不同浓度EGCG 溶液(0、1、2、4、10、20、40、60、80和100μmol/L)与20 mmol/L磷酸盐缓冲液按照1∶1比例混合均匀(各2.5 mL)作为空白对照.参考范志飞等人描述的方法[10],在室温下利用荧光光谱仪记录混合液体和相应空白对照的荧光强度,设定激发波长为 280 nm,扫描波长为 300~500 nm,激发狭缝宽度为3.3 nm,发射狭缝宽度为2.0 nm.
2 结果与讨论
2.1 不同加热处理对β-酪蛋白内源荧光的影响
β-酪蛋白含有一个位于蛋白表面的色氨酸残基(Trp143),Trp143受激发后发射的荧光是β-酪蛋白内源荧光的主要来源[11].蛋白质最大内源荧光强度(Fmax)和对应的最大荧光发射波长(λmax)的变化可以间接反映蛋白构象的变化[12].
如表1所示,无EGCG存在时,不同温度处理对β-酪蛋白的Fmax和λmax具有不同的影响:与对照(25 ℃)相比,35 ℃处理几乎无影响;45 ℃处理30 min导致β-酪蛋白的Fmax升高约3.0%,同时λmax红移动约2 nm;这说明45 ℃处理30 min对β-酪蛋白中的Trp143残基的微环境产生了较为明显的影响,或者说该条件下处理使得β-酪蛋白中的Trp143残基的微环境变得更加亲水性或极性[7].加热温度对β-酪蛋白内源荧光的影响与其自身的结构变化以及β-酪蛋白自我缔合与解离行为有关:在低温(0~8 ℃)下,β-酪蛋白以单体的形式存在于溶液中;当温度高于20 ℃时,β-酪蛋白单体发生聚合和自我缔合;当温度高于90 ℃时,β-酪蛋白聚集体发生热解离[13].

表1 不同温度处理后β-酪蛋白的最大内源荧光强度(Fmax)和对应最大荧光发射波长(λmax)
2.2 β-酪蛋白-EGCG复合物的荧光猝灭
不同温度(25 ℃、35 ℃和45 ℃)下,β-酪蛋白与EGCG相互作用的荧光淬灭光谱如图2所示.从图2可以看出,随着 EGCG 浓度的增加,β-酪蛋白的荧光发射峰强度逐渐降低,当EGCG终浓度为 50μmol/L时,β-酪蛋白的荧光发射峰强度最低,由此可以推断EGCG 与β-酪蛋白生成了复合物,同时也改变了β-酪蛋白的空间结构[14]:与EGCG的结合导致β-酪蛋白的分子构象进一步展开,使得色氨酸残基(Trp143)暴露于更加亲水的环境中.不同温度下,EGCG对β-酪蛋白的荧光猝灭程度不同,比如,当EGCG终浓度为 50μmol/L时,荧光猝灭率分别为77.8%(25 ℃)、76.5%(35 ℃)和84.6%(45 ℃),说明温度升高增强了EGCG与β-酪蛋白之间的相互作用.与本实验结果类似,He等[7]研究发现随着温度的升高EGCG对β-酪蛋白的荧光猝灭作用增强.

(a)25 ℃下EGCG对β-酪蛋白的荧光猝灭光谱
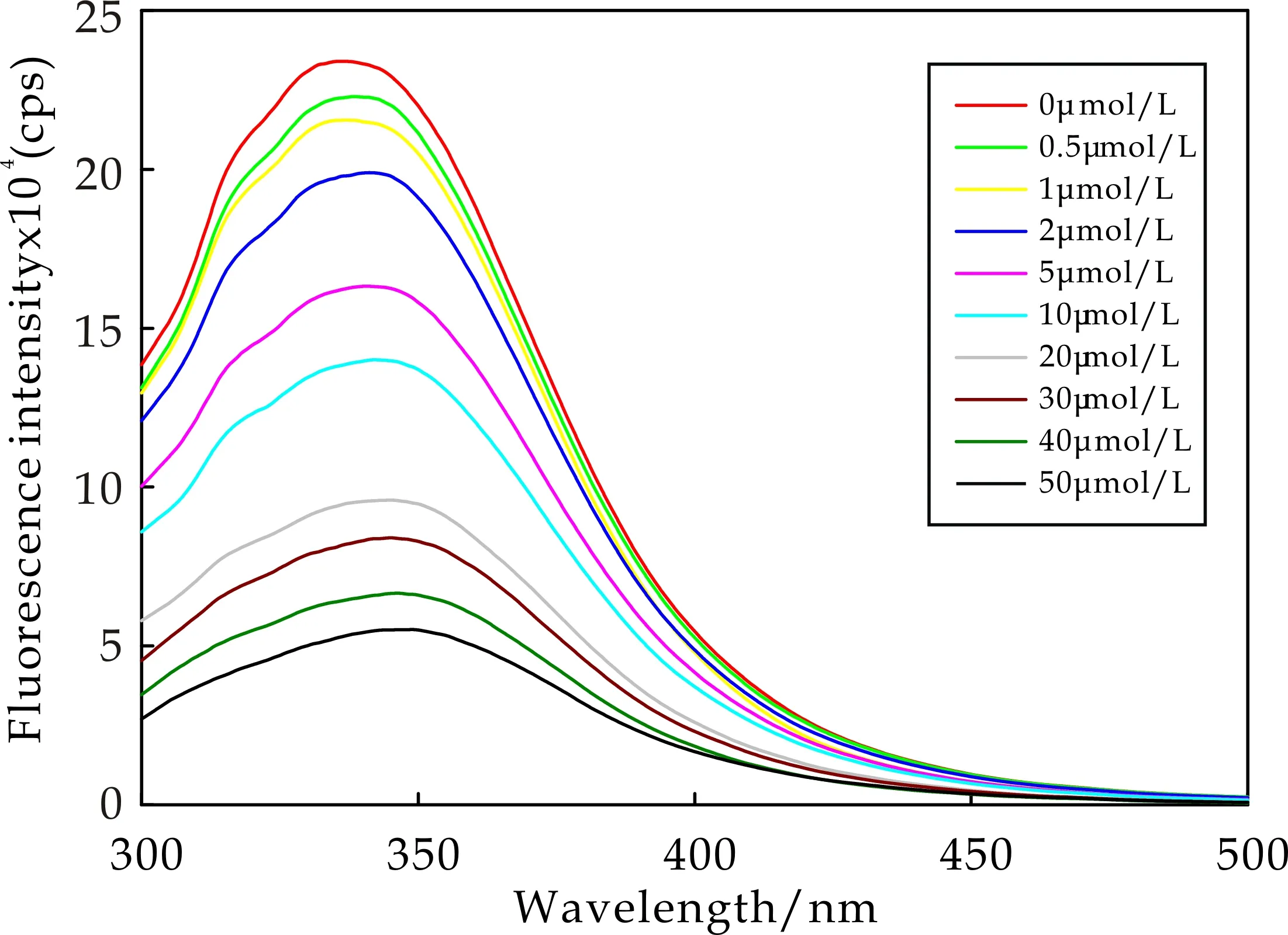
(b)35 ℃下EGCG对β-酪蛋白的荧光猝灭光谱

(c)45 ℃下EGCG对β-酪蛋白的荧光猝灭光谱图2 EGCG对β-酪蛋白的荧光猝灭光谱
荧光猝灭反应的类型主要有:动态猝灭与静态猝灭[15].无论EGCG对β-酪蛋白的荧光猝灭是一个动态猝灭或者静态猝灭过程,均可根据Stern-Volmer 方程(1)计算其双分子荧光猝灭速率常数(Kq),据此可判定其猝灭类型.
F0/F=1+Kqτ0c(EGCG)=1+
KSVc(EGCG)
(1)
式(1)中:F0和F分别为EGCG加入前后β-酪蛋白荧光发射峰的强度;Kq为双分子猝灭速率常数(L/(mol·s));τ0为不存在荧光猝灭剂时的荧光寿命(对于生物大分子来说τ0=10-8s-1)[16];c(EGCG)是荧光猝灭剂EGCG的浓度(mol/L).KSV是Sterne-Volmer 动态猝灭常数(L/mol),可以通过F0/F对c(EGCG)做线性回归,其线性部分的斜率即为KSV.
根据方程式(1),对于单一的动态猝灭或静态猝灭过程,以β-酪蛋白与EGCG作用前后荧光发射峰的强度变化F0/F对荧光猝灭剂浓度c(EGCG)为轴制作散点图并算出趋势线方程,方程的斜率代表Sterne-Volmer 动态猝灭常数KSV.
图3为不同温度(25 ℃、35 ℃和45 ℃)下β-酪蛋白与不同浓度EGCG相互作用的荧光发射峰的强度F0/F-c(EGCG) 曲线.从图3可以看出,F0/F-c(EGCG)呈线性关系,随着温度升高荧光猝灭曲线的斜率增加,并且可以计算出25 ℃、35 ℃ 和45 ℃ 下双分子猝灭速率常数Kq分别为0.664×1013L/(mol·s)、0.629×1013L/(mol·s)和0.945×1013L/(mol·s).
一般情况下,生物大分子的双分子荧光动态猝灭速率常数Kq小于2×1010L/(mol·s),由此可以判断 EGCG对β-酪蛋白的荧光猝灭是由于 EGCG 与β-酪蛋白形成了复合物而引起的静态猝灭,是通过荧光基团(Trp143)与荧光猝灭剂(EGCG)之间形成了一个复杂的循环[17,18].不同温度下EGCG对β-酪蛋白的双分子猝灭速率常数Kq的变化与温度诱导的β-酪蛋白构象变化等有关.
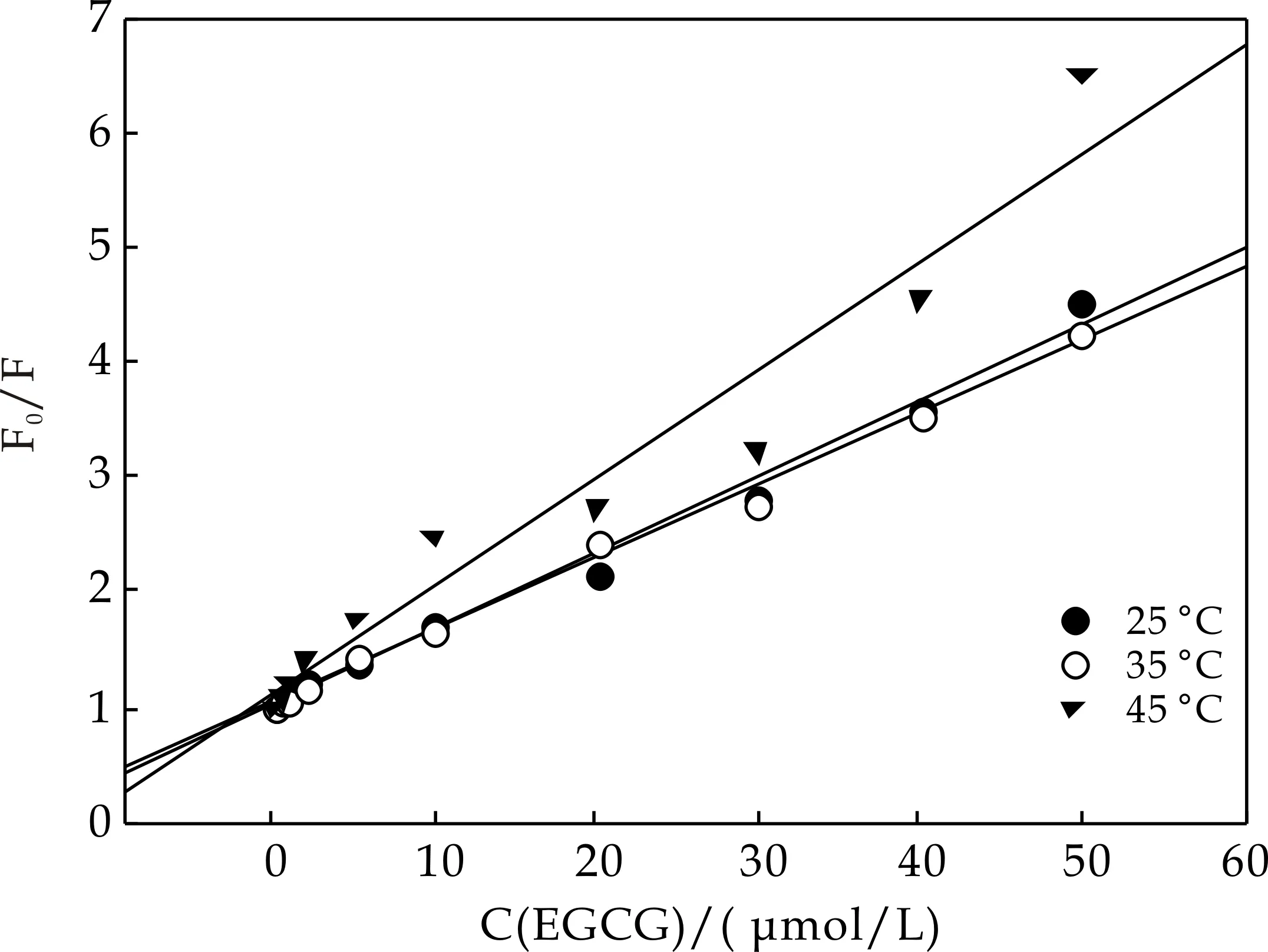
图3 不同温度下EGCG对β-酪蛋白荧光猝灭的Stern-Volmer曲线
2.3 EGCG与β-酪蛋白的表观结合常数及结合位点数
由于EGCG对β-酪蛋白的荧光猝灭主要是静态猝灭,其结合常数(KA)和结合位点数(n)可通过公式(2)计算得出:
lg[(F0-F)/F]=lgKA+nlgc(EGCG)
(2)
式(2)中:F0和F分别为EGCG加入前后β-酪蛋白荧光发射峰的强度;KA为结合常数;n为结合位点数;c(EGCG)为EGCG浓度(mol/L).
以lg[(F0-F)/F]对lgc(EGCG)作图,本实验范围内呈线性关系,因而拟合直线的斜率为结合位点数(n),截距为结合常数(KA),计算结果见表2.
由计算结果可知,EGCG与β-酪蛋白的结合常数达104数量级,并形成一个结合位点.在25 ℃温度条件下二者之间就能较好的结合,温度升高有利于二者之间的结合.朱美霖等[14]在研究EGCG与人血清白蛋白(HSA)相互作用时也得到了类似的实验结果.
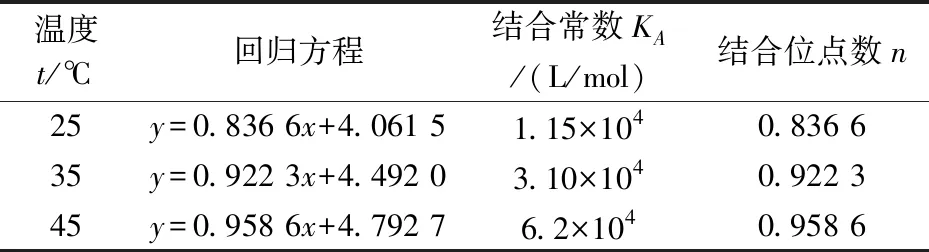
表2 不同温度下EGCG 与β-酪蛋白的结合常数(KA)和结合位点数(n)
2.4 EGCG 与 β-酪蛋白的主要作用力类型
生物大分子与小分子的作用力类型一般包括:氢键、范德华力、静电引力和疏水作用力这四种[19].根据不同温度下的热力学参数:焓变ΔH、自由能变化ΔG和熵变ΔS等,可以判断EGCG与β-酪蛋白的主要作用力类型.
在温度变化范围不大时,ΔH 可看作是常数,由热力学参数方程(3,4)可以计算出EGCG和β-酪蛋白在不同温度下相互作用的热力学参数值,结果见表3所示.
ln(K2/K1)=(1/t1-1/t2)ΔH/R
(3)
ΔG=ΔH-tΔS=-RtlnK
(4)
式(3)、(4)中:K1,K2分别为不同温度下EGCG与β-酪蛋白的结合常数(KA);t1,t2分别为不同温度,单位为K;R为气体常数,R=8.314J/(mol·K);ΔH为焓变;ΔG为自由能变化;ΔS为熵变.

表3 不同温度下EGCG与β-酪蛋白结合过程的热力学参数
ΔG为吉布斯自由能,是在某一个热力学过程中,系统减少的内能中可以转化为对外做功的部分.当ΔG<0时反应自发;ΔG>0时反应逆方向自发;ΔG=0时反应平衡[20].从表3可以看出,EGCG与β-酪蛋白的复合物在形成过程中的ΔG<0,说明结合过程是一个自发过程.生物大分子与小分子作用力类型的热力学规律为:(1)ΔS>0的情况下作用力类型可能是疏水作用力与静电作用力;(2)ΔH>0同时ΔS>0的情况下作用力类型为疏水作用力;(3)ΔH<0的情况下作用力类型主要为静电相互作用[19].根据此规律并结合上述结果分析可知,该体系中EGCG与β-酪蛋白之间的作用力是以疏水作用力为主.由于ΔH 采用荧光猝灭法研究了不同温度下β-酪蛋白与EGCG之间的相互作用,研究结果表明: EGCG与β-酪蛋白发生了静态荧光猝灭,形成了β-酪蛋白-EGCG复合物;当温度为25 ℃、35 ℃和45 ℃时,其双分子猝灭速率常数Kq分别为0.664×1013L/(mol·s)、0.629×1013L/(mol·s) 和0.945×1013L/(mol·s),结合位点数分别为0.836 6、0.922 3与0.958 6.热力学参数分析结果显示EGCG 与β-酪蛋白形成复合物的过程中ΔG<0,说明该结合过程是一个自发过程,ΔH>0且ΔS>0说明EGCG与β-酪蛋白之间的作用力是以疏水相互作用为主.3 结论

