基于SIRT1/FoxO1通路研究白背三七总黄酮对糖尿病肝损伤大鼠的保护作用*
金铁峰
浙江中医药大学第二临床医学院 浙江 杭州 310053
糖尿病对肝脏的损害临床最常见的表现为非酒精性脂肪肝病(NAFLD)。沉默信息调节因子1(SIRT1)和叉头转录因子(FoxO1)在NAFLD演变中起着重要的作用,研究发现,SIRT1/FoxO1信号通路与改善机体胰岛素敏感性、调节肝脏脂质代谢、抗氧化应激及抗炎等作用紧密相关。本研究拟用链脲佐菌素(STZ)造成的2型糖尿病(T2DM)模型大鼠研究白背三七总黄酮对SIRT1/FoxO1通路的干预作用,并探讨白背三七总黄酮对糖尿病肝损伤的保护作用及其可能机制。
1 材料和方法
1.1 动物及饲料:清洁级(SPF)雄性SD大鼠40只,体重180~220g,购自上海西普尔-必凯动物有限公司,许可证号:SCXK(沪)2013-0016,饲养于浙江中医药大学动物实验中心。常规饲料由浙江省医学科学院提供。高糖高脂饲料由1O.0%白砂糖、10.0%熟猪油、0.5%胆固醇、1O.0%蛋黄粉及69.5%基础饲料组成,由浙江省医学科学院制作成型及烘焙而成。
1.2 药物及试剂:白背三七,由浙江名中医馆提供。白背三七总黄酮(黄酮质量分数为51.3%)由浙江中医药大学动物实验中心制备。链脲佐菌素(STZ)(美国Sigma公司,批号B64927)。抗S1RT1抗体(Abcam公司);抗FOXO1抗体(Santa Cruz公司);抗Ac-FOXO1抗体(Santa Cruz公司)。
1.3 糖尿病模型复制:适应性喂养1周后,随机选取6只作为正常对照组,给予普通饲料喂养。其余大鼠作为实验组:高糖高脂饲料喂养4周,诱发胰岛素抵抗。禁食10h后,将2%链脲佐菌素溶液按30mg/kg腹腔注射。72h后采用尾静脉采血的方法测量血糖,持续3d的血糖浓度>16.7mmol/L证明T2DM模型大鼠造模成功。
1.4 分组与给药:将造模成功的24只大鼠随机分为模型组、白背三七总黄酮低(30mg/kg)、中(60mg/kg)、高(120mg/kg)剂量组,每组6只。正常对照组给予普通饲料喂养,实验组继续给予高糖高脂饲料。各给药组大鼠按每次lml/100g体质量的容量灌胃给药。正常对照组和模型组给等体积的生理盐水,每日1次,连续8周。
1.5 标本的采集:在用药8周末,大鼠禁食不禁水12小时后称重,以1.0mg/kg 10%水合氯醛腹腔注射麻醉,心脏穿刺抽血,静置30min后,以3000r/min离心10min,分离血清(用于检测血糖、血脂、胰岛素水平及肝功能指标),-20℃保存。分离肝脏,取部分组织固定于10%中性甲醛溶液中以备光镜观察,再取部分肝脏快速液氮冷冻,用于SIRT1、FoxO1及乙酰化的FoxO1(Ac-FoxO1)蛋白含量的检测。
1.6 血清生化指标测定:采用全自动生化分析仪测定空腹血糖(FBG)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、甘油三酯(TG)。
1.7 肝组织病理变化:肝脏组织常规固定脱水、透明、包埋、切片,行苏木素一伊红(HE)染色,光镜下观察肝脏病理形态学改变。
1.8 Western-blot法检测肝脏组织中Sirt1、FoxO1、Ac-FoxO1蛋白的表达:用二喹啉甲酸(BCA)比色法蛋白定量试剂盒检测各组样品蛋白浓度。在电泳加样孔内加入等量蛋白质,10%Bis/Tris凝胶分离蛋白,并用湿转法将蛋白转移到PVDF膜上。用TBST(150mM NaC1,50mM Tris,0.1%Tween-20,pH 7.5)稀释的5%脱脂牛奶封闭PVDF膜2h,孵育抗SIRT1(1:500稀释)、FOXO1(1:1000稀释)、Ac-FOXO1(1:1000稀释),4℃过夜;用TBST洗涤3次;室温孵育对应的二抗(1:5000稀释)1.5h;用TBST洗涤3次。使用BioRad成像系统检测蛋白质条带并使用Image Lab软件定量。
1.9 统计学方法:采用SPSS 19.0软件处理数据。结果以±s表示,两样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清生化指标改变情况:见表1。
表1 白背三七总黄酮对DM大鼠FBG、ALT、AST和TG的影响(±s,n=6)

表1 白背三七总黄酮对DM大鼠FBG、ALT、AST和TG的影响(±s,n=6)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
TG(mmol/L)0.23±0.06 2.36±0.77*1.79±0.75#1.55±0.65#1.41±0.64#组别正常对照组模型组低剂量组中剂量组高剂量组FBG(mmol/L)5.16±1.08 25.12±6.13*25.24±5.99#25.03±4.61#24.20±3.78#ALT(U/L)50.35±6.66 173.55±89.57*121.75±43.97#111.30±30.15#109.75±14.45#AST(U/L)128.95±21.63 195.50±83.55*149.20±60.46#133.50±45.97#130.70±41.21#
2.2 各组大鼠肝脏组织病理形态学改变:根据HE染色显示,正常对照组大鼠肝小叶轮廓清晰完整,肝细胞形态正常;模型组大鼠肝细胞呈明显脂肪变,局灶性坏死,坏死区和汇管区可见程度不一的炎症细胞浸润,部分细胞核变型和核偏位;白背三七总黄酮高、中、低剂量组肝细胞病变程度显著轻于模型对照组,其中高剂量组最明显。
2.3 各组大鼠肝脏组织SIRT1、FoxO1及Ac-FoxO1蛋白蛋白表达的变化:见表2、图1。
表2 白背三七总黄酮对DM大鼠肝脏组织SIRT1/FoxO1通路的影响(±s,n=6)
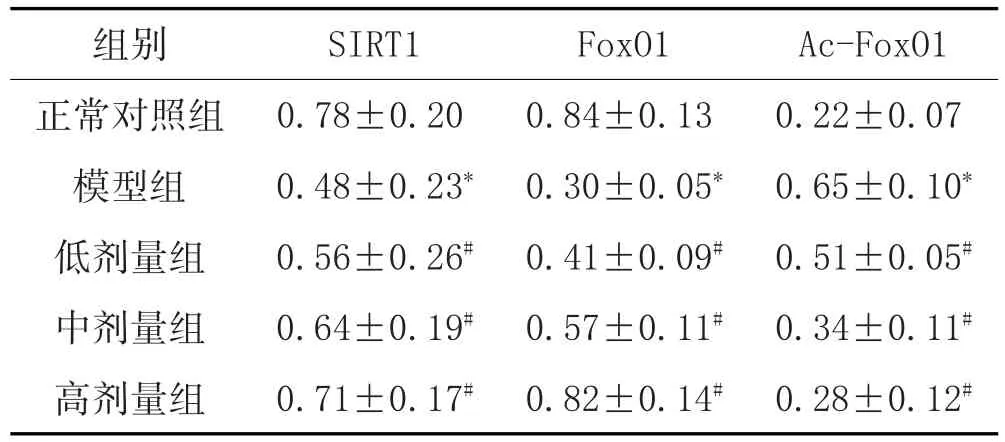
表2 白背三七总黄酮对DM大鼠肝脏组织SIRT1/FoxO1通路的影响(±s,n=6)
Ac-FoxO1 0.22±0.07 0.65±0.10*0.51±0.05#0.34±0.11#0.28±0.12#组别正常对照组模型组低剂量组中剂量组高剂量组SIRT1 0.78±0.20 0.48±0.23*0.56±0.26#0.64±0.19#0.71±0.17#FoxO1 0.84±0.13 0.30±0.05*0.41±0.09#0.57±0.11#0.82±0.14#
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。

图1 Western blot法检测SIRT1、FoxO1及Ac-FoxO1蛋白的表达
3 讨论
NAFLD的发病机制,主流观点支持“多重打击”学说[1],第一重打击主要是胰岛素抵抗(IR),它可促使外周脂解增加和高胰岛素血症,引起肝细胞内甘油三酯储积,同时诱导脂肪变性的肝细胞对内、外源性损害因素的敏感性提高,并为脂质过氧化提供反应基质。第二重打击主要是氧化应激产生过多的活性氧自由基及脂质过氧化产物,导致肝细胞线粒体功能障碍、促炎细胞因子生成,最终导致肝细胞炎症坏死。现阶段研究发现某些基因也参与病情的进展[2]。SIRT1是一种依赖烟酰胺腺嘌呤二核苷酸的组蛋白去乙酰化酶,与细胞衰老、寿命延长、抗氧化应激和能量代谢调节等生命活动密切相关[3]。多项证据显示,SIRT1能使Ac-FoxO1去乙酰化,激活FoxO1的转录活性,在脂质代谢中起重要作用。SIRT1-FoxO1信号通路可能通过改善胰岛素敏感性、减弱氧化应激等多方面调节肝细胞脂肪代谢。
中医学认为,糖尿病并发症的基本病机为瘀浊互阻,气阴两虚。消渴日久,治不得法,伤阴耗气,痰瘀互结于肝络可致糖尿病肝病。《中华本草》记载白背三七可“清热凉血,活血止痛,止血。主咳嗽,疮疡,烫炎伤,跌打损伤,风湿痛,崩漏,外伤出血”,并被广泛用于治疗糖尿病。实验证实白背三七中黄酮类化合物含量丰富,且能显著改善胰岛的功能,用于治疗2型糖尿病的功效确切。本实验结果显示,经白背三七治疗后血清FBG、TG、AST、ALT显著降低;病理形态学发现肝细胞形态多数恢复正常,脂肪变肝细胞、炎性细胞明显减少;肝内SIRT1、FoxO1蛋白表达明显增加,Ac-FoxO1蛋白表达明显减少,提示白背三七总黄酮可能通过激活SIRT1,使Ac-FoxO1去乙酰化,激活FoxO1的转录活性,进而改善胰岛素敏感性、减弱氧化应激等,从而对糖尿病肝损伤起到了保护作用。

