尼妥珠单抗治疗局部晚期鼻咽癌的近期疗效及不良反应分析
孙健达 胡 丹 冯会亭 林晶晶 陈意标 张汉雄 熊 俊
广东省梅州市人民医院放疗科,广东梅州 514031
鼻咽癌的发病具有明显的地域性,在我国及东南亚地区高发,而其中又以我国的华南地区为甚。放化疗综合治疗不仅可降低局部区域失败与远处失败的风险,而且可提高无进展生存率及总生存率,因此成为局部区域晚期鼻咽癌患者的标准治疗模式,但同时不良反应也显著增加[1]。如何寻找新的高效低毒的治疗方法成为目前研究的热点。表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种细胞表面受体,属于酪氨酸激酶的ErbB家族,研究表明其在细胞增殖、生存及分化的调节过程中起到关键的作用[2]。EGFR在鼻咽癌患者中的表达可高达89.5%[3],而EGFR的过表达对患者的总生存、无病生存及局部区域控制均产生显著的不良影响[4]。这提示针对EGFR进行分子靶向治疗可能改善患者的预后。尼妥珠单抗为一种人源化EGFR单克隆抗体,多个研究结果显示尼妥珠单抗在鼻咽癌治疗中显示出良好疗效的同时,不良反应无明显增加[5-9]。本研究旨在通过对尼妥珠单抗联合放化疗治疗局部区域晚期鼻咽癌的回顾性分析,以了解尼妥珠单抗的近期疗效及不良反应的发生情况。
1 资料与方法
1.1 一般资料
选取2015年4月~2017年12月我院放疗科收治初治病理确诊、无远处转移的局部区域晚期鼻咽癌患者共44例。纳入标准:Ⅲ~Ⅳa期(2008分期);年龄为18~70岁;初次治疗;无放化疗禁忌。所有患者均经病理检查分型为WHO Ⅱ~Ⅲ型,均接受尼妥珠单抗联合放化疗综合治疗。其中男36例,女 8例;中位年龄44岁(范围24~69岁);T1~2期17例,T3~4期27例;N0~1期11例,N2~3期33例;Ⅲ期27例,Ⅳa期17例。治疗前对患者病情的评估包括症状和体征、电子鼻咽镜检查、胸部及上腹部CT增强扫描、鼻咽部及颈部MRI增强扫描和ECT骨扫描,部分患者行全身PET/CT检查。
1.2 治疗方法
43例患者接受调强适形放疗,1例患者接受容积旋转调强放疗。鼻咽部照射剂量70~74 Gy/33次。有2例患者放疗结束时鼻咽病灶残留,其中1例予以三维适形局部推量6Gy/3F,另外1例予以后装放疗10Gy;有2例患者在放疗过程中因机器故障而中断放疗的时间较长,因此在放疗结束后按原计划加放疗1次。颈部转移淋巴结照射剂量70~74 Gy/33次,高危区PTV1照射剂量60~66 Gy/33次,低危区PTV2照射剂量50~54 Gy/28次。43例患者接受1 ~ 4周期以铂类为基础的联合方案新辅助化疗,其中1例患者在化疗过程中加用重组人血管内皮抑制素治疗。有3例患者拒绝行同期化疗,共有41例患者接受1~3周期铂类单药同期化疗。8例患者接受1~3周期以铂类为基础的联合方案辅助化疗。放疗过程中予以尼妥珠单抗治疗(百泰生物药业有限公司,S20080001),每次200mg,每周1次。2例患者完成6次尼妥珠单抗治疗,42例患者完成7次尼妥珠单抗治疗。
1.3 疗效及毒性评价
放疗期间通过每周进行体格检查,定期复查血常规、血生化及电子鼻咽镜,了解不良反应的发生情况。放疗结束复查电子鼻咽镜、鼻咽+颈部MRI增强扫描、胸部X线/CT、上腹部彩超/CT,以评价疗效。近期疗效评价采用实体肿瘤的疗效评价标准 RECIST 1.1 版[10]:完全缓解(complete response,CR):所有靶病灶消失,所有病理淋巴结的短径均小于10mm;部分缓解(partial response, PR):靶病灶直径之和比基线水平减少至少30%;疾病进展(progressive disease, PD):靶病灶直径之和相对增加至少20%(直径之和的绝对值增加至少5mm),或出现新的病灶;疾病稳定(stable disease,SD):靶病灶直径之和减少的程度没有达到PR,增加的程度也没有达到PD。放疗相关急性反应评价参考RTOG急性放射损伤分级标准,药物相关毒性反应采用常用药物毒性标准V3.0 (CTCAE)进行评价[11]。
1.4 随访
对所有患者均进行随访。治疗后3年内每3个月随访一次,第4、5年每半年随访一次,以后每年随访一次。要求患者到医院复查,复查项目包括一般体格检查、血EB-DNA、电子鼻咽镜、胸部X线、腹部彩超、颈部淋巴结彩超/颈部MRI增强扫描以及鼻咽部MRI增强扫描,必要时行ECT骨扫描及胸腹部CT扫描检查。没有回医院复查的患者进行电话随访,建立患者数据库。随访自开始治疗之日至2018年7月,随访时间为5~37个月,中位随访时间为10.5个月。
1.5 统计学方法
采用SPSS25.0软件进行统计分析,计量资料以中位数表示,计数资料组间比较采用χ2检验,生存率分析采用Kaplan-Meier方法进行计算,P<0.05为差异有统计学意义。
2 结果
2.1 尼妥珠单抗联合放化疗的近期疗效
放 疗 结 束 时,鼻 咽 病 灶 CR:79.5%,PR:18.2%,SD:2.3%,客观缓解率为97.7%。颈部淋巴结CR:83.3%,PR:16.7%,客观缓解率为100.0%。Ⅲ期及Ⅳa期患者的完全缓解率分别为74.1%及52.9%,差异无统计学意义。全组患者及不同临床分期患者的近期疗效评价详见表1 ~ 2。
全组患者中无局部复发及颈部淋巴结复发,有3例出现远处转移,其中1例患者在治疗结束后14月出现右眼眶转移,并行放化疗治疗,目前肿瘤稳定;1例患者在治疗结束后7个月出现肺、骨、肺门及纵隔淋巴结转移,另1例患者在治疗结束后2个月出现骨转移,均行姑息化疗,目前仍然存活。全组患者中出现1例死亡,该患者在治疗结束后3个月出现右侧腮腺淋巴结转移,随后行挽救性放化疗,但最终仍死于肿瘤进展。全组患者1年局部无失败生存率、区域无失败生存率、无远处转移生存率、无病生存率及总生存率分别为100%、100%、96.3%、94.8%及100%。

表1 44例局部区域晚期鼻咽癌患者近期疗效评价[n(%)]
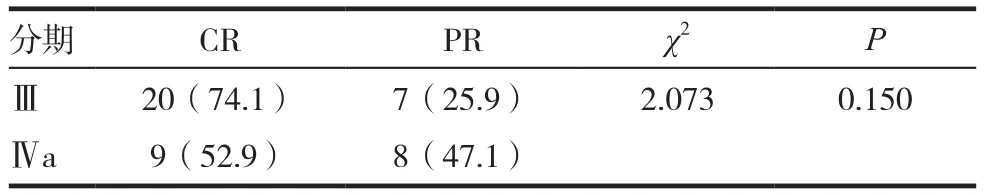
表2 不同临床分期鼻咽癌患者的近期疗效评价[n(%)]
2.2 尼妥珠单抗联合放化疗的不良反应
放疗过程中患者的治疗耐受性较好,出现的毒副反应较小,主要的不良反应为血液学毒性、口腔黏膜炎、放射性皮肤反应、食欲减退及恶心/呕吐,大多为1/2级,其中13例(29.5%)出现3/4级不良反应,无痤疮样皮疹、输液反应及治疗相关性死亡发生。10例(22.7%)出现3/4级血液学毒性反应,其中有2例患者出现4级血小板下降,予以积极处理后均能恢复,无患者因此而终断放疗。43例(97.7%)出现1/2级口腔黏膜炎,只有1例患者出现3级口腔黏膜炎。没有患者出现3/4级放射性皮肤反应。
3 讨论
EGFR信号传递对细胞增殖起到至关重要的作用,同时也参与血管生成、转移扩散及凋亡抑制等多个对肿瘤进展起重要作用的过程[12]。超过90%的头颈部肿瘤存在EGFR的过表达,而在多种肿瘤中,EGFR的过表达与较差的预后及治疗效果相关[13]。因此针对EGFR进行抑制成为肿瘤治疗中的一个关键靶点。尼妥珠单抗是一种的人源化EGFR单克隆抗体,研究表明尼妥珠单抗可以增加晚期鼻咽癌对放疗的敏感性,具有与放疗的协同作用[5],而放化疗加尼妥珠单抗具有比单纯放化疗更高的肿瘤缓解率[14]。在本研究中,放化疗综合治疗联合尼妥珠单抗治疗,可取得较好的近期疗效,鼻咽病灶及颈部淋巴结的完全缓解率分别可达79.5%和83.3%,而客观缓解率更分别可达97.7%和100.0%,1年无病生存率及总生存率分别为94.8%及100%。在本研究中由于部分患者拒绝在治疗后3月复查磁共振,因此采用治疗结束复查的结果来评价疗效,而目前多数文献报道的是在治疗结束后3月或以上才进行疗效评价的,这就造成本研究的完全缓解率较其他文献报道的低。预计随着随访时间的延长,完全缓解率会进一步提高。治疗后74.1%的Ⅲ期患者取得完全缓解,而只有52.9%的Ⅳa期患者取得完全缓解,这提示与肿瘤负荷较高的患者相比,中等肿瘤负荷的患者或许能从尼妥珠单抗的治疗中获益更多。如何能从局部区域晚期鼻咽癌患者中筛选出尼妥珠单抗治疗的优势人群值得进一步探讨。
目前已有多个研究表明尼妥珠单抗在产生抗肿瘤作用的同时,并没有出现严重的毒性反应,其原因可能跟尼妥珠单抗与EGFR二价结合的特性有关[15]。在本研究中,患者的治疗耐受性较好,出现的毒副反应较小,大多为1 ~ 2级,仅有29.5%的患者出现3/4级不良反应,无痤疮样皮疹、输液反应及治疗相关性死亡发生,表明尼妥珠单抗加同期放化疗并未明显增加治疗的毒副反应。在本研究中有22.7%患者出现3/4级血液学毒性反应,与文献[16-17]报道的结果相似。但值得注意的是,在本研究中只有2.3%患者出现3级口腔黏膜炎,无患者出现4级口腔黏膜炎,发生率远低于文献[16]报道的结果。其原因可能有:(1)本院在靶区勾画及计划设计过程中注意对口腔黏膜的保护;(2)患者在放疗过程中出现2级口腔黏膜炎时,积极予以口腔黏膜雾化、抗炎、激素及加强营养支持治疗等措施,减少严重口腔黏膜炎的发生;(3)本研究的病例数较少,可能会导致结果出现偏倚。此外目前多数文献报道的是尼妥珠单抗治疗的近期不良反应发生情况,尚缺乏关于远期不良反应的报道。因此尼妥珠单抗是否会增加放化疗的毒副反应还有待大型随机对照临床试验及长期随访以得出最终的结论。
综上所述,尼妥珠单抗联合放化疗治疗局部区域晚期鼻咽癌的缓解率较高,近期疗效较好,出现的毒副反应较小,使进一步提高鼻咽癌的治疗效果成为可能,有望成为新的鼻咽癌辅助治疗方法。

