基于转录组分析香鳞毛蕨乙醇提取物抑制红色毛癣菌的机制研究
林楚怡,张春荣,沈志滨
(广东药科大学中药学院,广东 广州 510006)
香鳞毛蕨Dryopterisfragrans(L.)Schott是鳞毛蕨科鳞毛蕨属植物,对多种皮肤病具有良好治疗作用[1-2],其醇提液对红色毛癣菌(Trichophytonrubrum)等多种真菌有较好的抑制作用[3-5]。
随着生物技术的发展,高通量测序技术在揭示药物作用机理的研究中也得到快速的发展,并形成一种新药作用机制研究的新思路和新方法,通过其对新药作用机制展开的转录组学的研究,增加对新药作用机制的了解[6-8]。
本文利用RNA-seq技术研究红色毛癣菌在香鳞毛蕨乙醇提取物(DF)作用前后基因差异表达,揭示香鳞毛蕨乙醇提取物对红色毛癣菌的抑菌机制,为香鳞毛蕨的新药研发提供理论依据和研究途径。
1 材料
1.1 药物
香鳞毛蕨药材采自黑龙江省五大连池,由哈尔滨商业大学药学院张德连教授鉴定为香鳞毛蕨Dryopterisfragrans(L.)Schott。盐酸特比萘芬原料药,购自济南明鑫制药股份有限公司,质量分数>98%。
1.2 菌株
红色毛癣菌标准株CMCC(f)T1a、平滑念珠菌(ATCC22019)购于中国医学科学院南京皮肤病研究院。
1.3 培养基
沙氏琼脂培养(SDA,批号:20160926)、MOPS(批号:20160926)均由广州瑞舒生物科技有限公司生产。RPMI Medium 1640(批号:785914)由美国Gibco有限公司生产。
2 方法
2.1 药物贮备液的制备
2.1.1 香鳞毛蕨乙醇提取物的制备 称取100 g香鳞毛蕨药材粗粉,90 ℃下用12倍量体积分数50%的乙醇提取3次,合并提取液,浓缩至无醇味,并加水定容至200 mL,制成质量浓度为0.50 g/mL的香鳞毛蕨乙醇提取物贮备液,备用。
2.1.2 盐酸特比萘芬贮备液的制备 精密称取160 mg盐酸特比萘芬原料药,加入10 mL二甲基亚砜溶解,制成质量浓度为16 mg/mL的阳性对照药贮备液,备用。
2.2 红色毛癣菌的药物处理
红色毛癣菌接种于SDA斜面培养基,28 ℃培养7 d以培养真菌孢子,用适量无菌生理盐水(0.9%)冲洗斜面,将冲洗出的菌液置于无菌研磨器中,充分研磨,使孢子游离,制备得到红色毛癣菌菌悬液。用RPMI 1640培养基将菌悬液调节至1.0×106CFU/mL,作为实验真菌培养物。
根据文献[9-12]可知,香鳞毛蕨乙醇提取物、盐酸特比萘芬对红色毛癣菌CMCC(f)T1a的最低抑菌浓度(MIC)分别为40 μg/mL和0.01 μg/mL。
实验设计9瓶100 mL培养物,每组3瓶,分别为乙醇提取物作用组(DF组)、盐酸特比萘芬作用组(TRB组)、对照组(Control组)。各组置于28 ℃下以150 r/min摇床培养5 d后,分别向DF组和TRB组中加入1/2 MIC浓度的乙醇提取物和盐酸特比萘芬,对照组中各加入等量的空白培养基。继续培养48 h后,离心获得红色毛癣菌培养物,快速冷冻于液氮中,后将培养物至-80 ℃超低温冰箱保存,转录组分析备用[13-14]。
2.3 总RNA提取及RNA-seq 测序
取出冷冻备用的红色毛癣菌培养物,研磨粉碎,用RNA plant plus 植物总RNA提取试剂盒提取总RNA,步骤参考其说明书。由深圳华大基因研究院进行测序文库构建,并用Illumina HiSeq2000进行转录组测序。
从提取的RNA样品中富集mRNA并片段化。以mRNA片段作为合成模板,采用六碱基随机引物合成、纯化第1链和第2链cDNA。对纯化的双链cDNA进行末端修复、加A尾和连接测序接头,采用DNA Clean Beads进行片段大小分选。最后通过PCR扩增技术对片段进行扩增,以纯化的PCR产物构建cDNA文库。
2.4 测序结果的质量检测与分析
由广州基迪奥有限公司对测序序列进行处理和生物信息学分析,包括测序质量评价,对GenBank中已有红色毛癣菌基因组为参考基因组(GenBank Assembly ID: GCA_000622995和GCA_000151425)进行序列注释、差异表达基因(DEGs)的基因本体GO(Gene ontology)功能显著性分析、KEGG代谢途径分析等。
3 结果
3.1 药物处理后红色毛癣菌测序结果的质量评价
3.1.1 测序质量及序列比对统计结果 如图1所示,DF组样品经测序共获得10 079 357个reads,经过滤得到9 979 222个clean reads,占总reads数99.01%; TRB组样品经测序共获得12 352 594个reads,经过滤得到12 315 550个clean reads,占总reads数99.03%; Control组经测序共获得12 695 547个reads,经过过滤得到12 576 327个clean reads,占总reads数99.06%,各样品获得的clean reads百分比均大于98%,测序质量较高,达到信息分析需求。
3.1.2 测序饱和度分析结果 随着测序量的增加,所检测到的基因相应增多。如图2所示,随着测序量的升高,检测到的基因增长速度趋于平缓,3组样品所能检测到的基因数量趋于饱和。
3.1.3 Reads在参考基因上的分布统计 通过reads在参考基因上的分布情况可以评价mRNA打断的随机程度。如图3所示,DF组、TRB组和Control组样品分布均匀性较好。
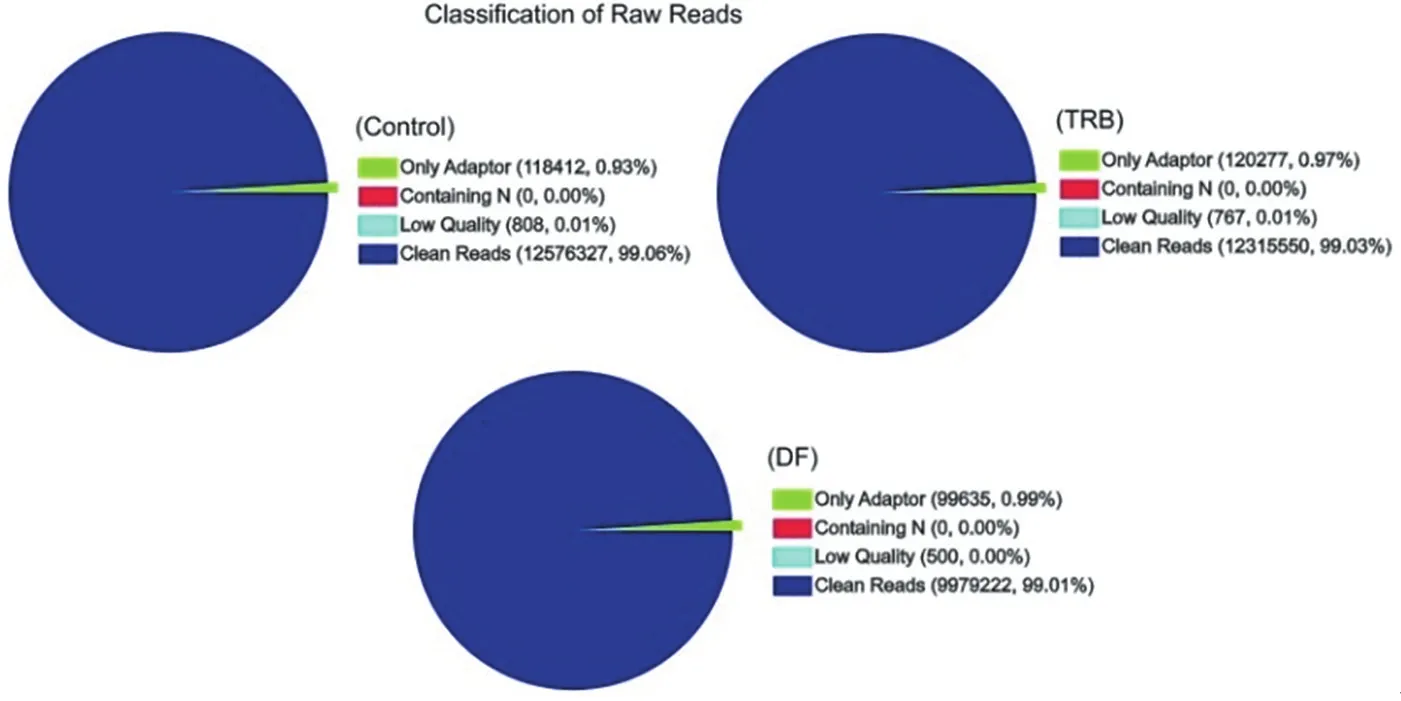
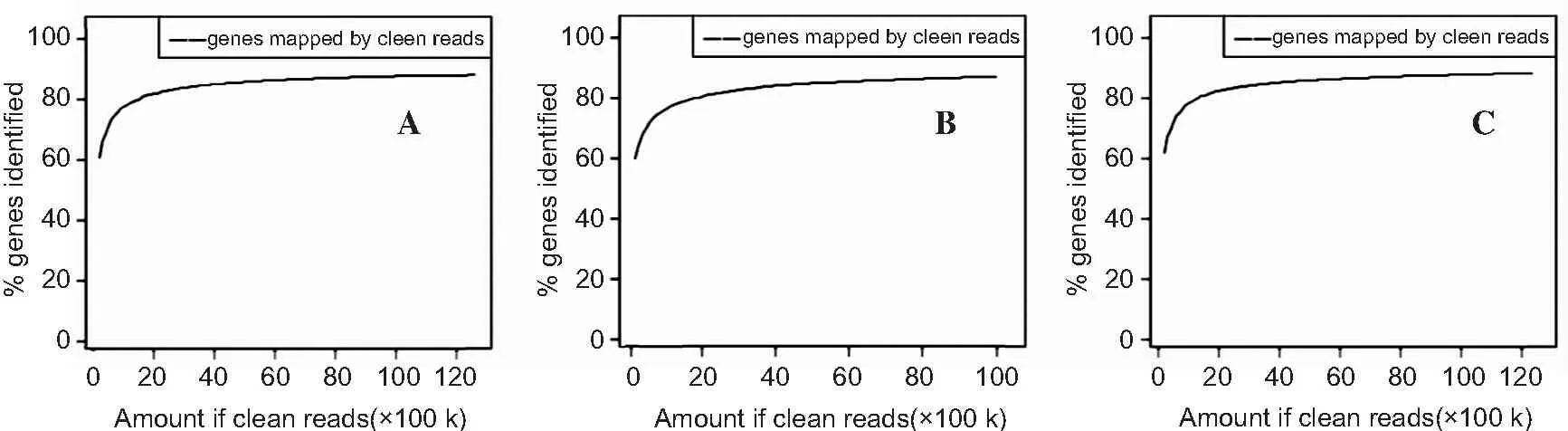
图1 测序质量统计Figure 1 Quality statistics of sequencing
A. Control组; B. DF组; C. TRB组。
图2测序饱和度分析
Figure2Saturation analysis of sequencing
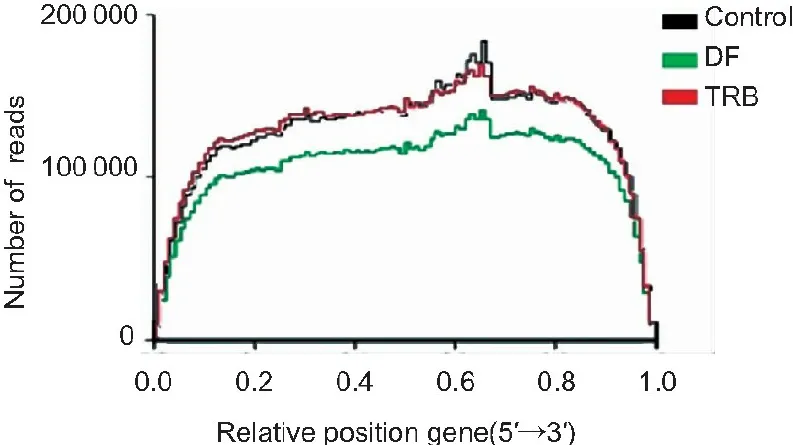
图3测序随机性统计
Figure3Random statistics of sequencing
3.1.4 基因覆盖度统计 测序深度是测序质量评价的指标之一,它与基因覆盖度呈正相关,与测序中的假阳性和错误率呈负相关。图4中为样品的测序覆盖度与测序深度分布,在DF组、TRB组和Control组样品中,对于所用unique mapping reads与参考基因对比后的基因覆盖度达到90%~100%的分别约有64%、67%和66%。
3.1.5 差异表达基因检测及分析 对3组样品的基因进行RPKM法定量,根据计算的基因表达量(RPKM值)计算该基因在不同样本间的差异表达倍数。确定FDR≤0.001且差异表达倍数不低于2倍(log2 Ratio≥1)的条件对基因进行差异表达筛选。
本试验3个样品每2个进行基因差异表达统计分析,结果如图5所示。DF组样品相对于Control组样品有194个基因上调表达,336个基因下调表达。TRB组样品相对于Control组样品有441个基因上调表达,201个基因下调表达。
3.2 差异表达基因的GO功能显著性富集结果
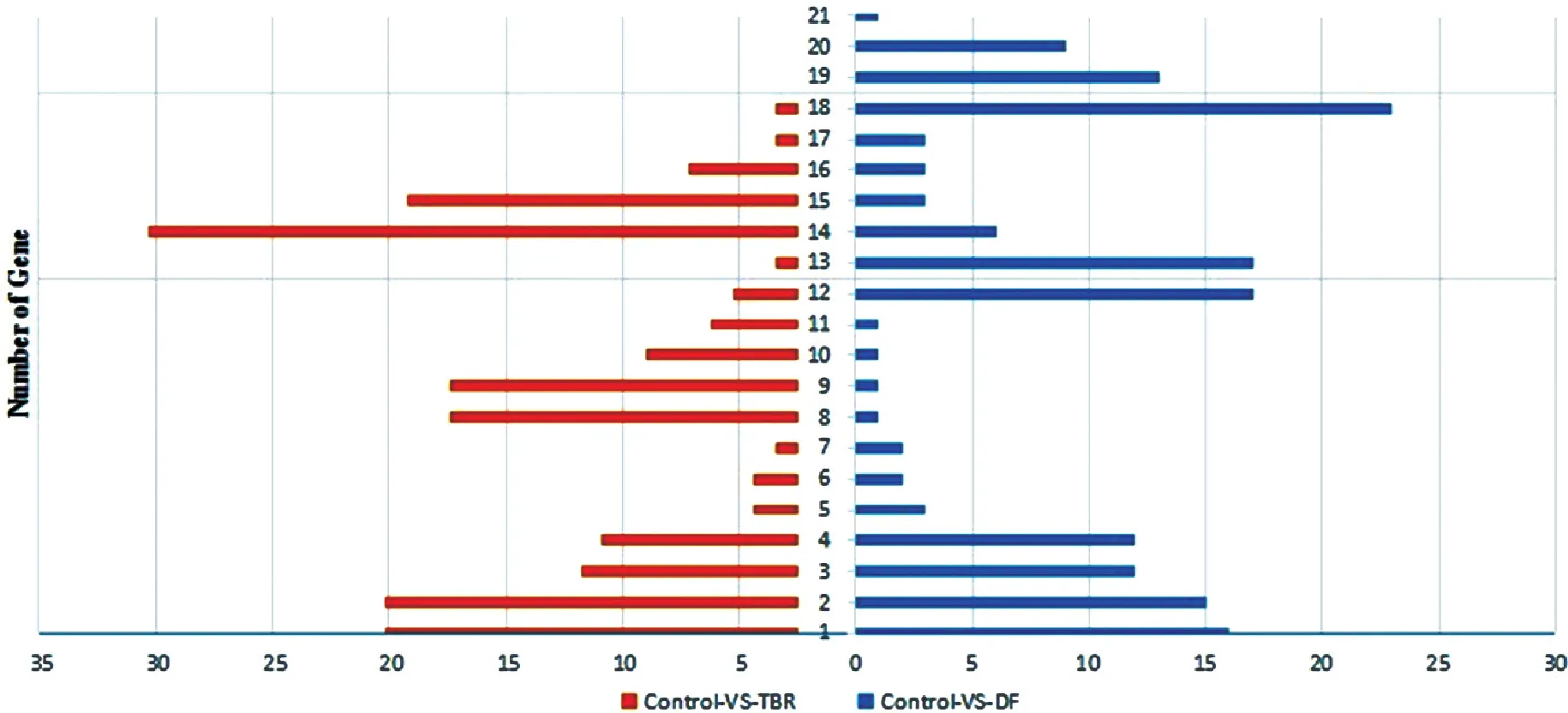
对测序获得的差异表达基因进行GO(Gene ontology)功能显著性富集分析,结果如图6所示。
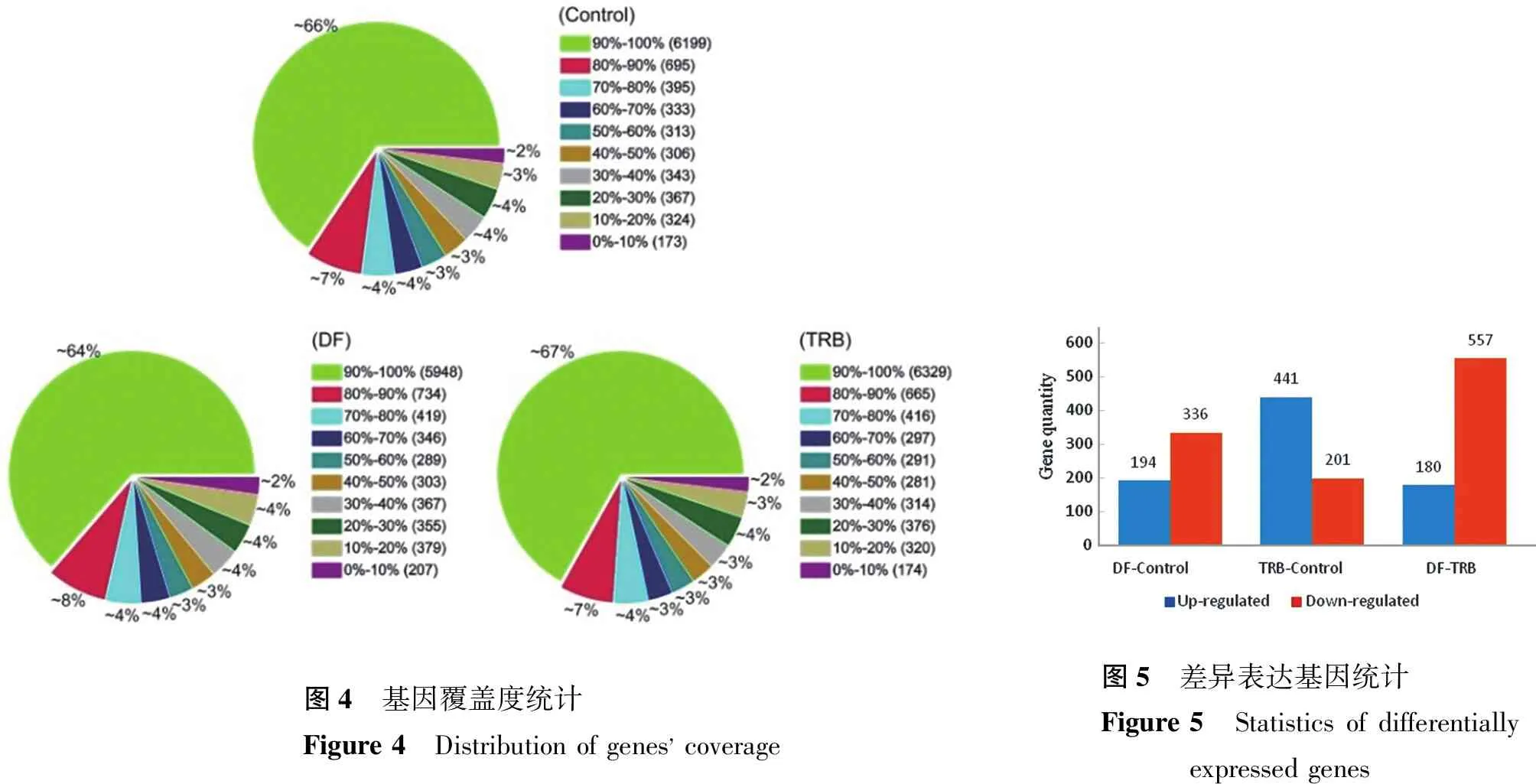
图4 基因覆盖度统计Figure 4 Distribution of gene coverage图5 差异表达基因统计Figure 5 Statistics of differentially expressed genes
precent of gene
注:1.代谢过程; 2.细胞过程; 3.定位的建立过程; 4.定位; 5.组织细胞的组成; 6.结构形成; 7.细胞组分的生物合成; 8.生物调节; 9.生长; 10.免疫系统过程; 11.刺激反应; 12.色素沉着; 13.细胞; 14.细胞部分; 15.细胞器; 16.隔膜; 17.高分子复合物; 18.细胞器部分; 19.催化活性; 20.结合; 21.转运活性; 21.结构; 23.分子活性; 24.转录调控。
图6GO功能分析
Figure6GO functional analysis
在Control组-VS-DF组中,共富集到21个类别。生物进程有11个小类,即解剖结构形成生物调节、细胞组分生物合成、细胞组织、细胞过程、固定的建立、生长、免疫系统过程、定位、代谢过程、刺激反应,共36个差异基因。细胞组分有6个小类,即细胞、细胞部分、膜部分、高分子复合物、细胞器、细胞器部分,共17个差异基因。在分子功能有4个小类,即结合、催化活性、结构分子活性、转运活性,共31个差异基因。生物进程中,“代谢过程”注释的unigene(16个)最多占55.6%; 细胞组分中,“细胞”和“细胞部分”注释到的最多(17个)占47.1%; 分子功能中,“催化活性”注释到的最多(23个)占74.2%。
在Control组-VS-TRB组中,共富集到18个类别。其中,生物进程有7个小类,即生物调节、细胞过程、定位的建立、定位、代谢过程、色素沉着、刺激反应,共40个差异基因。细胞组分有6个小类,即细胞、细胞部分、膜部分、高分子复合物、细胞器、细胞器部分,共16个差异基因。在分子功能有5个小类,即结合、催化活性、结构分子活性、转运活性,共40个差异基因。生物进程中,“代谢过程”注释的unigene(29个)最多占72.5%; 细胞组分中,“细胞”和“细胞部分”注释到的最多(11个)占68.8%; 分子功能中,“结合”注释到的最多(19个)占47.5%。
结果表明,DF组样品与TRB组样品作用相似,能够改变红色毛癣菌膜的通透性,影响生物被膜的结构,干扰菌机体的代谢活动,达到抑制真菌及其生物被膜生长和发育的效果。TRB组的GO功能分析与目前报道的作用机制相符[15-16]。
3.3 差异表达基因的Pathway显著性富集分析
通过KEGG对Control组-VS-DF组和Control组-VS-TRB组的pathway进行富集,以FDR<0.01,LogFC绝对值大于1进行差异表达基因的筛选。
在Control组-VS-DF组中,发现差异基因在代谢途径、次生代谢产物的生物合成、内质网蛋白质加工、氧化磷酸化、RNA转运、谷胱甘肽代谢、酪氨酸代谢、过氧化物酶体等67个通路存在富集。“代谢途径”相关的差异表达基因表达最多(47个)占21.56%,其次是“次生代谢产物的生物合成”(18个)占8.26%,“RNA转运”(8个)占3.67%,“氧化磷酸化”(8个)占3.67%,“内质网蛋白质加工”(8个)占3.67%。
在Control组-VS-TRB组中,发现差异基因主要分布于等67个通路中存在富集。“代谢途径”相关的差异表达基因表达最多(53个)占22.55%,其次是“次生代谢产物的生物合成”(25个)占10.64%,“类固醇生物合成”(11个)占4.68%,“谷胱甘肽代谢”(9个)占2.98%,“RNA运输”(7个)占2.55%。
途径分析结果表明,DF组红色毛癣菌在代谢途径、次生代谢产物合成、RNA运输、氧化磷酸化和内质网蛋白质加工等代谢的差异表达基因与DF组抑制受试菌的作用机制相关,即DF能够通过抑制受试菌的作用机制与抑制所需蛋白质的合成和通过氧化磷酸化途径相关。
TBR组红色毛癣菌在代谢途径、次生代谢产物合成、类固醇生物合成、谷胱甘肽代谢和RNA运输的基因差异表达与目前已报告的作用机制相符,即特比萘芬能干扰真菌麦角固醇的早期生物合成,抑制真菌的角鲨烯环氧化酶,使真菌细胞膜形成过程中角鲨烯环氧化反应受阻,从而达到杀灭或抑制真菌的作用。
4 讨论
目前,常用抗真菌药的作用机制分别有抑制真菌细胞膜的合成、抑制真菌细胞壁的成分、抑制核酸合成、抑制真菌的新陈代谢[17-18]。本次实验结果表明DF对红色毛癣菌的RNA运输、氧化磷酸化和内质网蛋白质加工运输的途径均具抑制作用,即其能影响真菌正常新陈代谢、干扰细胞膜、细胞壁、核酸的合成,具有多种靶点作用。
本研究发现,DF能够下调核糖核酸酶P复合亚基、真核翻译起始因子亚基和核孔复合蛋白相关基因的表达,影响真菌mRNA翻译和环境胁迫应答,达到生长抑制作用[19-20]。
白色念珠菌的ATPase调控胞质的ATP水平,ATPase的紊乱将诱发胞内能量代谢功能障碍[21-22]。DF能够迫使液泡ATP合成酶亚单位、液泡质子转位ATPase亚单位、线粒体ATP合成酶α亚基基因的下调表达,影响真菌机体正常的能量代谢,干扰菌体正常生长。
内质网中蛋白累积可引发内质网应激,导致细胞凋亡和自噬。磷脂酶D(PLD)可以通过抑制SAR1、SEC23/24、SEC13/31聚合形成COPII被膜小泡,抑制蛋白质从内质网运输到高尔基体,诱发内质网应激和细胞凋亡[23-24]。本研究发现,DF组中COPII被膜小泡形成的相关编码基因的表达明显下调,可能引发真菌机体的凋亡和自噬,达到杀菌效果。
在多种耐药途径中,生物被膜的形成是主要耐药机制之一[25-28]。生物被膜的形成需要多糖基质、纤维蛋白、脂蛋白等的合成与分泌[29-30],DF对真菌代谢抑制作用一定程度上会干扰生物被膜相关的物质合成与代谢,导致生物被膜的发育困难。因此,DF有望作为一种新型的生物被膜抑制剂与常用抗真菌药联用,形成一种耐药真菌的治疗策略。
本研究基于转录组测序分析,初步揭示了香鳞毛蕨抗真菌作用的分子机制,提出DF作为新型抗真菌药物和生物被膜抑制剂的发展潜力,实验室对于DF中各单体化合物的抗菌活性和对耐药菌的抑制作用的研究尚在进行中,希望为新型抗真菌药物尤其具有良好抑制真菌生物被膜新药的研发提供理论依据。

