复方贞术调脂方非糖脂代谢依赖的促能量代谢作用
陈远云,王露莎,荣向路,3,4 ,郭姣,3,4
(1.广东省代谢病中西医结合研究中心, 广东 广州510006; 2.广东省代谢性疾病中医药防治重点实验室,广东 广州510006; 3.国家中医药管理局脂代谢国家中医药三级实验室,广东 广州 510006; 4.国家中医药管理局高脂血症调肝降脂国家中医药重点研究室,广东 广州510006)
正常情况下,人体内物质能量代谢处于动态平衡中。当能量代谢发生障碍时,体内的这种平衡就会被破坏,从而引起相关疾病的发生[1-4]。在疾病治疗的过程中,一般讲究对症下药,如治疗糖尿病、高脂血症时,一般都会根据降糖、降脂这些特点来选择用药。因此在进行基础研究中,更多的是偏于物质代谢途径,然而却忽略了能量代谢异常也是疾病发生的一个主要原因。目前,许多学者的关注点已经从物质代谢途径转向能量代谢途径,以此作为切入点对疾病进行研究,得到了一定成果[5-8]。
复方贞术调脂方(Fufang Zhenzhu Tiaozhi Formula,FTZ)由女贞子、黄连、佛手、三七等八味中药组成,是广东药科大学郭姣教授调肝启枢化浊创新理论的代表验,对高脂血症[9-10]、糖尿病、动脉粥样硬化[11-12]、非酒精性脂肪肝[13-16]等糖脂代谢紊乱疾病疗效显著。FTZ以往研究中,主要集中于糖代谢、脂代谢等物质代谢途径,未有相关能量代谢方面的报道。本研究从能量代谢的角度出发,使用aP2-SREBP1c转基因小鼠、正常C57小鼠及盐酸氯丙嗪低温模型小鼠这3种模型,来观察不同情况下FTZ在能量代谢方面的作用,为糖脂代谢疾病的治疗提供思路。
1 材料
1.1 实验动物
8周龄aP2-SREBP1c转基因小鼠,雄性,SPF级,美国Jackson实验室引进,委托南京大学模式动物研究所净化,然后转至广东药科大学动物中心饲养繁殖,动物合格证号:J003393 SCXK(苏)2010-0001。8周龄C57BL/6J小鼠,雄性,SPF级,由广东省医学实验动物中心提供,生产许可证号:SCXK(粤)2013-0002。所有小鼠均适应性饲养7 d后进行实验。
1.2 药品与试剂
FTZ浸膏粉(FTZ,批号:20160901)为广东药科大学第一附属医院院内制剂(批准文号:粤制药字Z20110029),临床应用多年;氯丙嗪盐酸盐(梯希爱上海化成工业发展有限公司,货号69-09-0,质量分数98.0%);生理盐水(广东利泰制药股份有限公司,批号:5216040605)。XF细胞线粒体压力测试试剂盒(安捷伦科技有限公司,货号:103015-100)
1.3 主要仪器
XFe24细胞能量代谢分析仪(安捷伦科技有限公司);MP150小鼠生理活动仪电子体温计系统(普升科技有限公司);实验动物综合监测系统(Columbus Instruments, USA);SHP-150生化培养箱(上海精宏实验设备有限公司);5180R型低温高速离心机(Eppendorf,美国);ELGA超纯水机(威立雅水处理技术有限公司)。
2 方法
2.1 使用模型
aP2-SREBP1c脂肪代谢障碍模型小鼠: aP2-SREBP1c转基因小鼠,是由于脂肪组织内特异性aP2的启动子的控制下固醇元件结合蛋白-1c(SREBP-1c)的过表达小鼠模型,具有明显的脂质代谢紊乱和脂肪生成分化障碍的特点,曾用于糖尿病的研究[17]。
正常小鼠:C57BL/6j小鼠,SPF级,8周龄。用于探究FTZ对正常小鼠的能量代谢作用。
盐酸氯丙嗪低温小鼠模型的制备:以水为溶剂,配制0.08%盐酸氯丙嗪溶液,造模时给小鼠腹腔注射0.08%盐酸氯丙嗪溶液,注射容积为0.1 mL/10 g体质量,腹腔注射后小鼠体温显著下降[18]。
2.2 分组与给药
aP2-SREBP1c脂肪代谢障碍模型小鼠实验组:小鼠根据基因型分为同窝野生型小鼠、aP2-SREBP1c转基因小鼠。同窝野生型小鼠为野生对照组(WT),aP2-SREBP1c脂肪代谢障碍小鼠分为模型组(MO)、阳性药二甲双胍组(R)、FTZ高剂量组(FH)、FTZ中剂量组(FM)和FTZ低剂量组(FL),每组12只。野生对照组、模型组给予蒸馏水,阳性药二甲双胍组给予250 mg/kg二甲双胍, FTZ高剂量组给予2.4 g/kg FTZ浸膏粉,FTZ中剂量组给予1.2 g/kg FTZ浸膏粉,FTZ低剂量组给予0.6 g/kg FTZ浸膏粉,共给药12周。给药结束后,提取其棕色脂肪组织SVF细胞进行棕色脂肪细胞线粒体耗氧量实验 。
C57正常小鼠实验组:将小鼠分为对照组和给药组,每组10只。空白对照组给予蒸馏水;给药组给予1.2 g/kg FTZ,共给药14 d。各组小鼠分为两部分,一部分用于肛温测定;另一部分于给药的最后1天放入实验动物监测系统中监测小鼠给药后的能量代谢情况。
氯丙嗪低温小鼠实验组:将小鼠分为3组,分别为对照组、模型组与给药组,每组10只。空白对照组与模型组给予蒸馏水;给药组给予1.2 g/kg FTZ浸膏粉,共给药14 d。给药最后1天,模型组小鼠与给药组小鼠按照 0.1 mL/10 g体质量腹腔注射0.08%盐酸氯丙嗪溶液,空白组小鼠按照0.1 mL/10 g体质量腹腔注射生理盐水。各组小鼠分为两部分,一部分用于肛温测定,分别测小鼠腹腔注射0.08%盐酸氯丙嗪溶液后0 min、15 min、30 min、45 min、60 min、1.5 h、3.0 h、4.0 h、6.0 h、8.0 h、30.0 h的肛温;另一部分小鼠置于实验动物监测系统,用于能量代谢的测定。
2.3 肛温测定方法
连接好MP150小鼠生理活动仪中的电子温度计系统模块,将小鼠放入小鼠固定器中,待其稍安静,用甘油润滑温度探头,将温度探头插入小鼠肛门,固定插入一定位置不动,待体温读数稳定后,记录数据。正式实验前3天每天测1次肛温,让小鼠适应温度探头的刺激。
C57正常小鼠实验组:从给药第1天开始,分别于给药后0 min、1.5 h和3 h测小鼠肛温,每隔3天测1次,对比给药后3 h小鼠体内肛温变化的情况。
氯丙嗪低温小鼠实验组:分别测小鼠腹腔注射0.08%盐酸氯丙嗪溶液后0 min、15 min、30 min、45 min、60 min、1.5 h、3.0 h、4.0 h、6.0 h、8.0 h、30.0 h的肛温。对比各组小鼠肛温变化的情况。
2.4 实验动物监测系统监测小鼠能量代谢情况
C57正常小鼠实验组:安装好仪器,加入水和饲料,将小鼠放入代谢笼中马上进行气体校正,开始对小鼠的能量代谢情况进行为期3 d的监测。取中间一个昼夜的结果进行分析。
氯丙嗪低温小鼠实验组:安装好仪器,进行仪器气体校正后,提前将小鼠放入代谢笼中适应1 d,第2天腹腔注射0.08%氯丙嗪后,马上开始对小鼠进行24 h的能量代谢情况的监测。
2.5 棕色脂肪细胞线粒体耗氧量实验
aP2-SREBP1c脂肪代谢障碍模型小鼠棕色脂肪组织SVF细胞的提取:给药结束后,取适量棕色脂肪组织,加入组织体积10倍左右的2%BSA的2 mg/mLⅠ型胶原酶。剪碎,放于37 ℃中孵育30 min左右,取出,过100 μm细胞滤器,用PBS清洗1~2次,混合滤液,过滤,1 000 g离心5 min;取出,吸去上次脂滴,然后倒去上清;加入3~5 mL 含有10%FBS 1%双抗的完全培养基,吹散,过40 μm细胞滤器;1 000g离心5 min,倒去上清,加入10%FBS 1%双抗的完全培养基,种板;于37 ℃,5%(φ) CO2培养箱进行培养。
线粒体耗氧量实验前1天,将细胞接种到细胞培养板中,在生长培养基中过夜培养;并打开仪器,过夜预热;在固定板中加入校准液,将测试板放回固定板上,置于37 ℃ 无CO2培养箱中过夜水化探针。
线粒体耗氧量实验当天,用专业的基础营养液配制检测液,加入所需要的底物,将溶液加热至37 ℃ ,调pH值至7.4,过滤,置37 ℃ 水浴中备用;在显微镜下观察细胞状态良好,将生长培养基换为检测液,然后将细胞放置在37 ℃ 无CO2培养箱中1 h;将稀释好的药物分别加入测试板上的A、B、C、D 4个加药孔中,放入细胞能量代谢分析仪中进行检测。
2.6 统计学处理
3 结果
3.1 FTZ对aP2-SREBP1c脂肪代谢障碍模型小鼠耗氧量的影响
结果见图1。线粒体是机体重要的产能器官,主要通过呼吸作用来产生能量。通过线粒体耗氧情况可以反映出机体能量代谢情况。线粒体耗氧量曲线中的第一阶段(第1时间点至第3时间点)代表细胞的基础耗氧量,反映质子通过呼吸链形成电势后,转化为ATP合成所需能量和热量的情况。从图1A可以得知,模型组小鼠棕色脂肪细胞线粒体基础耗氧量与同窝野生型小鼠相似,给予高、低剂量的FTZ治疗后,模型组小鼠的细胞基础耗氧量未出现变化,而在给予二甲双胍与中剂量FTZ时,模型组小鼠基础耗氧量升高,说明中剂量FTZ可促进线粒体中ATP的合成和产热的发生。线粒体耗氧量曲线中第3阶段(第7个至第9个时间点)是加入线粒体氧化磷酸化解偶联剂(FCCP)之后检测的数值,在FCCP的作用下,大量质子回流,导致耗氧增加,此阶段的数值代表线粒体的最大耗氧能力,可间接显示细胞的最大的呼吸能力。各组小鼠在此阶段均表现不同的差异,其中升高最明显的是二甲双胍组和中剂量FTZ组。故对第3阶段的最大耗氧量结果进行定量分析(图B),结果显示模型小鼠的最大耗氧能力与正常组小鼠相比显著降低,而在给予高、中、低剂量的FTZ治疗后,小鼠皮下脂肪组织SVF细胞的耗氧量均有不同程度增加,且中剂量组和低剂量组与模型组比较差异有统计学意义(P<0.05)。提示FTZ能够增强棕色脂肪SVF细胞线粒体的呼吸率,增加机体能量代谢。
aP2-SREBP1c脂肪萎缩小鼠具有高血糖、高血脂、胰岛素抵抗等特点[17-20],其体内的物质代谢水平,包括糖代谢、脂代谢均出现异常。而本实验通过棕色脂肪组织线粒体耗氧量实验证明了该模型小鼠也具有能量代谢异常的特点,而经过FTZ治疗后,其能量代谢水平升高了,说明FTZ不仅能改善糖脂代谢疾病中的物质代谢紊乱,还能提高其能量代谢。
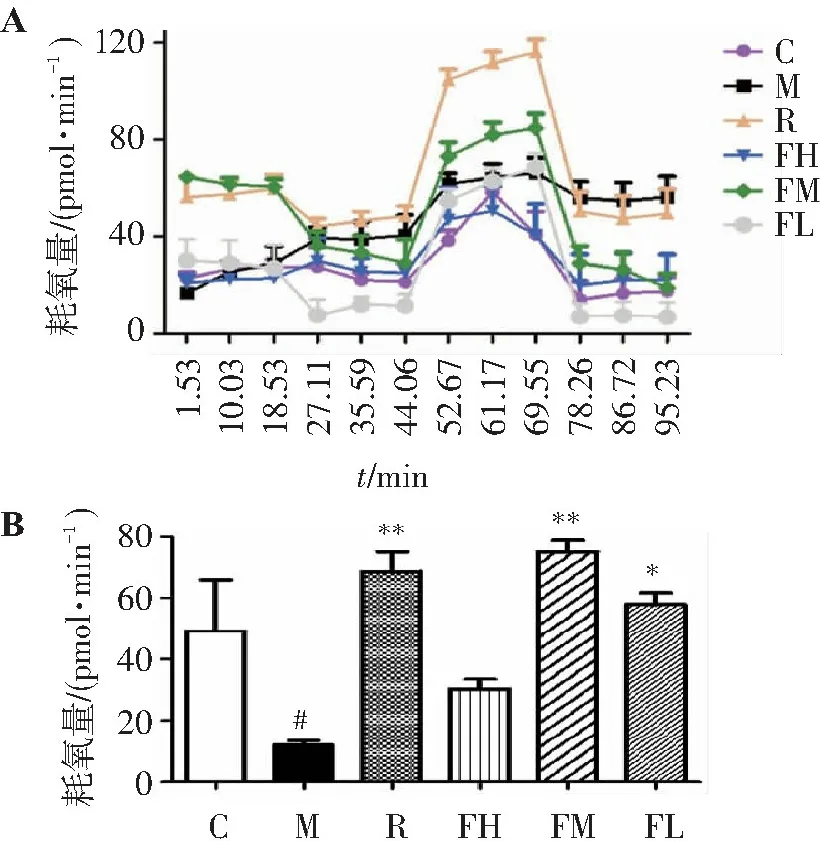
A.棕色脂肪组织SVF细胞线粒体耗氧量曲线; B.棕色脂肪组织SVF细胞线粒体耗氧量。与野生对照组比较:#P<0.05;与模型组比较:*P<0.05,**P<0.01。
图1FTZ对aP2-SREBP1c脂肪代谢障碍模型小鼠棕色脂肪细胞呼吸率的影响
Figure1Effect of FTZ on mitochondrial respiratory rate of brown adipose tissue in aP2-SREBP1c lipodystrophy mice
3.2 FTZ对C57正常小鼠中心体温的影响
给药前后3.0 h 内肛温变化的结果显示见图2,给药前5天,对照组小鼠给药后的波动幅度逐渐升高,给药5 d后相对稳定不变。而给药组小鼠下降给药14 d后,肛温的波动幅度降低。与对照组相比,刚开始给药时FM组小鼠体温下降幅度更大,而在给药14 d后,FM 组小鼠肛温下降幅度降低,几乎无明显改变。小鼠肛温的变化可以反映小鼠体内中心体温的情况。说明FTZ可以抵抗短时间的外界刺激,减少中心体温的波动。
给药14 d后,正常组小鼠与给药组小鼠的肛温无明显变化(见图3)。以上结果说明,给药FTZ 2周不影响正常小鼠的中心体温。
3.3 FTZ对C57正常小鼠能量代谢的影响
结果见图4。小鼠耗氧量代表小鼠利用氧气进行有氧呼吸的能力,间接反映机体的能量代谢的强弱。给药14 d后,FTZ组小鼠夜间呼吸商相对于对照组显著升高,白天呼吸商无明显变化(图4B),提示FTZ可以增加正常小鼠的夜间的代谢活性。然而对照组小鼠与FTZ组小鼠的耗氧量、热量值结果均未显示出差异(图4A、C),说明FTZ并不能增加C57正常小鼠的能量支出。综上可知,短期给药FTZ并不能增强正常小鼠的能量代谢。
3.4 FTZ对氯丙嗪诱导的低温小鼠中心体温的影响
如图5A结果所示,盐酸氯丙嗪能显著降低小鼠的体温,并于30 h 后恢复正常体温。
注射氯丙嗪药物后,FTZ 组整体体温曲线均高于氯丙嗪对照组,且FTZ组能缓解注射0.08%盐酸氯丙嗪溶液后15 min、30 min体温降低的情况,其肛温变化明显比氯丙嗪对照组小(见图5B),且差异有统计学意义。但其不能改善注射后45 min 后的体温降低现象。说明FTZ只能短暂缓解小鼠体内由于氯丙嗪引起的低温,但无法逆转这个降温现象。
3.5 FTZ对氯丙嗪诱导的低温小鼠能量代谢的影响
如图6结果所示,盐酸氯丙嗪能显著降低小鼠24 h内的耗氧量,并使热量值显示下降的趋势。提示盐酸氯丙嗪能降低小鼠24 h内的能量代谢。与模型组相比,FTZ组小鼠耗氧量有升高的趋势,但差异无统计学意义。说明,FTZ并不能长时间维持对氯丙嗪低温小鼠能量代谢的促进作用。
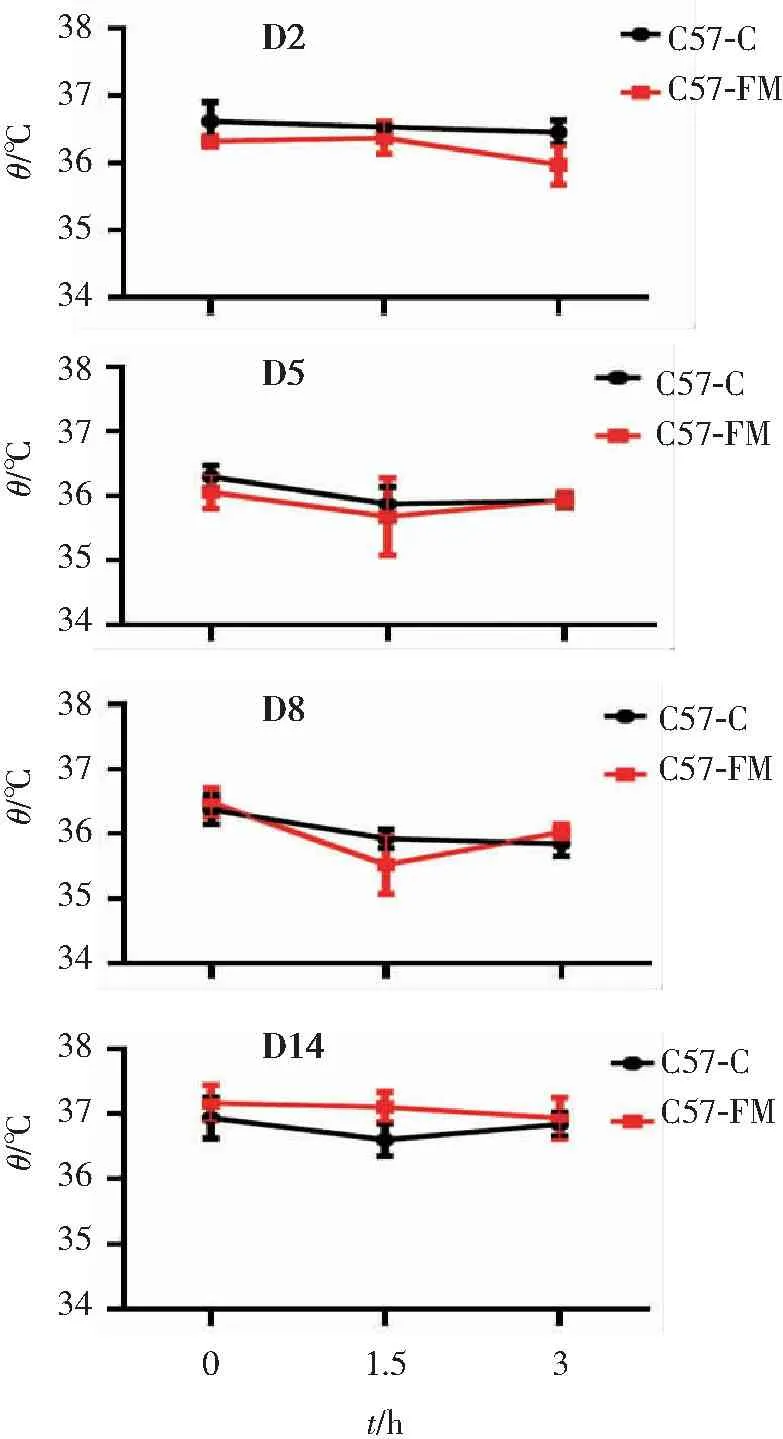
图2各时间段小鼠体温波动曲线图
Figure2Curve of body temperature fluctuation of mice in each time period
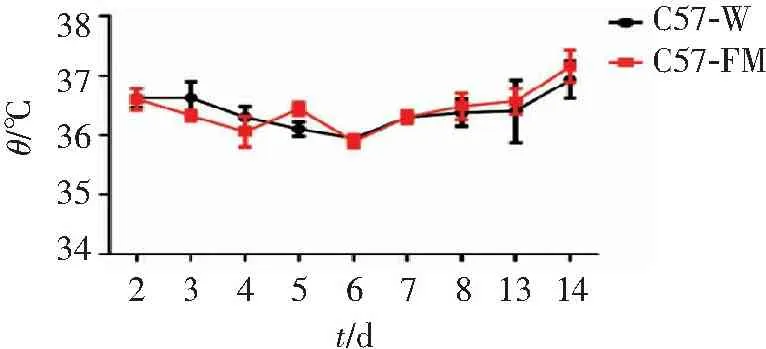
图3FTZ给药2周后小鼠的肛温变化曲线
Figure3Anal temperature curve of mice after two weeks of FTZ administration
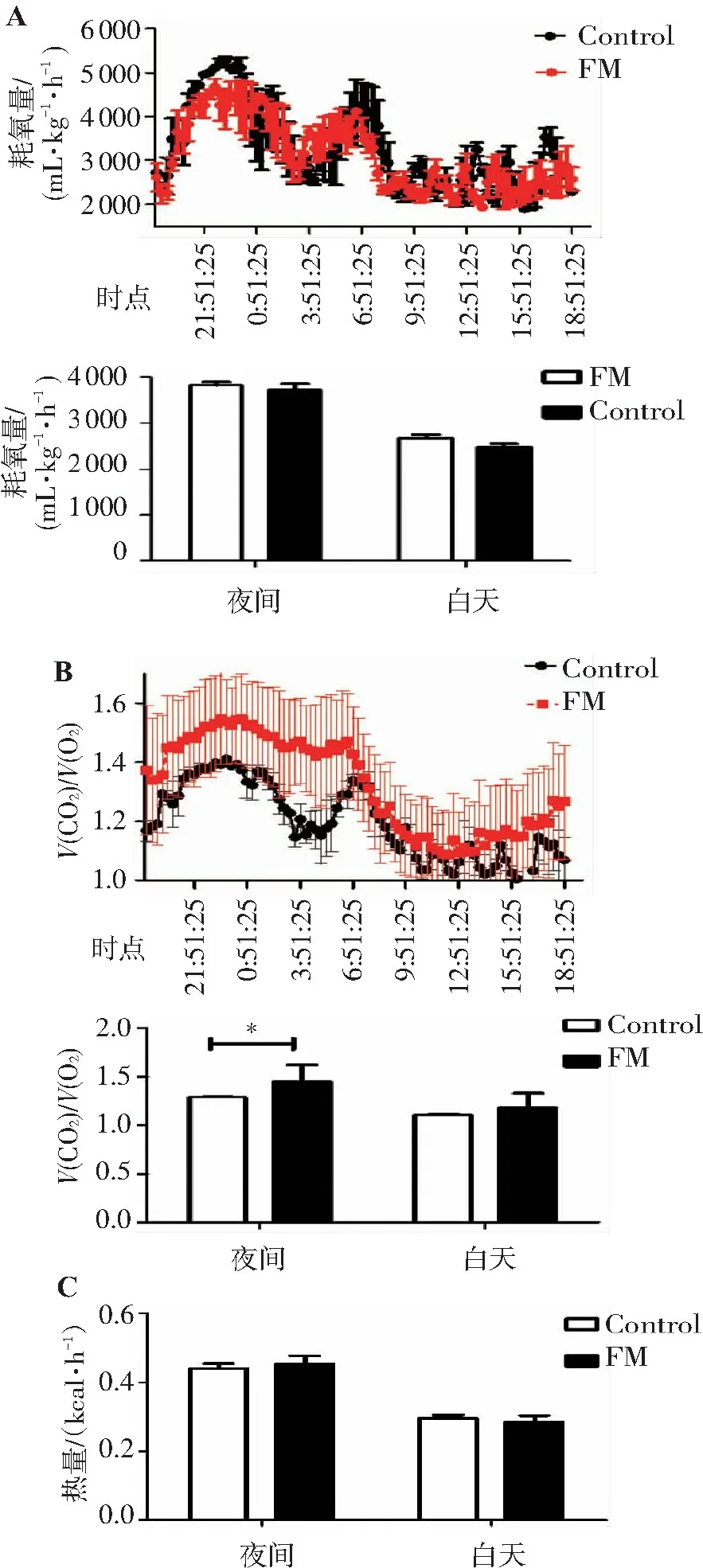
A.耗氧量; B.呼吸商; C.热量值。与对照组比较:*P<0.05。
图4FTZ给药2周后小鼠的能量代谢情况
Figure4Energy metabolism of mice after two weeks of FTZ administration
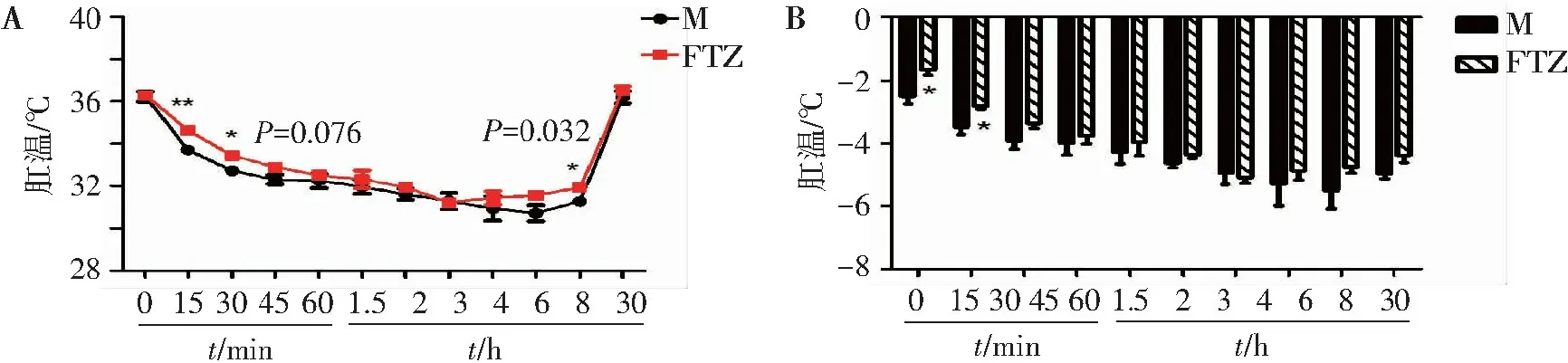
A.注射盐酸氯丙嗪后小鼠8 h肛温曲线图; B.注射盐酸氯丙嗪后8 h 的小鼠肛温变化; 与模型组比较:*P<0.05,**P<0.01。
图5FTZ对盐酸氯丙嗪低温模型小鼠中心体温的影响
Figure5Effect of FTZ on central body temperature of mice with chlorpromazine hypothermia
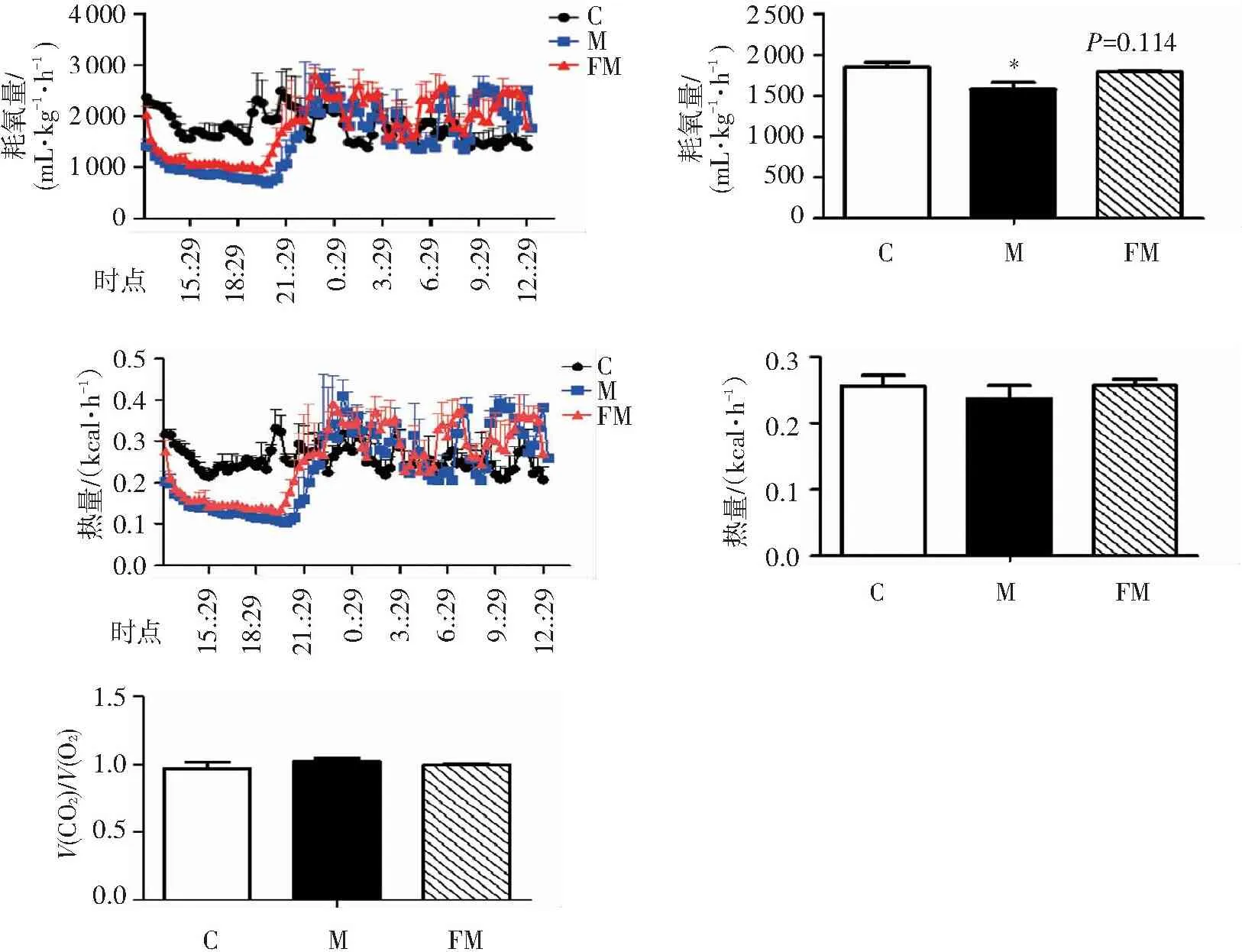
与对照组比较:*P<0.05。
图6注射盐酸氯丙嗪后小鼠 24 h 内的能量代谢情况
Figure6Energy metabolism of mice within 24 hours after injection of chlorpromazine hydrochloride
如图7所示,对盐酸氯丙嗪实验结果进一步分析,发现模型组小鼠在腹腔注射盐酸氯丙嗪后的24 h内,模型组与给药组小鼠的呼吸商差异无统计学意义,而其耗氧量、热量值均显著下降。说明盐酸氯丙嗪可使小鼠的能量代谢下降。造模5 h后,给药组与模型组的耗氧量(图7A)、热量值(图7B)开始显示出统计学差异,且差异在变大。造模12~16 h时,给药组与模型组的能量代谢指标显示出最大差异。以上结果说明,FTZ并不能长时间维持对氯丙嗪低温小鼠能量代谢的促进作用,其药效在盐酸氯丙嗪造模的第12~16小时之间达到最佳。提示FTZ能改善这种由于盐酸氯丙嗪导致的低耗氧量、低热量值的情况,具有促进小鼠能量代谢的作用。
上述结果表明,盐酸氯丙嗪能显著降低小鼠的体温、降低小鼠的能量代谢,并于30 h后恢复正常体温; FTZ 短期给药,不能提高正常小鼠的体温,但有减少给药后的体温波动的趋势。FTZ能升高由盐酸氯丙嗪诱导的低温小鼠的1 h内体温,促进其24 h内的能量代谢。
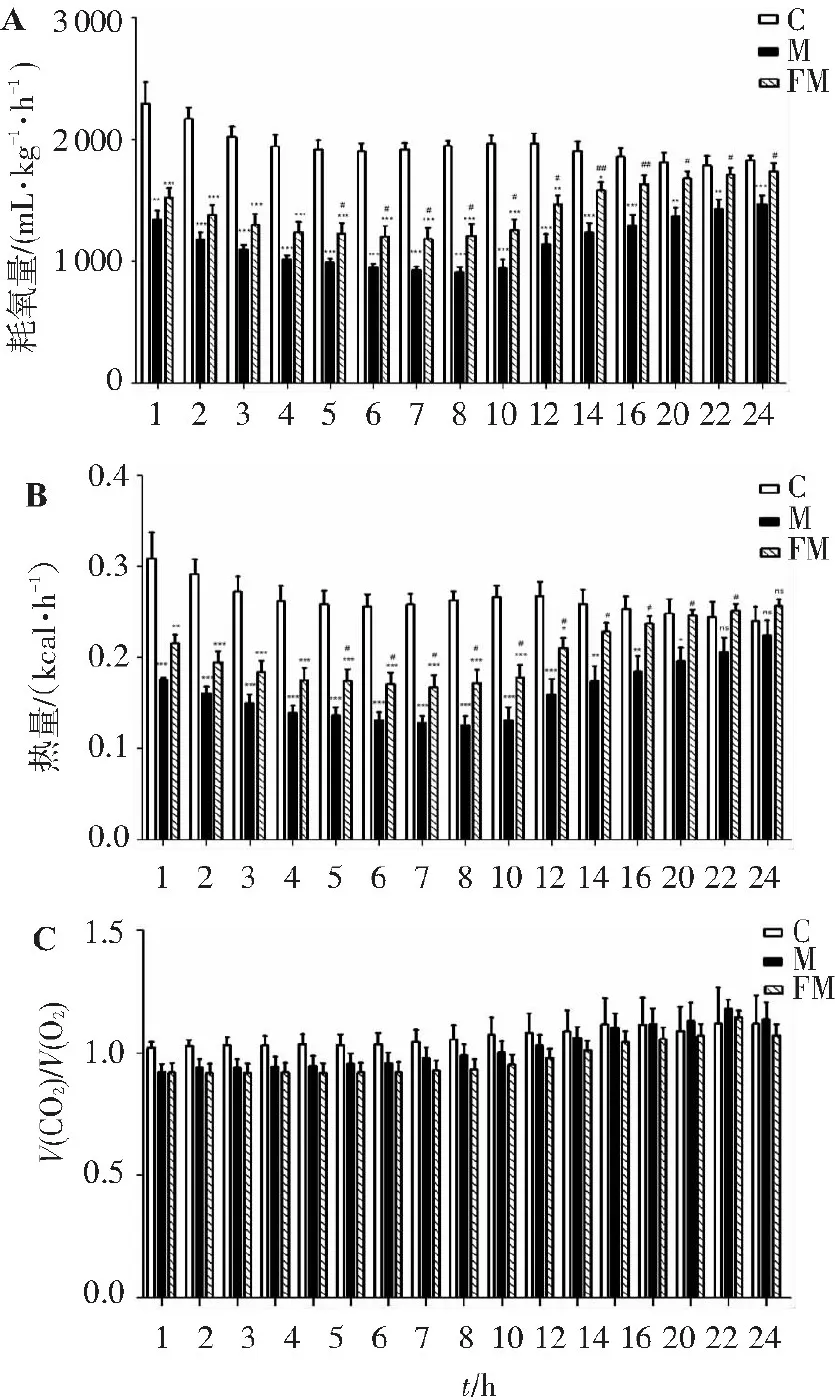
A. FTZ对盐酸氯丙嗪模型小鼠各时间点耗氧量的影响;
B. FTZ对盐酸氯丙嗪模型小鼠各时间点热量值的影响;
C. FTZ对盐酸氯丙嗪模型小鼠各时间点呼吸商的影响。
与对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01。
图7注射盐酸氯丙嗪24 h内小鼠各时间点的能量代谢情况
Figure7Energy metabolism of mice injected with chlorpromazine hydrochloride at various time points within 24 hours
4 讨论
本实验中分别采取了3种小鼠模型,分别为aP2-SREBP1c脂肪代谢障碍模型小鼠、C57正常小鼠、氯丙嗪诱导的低温小鼠。研究表明,aP2-SREBP1c脂肪代谢障碍小鼠具有高血糖症、高胰岛素血症、胰岛素抵抗和2型糖尿病等病理表征[19-21],具有显著糖脂代谢紊乱的特点。前期研究表明,FTZ可以改善aP2-SREBP1c脂肪代谢障碍模型小鼠的糖脂代谢紊乱[22-23]。本研究从能量代谢角度对其进行研究,希望能从中找到FTZ治疗糖脂代谢疾病相关机制的更多可能性。结果表明, aP2-SREBP1c脂肪代谢障碍模型小鼠的棕色脂肪组织耗氧量与对照组相比显著下降,说明该模型小鼠既存在糖、脂代谢紊乱,同时也存在能量代谢障碍,给予FTZ治疗后,模型小鼠棕色脂肪组织耗氧量显著升高,说明FTZ能促进糖脂代谢紊乱下的能量代谢。
在正常C57小鼠实验中,给药FTZ 14 d,小鼠的晚间呼吸商相对于对照组显著升高,而小鼠的中心体温及其他能量代谢指标并无显著变化,说明短期给药FTZ只能促进正常小鼠晚间的代谢活性,对正常小鼠的整体能量代谢无太大影响。
盐酸氯丙嗪为中枢多巴胺受体的阻断剂,通过阻断中脑-边缘叶及中脑-皮质通路中的多巴胺受体而产生镇静效应。研究表明,氯丙嗪对下丘脑体温调节中枢有很强的抑制作用,使体温调节中枢丧失调节体温的作用[24-26],临床常用于低温麻醉、人工冬眠。本实验采用氯丙嗪诱导的低温小鼠模型,主要探究FTZ在非糖脂代谢紊乱情况下对能量代谢的作用。实验证明,腹腔注射0.08%盐酸氯丙嗪能显著降低小鼠的体温与机体的能量代谢,持续时长约24 h。而在给予FTZ的情况下,不仅能短暂缓解由于氯丙嗪引起的低温,同时还能升高其能量代谢。以上结果证明,FTZ不能改变正常状态下的机体的能量代谢状态,但可以促进非糖脂代谢紊乱情况下的能量代谢。
“调肝启枢化浊”,是基于糖脂代谢疾病一体化综合防控而提出的一种策略[27],强调糖脂代谢紊乱性疾病的本质就是“浊”,运用多种有效手段,从多个环节干预,通过“调肝”使全身气机通畅,五脏安和;“启枢”使脾胃升降有序,运化功能正常,从而达到防治未病的效果。就是通过多种有效手段,使机体的功能恢复正常。本研究证明了FTZ在非糖脂代谢依赖下的促能量代谢作用,符合糖脂代谢疾病一体化综合防控的策略要求,为FTZ治疗糖脂代谢紊乱的潜在机制研究提供了更多的可能。

