广藿香PTS基因的克隆及CPEC法构建其过表达载体pRI101-PTS
黄伟展, 胡贞贞 ,卢昌华 ,张宏意,2,3,何梦玲,2,3,严寒静,2,3
[1.广东药科大学中药学院,广东广州 510006; 2.国家中医药管理局岭南药材生产与开发重点研究室,广东广州 510006; 3.中药材国家现代农业产业技术体系广州综合试验站(CARS-21-16),广东广州 510006]
广藿香来源于唇形科刺蕊草属植物Pogostemoncablin(Blanco) Benth.的干燥地上部分,为“十大广药”之一,具芳香化浊、和中止呕、发表解暑之功效。作为传统的芳香化湿药,广藿香挥发油具有抗氧化、镇痛、抗感染、抗血栓、抗抑郁等生物活性[1-2],被作为医药领域的重要原料。此外,还被广泛应用于食品、化妆品领域[3]。广藿香油的组分多为倍半萜类化合物,数量超过24 种,其中以广藿香醇为主要成分[4]。因此,研究广藿香中倍半萜类化合物生物合成的分子机理,提高药材中广藿香油,尤其是广藿香醇的产量,对广藿香药用资源的开发和应用具有重要意义。
广藿香醇合酶(patchoulol synthase,PTS)是广藿香中合成广藿香醇的关键酶,能催化倍半萜的前体法呢基焦磷酸(farnesyl diphosphate,FDP)生成广藿香醇等倍半萜类化合物[5]。2006年,Deguerry等[4]从印度广藿香中成功克隆了PTS基因的cDNA序列。同年, Wu Shuiqin[6]将PTS基因与禽类的法呢基焦磷酸合酶(FPPS,催化合成FDP的酶)基因分别都加入叶绿体转运肽序列,在烟草中实现FPPS和PTS蛋白重定向,并检测到转化植株中广藿香醇质量分数达到0.5 μg/g(鲜重)。2014年,Hartwig等[7]从印度广藿香栽培品中克隆了PTS基因的cDNA 序列,发现与Deguerry克隆的序列存在3.4%的差异。Hartwig将PTS基因cDNA序列进行密码子优化后构建到3种pET系列载体上,在3种大肠杆菌中进行异源表达,结果发现该PTS基因变体的表达产物催化FDP生成的主产物并非广藿香醇而是大根香叶烯A。这与他们团队的前期研究结果并不相符,通过对PTS蛋白的结构分析,Hartwig发现该现象很大程度上是由于454和458号氨基酸的替换造成的。总体而言,广藿香中倍半萜的生物合成的分子机理研究相对较少,尚未见到该基因在广藿香中成功过表达的报道,随着对倍半萜类化合物的代谢途径及调控机理的深入研究,对植物体进行基因改造,将有望成为提高药用植物中倍半萜类有效成分合成水平的有效方法[8]。
环形聚合酶延伸克隆(Circular Polymerase Extension Cloning,CPEC)是一种简单、有效和经济的环状DNA组装和克隆方法。CPEC利用具有互补末端的引物,使线性双链DNA片段和载体末端产生重叠序列,然后通过具有末端重叠序列的线性双链DNA片段和载体经过变性和退火得到具有重叠末端的单链产物。最后彼此互为模板和引物,在DNA聚合酶的作用下进行延伸得到在两条链不同位置分别有两个缺口的环状载体,重组载体直接转化大肠杆菌,利用大肠杆菌体内的修复机制得到完整双链环状质粒的克隆方法[9-10]。由于该方法对引物Tm值差值要求苛刻,所以引物设计过程较繁琐,目前采用这个方法构建过表达载体的报道相对较少。
本研究对海南儋州广藿香的PTS基因进行克隆,采用CPEC法构建pRI101-PTS过表达载体,并进行生物信息学分析,以期为转染广藿香并进一步研究广藿香的倍半萜生物合成途径及其调控表达机制奠定基础。
1 材料与方法
1.1 材料
广藿香Pogostemoncablin(Blanco) Benth.植株采集自海南儋州,并移栽至广东药科大学大学城校区中药学院。克隆菌株DH5α、植物表达载体pRI101-AN均购自TAKARA公司。
1.2 仪器和试剂
TRIpure Reagent(北京艾德莱生物科技有限公司)、FastKing一步法RT-PCR试剂盒、超薄琼脂糖凝胶DNA回收试剂盒、快速质粒小提试剂盒(均购自天根生化有限公司)、琼脂糖(Biowest公司)、ExRed核酸电泳染料、6×Loading Buffer(庄盟生物)、Recombinant DNase I、PrimeSTAR®Max DNA Polymerase(TAKARA公司)。
1.3 引物设计
根据GenBank中PTS基因的CDS 序列(登录号AY508730.1、KF983531.1和KP694233.1),用CloneManager8软件针对OFR进行引物设计。
ORF扩增引物PTS-F:5′-ATGGAGTTGTATGCC CAAAGTG-3′,PTS-R:5′-TTAATATGGAACAGGGTG AAGGTAC-3′。环形聚合酶延伸克隆(CPEC)引物PTS-CPEC-F:5′-CTGTTGATAGCCACCATGGAGTTG TATGCC-3′,PTS-CPEC-R:5′-GATTCAGAATTCGGA TCCTTAATATGGAACAGGGTGAAGG- 3′以及pRI101-F:5′-CATACAACTCCATGGTGGCTATCAACAGTGAAG AAC-3′,pRI101-R:5′-CACCCTGTTCCATATTAAGGA TCCGAATTCTGAATCAAC-3′(引物由华大基因合成)。
2 方法
2.1 广藿香总RNA的提取与PTS基因的克隆
2.1.1 广藿香总RNA的提取及cDNA的合成 取广藿香新鲜叶片100 mg,用毛刷除去表面泥沙,加适量的液氮于预冷的研钵中充分研磨成粉末,迅速转移至EP管中,提取步骤参照TRIpure Reagent说明书进行。提取完成后,用Recombinant DNase I进行消化。1%琼脂糖凝胶电泳检测总RNA 完整性,并用超微量紫外分光光度计测定其浓度和纯度。
在冰浴条件下配制RT-PCR反应液:2×FastKing One Step RT-PCR Master Mix 25 μL,25×RT-PCR Enzyme Mix 2 μL,total RNA 3 μL,上下游引物(10 μmol/L)各1.25 μL,RNase-Free ddH2O补足50 μL。
PCR 程序为:42 ℃逆转录3 min,95 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 30 s,共35个循环,72 ℃终延伸5 min。将得到的PCR产物进行1%琼脂糖凝胶电泳鉴定,回收目的条带,并测定cDNA的浓度和纯度。-20 ℃保存。
2.1.2 PTS基因的T-A克隆 连接转化及菌液PCR加样过程均在超净工作台完成。在灭菌离心管中配置反应液:(2×)RapiLigation Mix 5 μL,pGM-T Fast Vector(50 ng/μL)1 μL,目的PCR片段3 μL,ddH2O补足10 μL。将连接产物转化克隆感受态T1,复苏菌体后取50 μL涂LB平板(Amp 50 mg/L),于37 ℃培养箱中培养过夜。挑取单菌落接种于1 mL LB液体培养基(含Amp 50 mg/L)中(以下均简称为BL-Amp液体培养基),37 ℃、200 r/min培养4 h,用引物PTS-F/ R进行菌液PCR鉴定。取阳性克隆菌液按100∶1体积比接种至6 mL BL-Amp液体培养基,过夜培养。取1 mL菌液加60%甘油0.5 mL,-80 ℃保存菌种。剩下的5 mL菌液提取重组质粒,检查浓度纯度,取适量送华大基因测序,剩余质粒于-20 ℃保存。测序结果用DNAman进行序列拼接,并用Blastn进行序列比对。
2.2 环形聚合酶延伸克隆(CPEC)构建pRI101-PTS过表达载体
2.2.1 PTS基因同源臂的引入 PCR反应体系:pGM-T-PTS重组质粒(160 ng/μL)1 μL,PTS-CPEC-F(10 μmol/L)1.5 μL,PTS-CPEC-R(10 μmol/L)1.5 μL,PrimeSTAR® Max DNA Polymerase 25 μL,ddH2O补足50 μL。
PCR反应条件:95 ℃预变性3 min,98 ℃变性10 s,70 ℃退火5 s,72 ℃延伸1 min,共30个循环,72 ℃终延伸5 min。产物经1%琼脂糖凝胶电泳鉴定后,回收目的片段,并检测浓度及纯度,备用。
2.2.2 pRI101-AN载体线性化及同源臂的引入 PCR反应体系:pRI101-AN载体(200 ng/μL) 1 μL,pRI101-F(10 μmol/L) 1 μL,pRI101-R(10 μmol/L) 1 μL,PrimeSTAR® Max DNA Polymerase 25 μL,ddH2O补足50 μL。
PCR反应条件:95 ℃预变性3 min,98 ℃变性10 s,69 ℃退火5 s,72 ℃延伸5 min 30 s,共30个循环,72 ℃终延伸5 min。产物经1%琼脂糖凝胶电泳鉴定后,回收目的条带,并检测浓度及纯度,备用。
2.2.3 PTS基因与pRI101-AN线性化载体的环化PCR反应体系 pRI101-AN线性化载体(65 ng/μL)2.5 μL,PTS带同源臂片段(160 ng/μL) 1.5 μL,PrimeSTAR® Max DNA Polymerase 10 μL,ddH2O补足20 μL。
PCR反应条件:95 ℃预变性3 min,98 ℃变性10 s,75~55 ℃(-0.1 ℃/s)退火,72 ℃延伸6 min,共10个循环,72 ℃终延伸5 min。为了更方便地进行环化反应,不对退火温度进行考察而采用缓慢降温退火[9]。环化反应完成后,取4 μL反应产物进行1%琼脂糖凝胶电泳检视。
2.2.4 环化产物转化克隆菌株DH5α及阳性克隆验证 取8 μL环化产物转化100 μL DH5α感受态菌液,转化完成后加入LB液体培养基(无抗性)500 μL,37 ℃、200 r/min复苏45 min,4 000 r/min离心2 min,吸取上清100 μL,弃去。剩余部分约100 μL混悬后,取50 μL涂于LB平板(含Kan 50 mg/L)上,37 ℃培养过夜。
挑取单菌落小量培养后进行菌液PCR验证(一个空载样品作为空白对照),阳性克隆菌株继续小量培养提取质粒送测序。测序结果拼接后与T-A克隆测序结果比对,同时确认目的片段插入位点是否与预期一致。
2.2.5 广藿香PTS基因的生物信息学分析 利用Clustalw在线软件将本实验克隆得到的PTS基因的cDNA序列及其编码的氨基酸序列与GenBank收录进行多序列比对。用Expasy在线分析平台对本研究中PTS蛋白的一级结构和理化性质进行预测分析。采用TMHMM 2.0预测蛋白跨膜结构;SignalP 4.1预测是否含有信号肽;ProtComp 9预测其亚细胞定位。蛋白二级结构使用SOPMA软件预测;SMART预测蛋白结构域(PFAM),SWISS-MODEL基于同源建模方法,构建广藿香PTS蛋白的三级结构模型。
3 结果
3.1 广藿香总RNA的提取及cDNA的合成
测得总RNA OD260/280在1.9左右,琼脂糖凝胶电泳显示28S、18S条带清晰,表明得到的总RNA质量较好,能满足后续试验需要。一步法逆转录得到cDNA后,1%琼脂糖凝胶电泳检视可见1 500~2 000 bp之间有清晰明亮的条带(图1)。初步确定得到广藿香PTS基因。
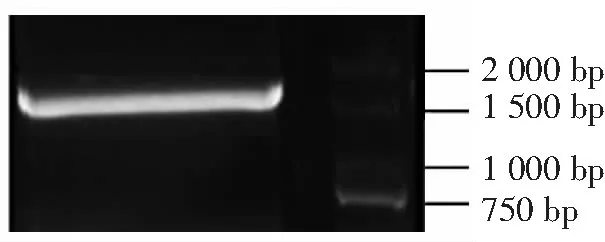
图1cDNA琼脂糖凝胶电泳
Figure1cDNA agarose gel electrophoresis
3.2 广藿香PTS基因T-A克隆
构建重组T载体完成后,以PTS-F/R引物进行菌液PCR,鉴定阳性克隆。阳性菌株提取质粒测序,序列拼接后进行Blast,结果表明该序列为PTS基因。
3.3 CPEC法构建pRI101-PTS过表达载体
PTS基因和pRI101-AN载体引入同源臂后,1%琼脂糖凝胶电泳检测结果表明,扩增过程都具有较高特异性,两个泳道中有且只有1 500~2 000 bp之间以及约10 000 bp处的一条清晰明亮的条带(图2)。环化产物检视结果如图3所示。环化后在15 000 bp左右能看到一条条带。转化后的单菌落经菌液PCR验证(引物为PTS-F/R),均为阳性克隆(图4),图中第7泳道为空白对照(pRI101-AN空载体)。
3.4 广藿香PTS基因及其编码的蛋白的生物信息学分析
PTS基因的cDNA全长为1 659 bp,为一个完整的开放阅读框,编码552个氨基酸。用Clustalw在线软件将本实验克隆得到的PTS基因的cDNA序列与GenBank收录的其他产地广藿香PTS基因的cDNA 序列[登录号为AY508730.1(产自印度)、KF983531.1(印度栽培品)和KP694233.1(产自海南万宁)]进行比对分别有50个、6个和20个碱基的差异,差异率为3.01%、0.36%和1.21%。编码的氨基酸(amino acid,aa)序列(对应的登录号为AAS86323.1、AHL24448.1、ALQ43502.1)分别有22个、3个和12个氨基酸的差异,差异率3.99%、0.54%和2.17%(图5)。
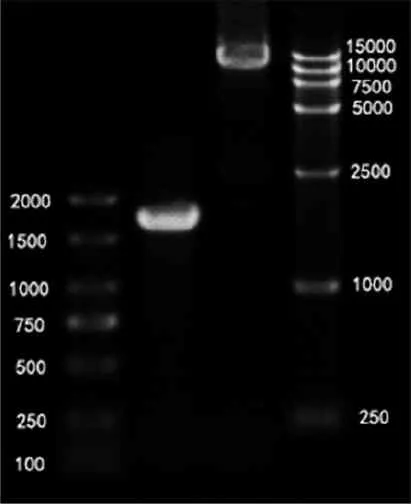
注:从左到右依次为DL2000 Marker、PTS、pRI01-AN线性化载体和DL15000 Marker。
图2PTS基因和pRI101-AN加同源臂后琼脂糖凝胶电泳检视图
Figure2Agarose gel electrophoresis view of PTS gene and pRI101-AN with homology arm
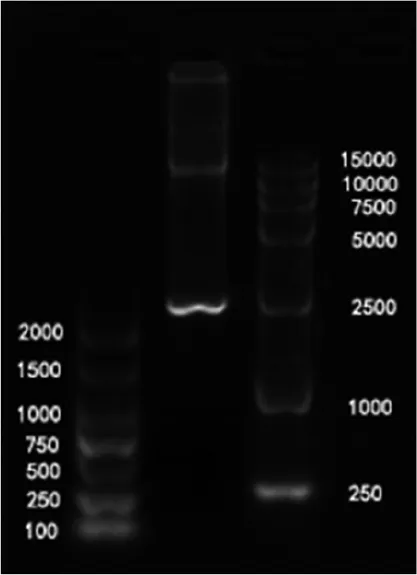
注:从左到右依次为DL2000、CPEC环化产物和DL15000 Marker。
图3CPEC产物琼脂糖凝胶电泳结果
Figure3The results of agarose gel electrophoresis of CPEC products
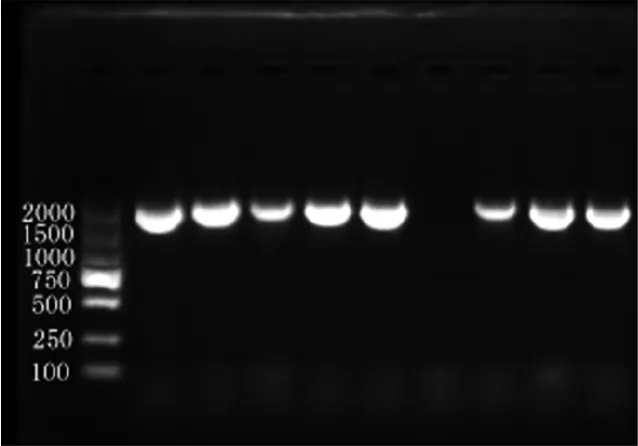
注:Marker为DL2000、第7泳道为空载体空白对照。
图4菌液PCR验证结果
Figure4PCR results of bacterial solution

图5不同产地广藿香醇合酶氨基酸序列比对图
Figure5Comparison of patchoulol synthase amino acid sequences in different habitats
PTS基因编码的蛋白质的分子量为64.1 ku,等电点为5.39。在氨基酸组成中,酸性氨基酸(D,E)占15.2%,碱性氨基酸(K,R)占11.8%,极性氨基酸(N,C,Q,S,T,Y)占22.3%,疏水氨基酸(L,A,I,F,V,W)占37.5%,负电荷残基(Asp+Glu)值为84,正电荷残基(Arg+Lys)值为65,脂肪系数为87.61,不稳定系数为42.81,在酵母体内半衰期大于20 h,在大肠杆菌体内则大于10 h。推测其编码的蛋白可能不稳定。ProtScale亲疏水性预测结果显示亲水性平均值(GRAVY)为-0.289,因此,PTS基因编码的蛋白质为亲水性蛋白。TMHMM软件预测分析得知,该蛋白无跨膜区域,全部位于膜外。ProtComp 9软件综合预测结果表明亚细胞定位于细胞质。
根据PTS基因编码的蛋白质信号肽预测结果如图6所示,其中C-score代表剪切位点的记分,分值越高表示出现剪切位点的可能性就越大。S-score表示信号肽记分,Y是基于C和S的综合记分,通常被视为潜在的剪切位点。从图6可见,C、S 和 Y 的最高得分分别为0.159、0.135、0.158,均低于0.5,表明PTS蛋白中不具有信号肽。
软件SOPMA预测该氨基酸序列的4种二级结构如图7。其中α-螺旋占总氨基酸残基的70.11%,共有387个氨基酸参与;延伸链有23个氨基酸参与,占4.17%;16个参与β-转角占2.90%,无规则卷曲占22.83%,有126个氨基酸参与。
用SMART在线软件预测PTS基因编码蛋白结构域(PFAM)。结果发现PTS基因编码蛋白含有两个结构域:一个N末端倍半萜合酶结构域共包含173个氨基酸残基,从25~197(aa序列);一个C末端倍半萜合酶结构域共包含268个氨基酸残基,229~496(aa序列)可能参与线性萜烯的环化,具结合镁离子活性。
采用SWISS-MODEL在线软件基于同源建模方法,构建PTS基因编码蛋白的三级结构模型(图8)。以蛋白质晶体结构数据库相似度较高的(+)-δ-杜松烯合酶序列(相似度44.53%,SMTL ID:3g4d.1.A)为模板蛋白,构建PTS基因编码蛋白三级结构模型。GMQE值(Global Model Quality Estimation)为0.75(GMQE评分范围为0~1,该值反映了模型的准确度和目标覆盖范围,数值越接近1,表示可靠性越高),QMEAN值(Qualitative Model Energy Analysis)为-2.06(QMEAN评估待测蛋白与模板蛋白的匹配度,值越大表示匹配度越高,大于-4,表示模型可用),评价结果表明该模型可以较好预测PTS蛋白的三级结构。
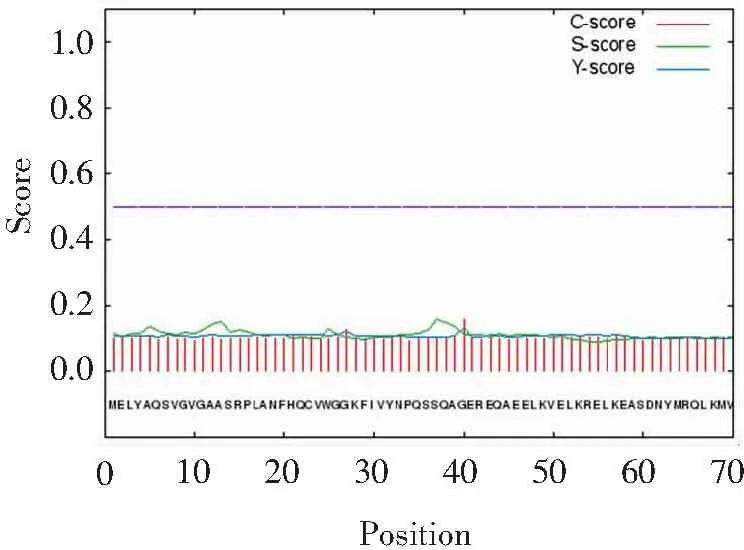
图6PTS基因编码蛋白的信号肽预测
Figure6Signal peptide prediction of proteins encoded by PTS gene
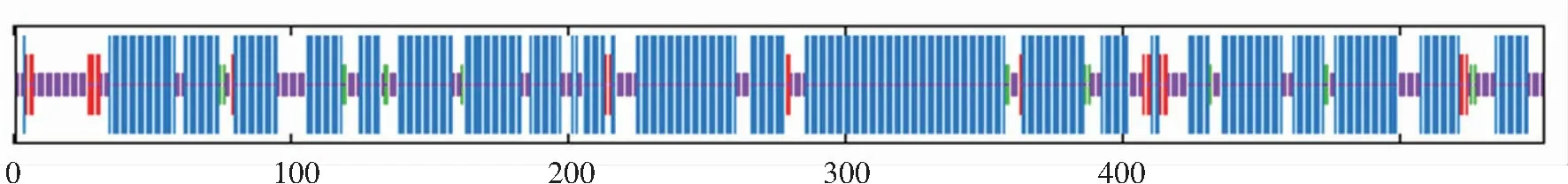
注:蓝色区域代表α螺旋,红色代表延伸链,绿色代表β-转角,紫色代表无规则卷曲。
图7PTS基因编码蛋白的二级结构预测
Figure7Secondary structure prediction of the protein encoded by the PTS gene
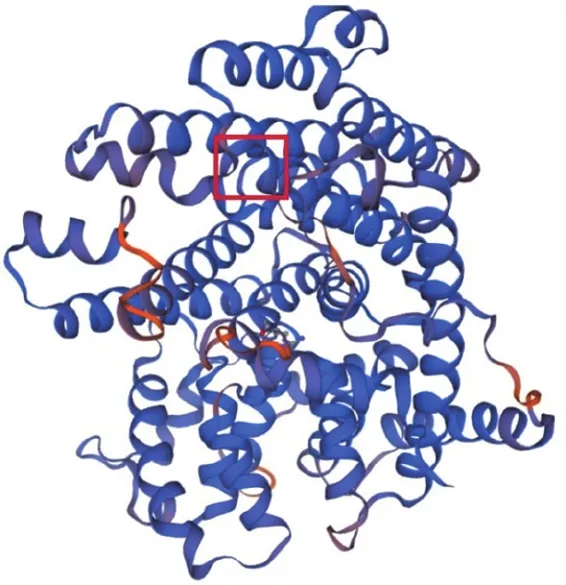
图8PTS基因编码蛋白的三级结构预测
Figure8The tertiary structure prediction of the protein encoded by the PTS gene
据文献报道,富含天冬氨酸的DDXXD(D代表天冬氨酸,X代表任意氨基酸)保守区域被认为是参与协调金属阳离子的酶活性中心的组成部分,广泛存在于萜类合酶中[7,11],其作用是络合金属阳离子,并有助于将反应底物PDF的烃基部分定位在活性口袋内,同时将二磷酸盐部分保留在外部。本研究对海南儋州、海南万宁、印度和印度栽培品的PTS蛋白序列进行分析,发现该DDXXD保守区域在PTS蛋白中位于第304~308号氨基酸,且均为DDVYD,见图8方框部分。
4 讨论
4.1 CPEC法构建表达载体的关键因素
本研究设计引物时通过在引物5′端加入插入位点序列,组成重复序列,重复区域长度一般在15~35 nt范围内。相对于重复序列而言,引物Tm值更具有决定意义。引物重叠区域的Tm值应尽可能的高,理想的Tm值在60~70 ℃之间。因为PCR过程中,较高的退火温度可以保证高水平的特异性扩增。除此之外,CPEC法构建表达载体的另一个关键点在于引物的Tm值的差值尽可能控制在2~3 ℃。较小的Tm值差值可以保证CPEC组装反应中,两个重叠区域退火过程的顺利进行[9]。
环化组装过程,反应条件可以有两种选择,一种是设置一系列退火温度进行考察,该方法工作量相对较大。因此,本研究采用与降落PCR[12-13]相类似的缓慢降温退火,由较高的温度(75 ℃)缓慢降温过程中实现插入片段和线性化载体重复序列的特异性结合,该过程还大大减少了非特异性扩增[9-10]。
由于CPEC特殊的环化机制,使得传统构建方法中经常出现的载体自连现象基本不会出现,因此转化感受态后阳性克隆率相较传统的酶切连接大大提高。本研究中,转化后平板上得到的单菌落基本都是阳性克隆。
4.2 PTS蛋白结构和功能预测
根据PTS基因编码的蛋白,即广藿香醇合酶的理化性质预测结果提示该蛋白在大肠杆菌中诱导表达的时间不应过长,过长可能会发生降解而使得蛋白得率降低。此外,该蛋白的pI为5.39,所以在研究其体外活性时,蛋白提取、纯化以及透析使用的缓冲液不应在此pH附近,否则会有部分蛋白析出。
本文结果显示,PTS蛋白不含信号肽,其细胞定位很可能位于细胞质。据文献报道,在萜类生物合成途径中,倍半萜的下游,从前体法呢基焦磷酸(FDP)的合成开始到倍半萜这一部分只发生在细胞质[14-16]。这与信号肽和亚细胞定位预测结果是相一致的。从结构上看,FDP的碳骨架为链状而广藿香醇为环状,反应过程必定涉及碳链的环化,这也与广藿香醇合酶C末端结构域可能参与线性萜烯的环化预测结果相契合。同时,该结构域可能具结合Mg2+的活性,提示在进行体外活性检测时,配置缓冲液时必须加入Mg2+作为活性激活剂。
4.3 PTS基因的克隆及过表达载体的构建对后续研究奠定基础
广藿香作为“十大广药”之一,在医药、化妆品制造等领域占据着极其重要的地位。其重要化学成分广藿香油多为倍半萜类化合物[4],因此,开展其倍半萜类成分相关基因的克隆研究以及在原植物中过表达相关基因,对广藿香药用资源的开发和应用具有重大意义。本研究成功克隆了广藿香中的PTS基因,并构建pRI101-PTS过表达载体,后续研究将着眼于农杆菌介导转染广藿香,以求从代谢工程方面着手提高植株中广藿香醇等倍半萜的含量。同时,也为探讨广藿香中倍半萜代谢的分子机制研究奠定基础。相信随着对倍半萜类化合物的代谢途径及调控机理的深入研究,对植物体进行基因改造,将有望成为提高药用植物中倍半萜类药效成分合成水平的有效方法[8,18],甚至可以通过微生物代谢工程手段,开发出能合成药用倍半萜的工程菌[17-18],更高效便捷地获取目的产物。
——青蒿素

