2016-2017年成都中医药大学附属医院主要肠杆菌耐药性分析
陈高莉,辛力华,王 芳,吴 波,李 睿,胡琼英
(成都中医药大学附属医院检验科,四川成都 610072)
大肠埃希菌与肺炎克雷伯菌是常见的临床分离菌株,在医院感染致病菌中占较大比重[1]。肺炎克雷伯菌的分离率在革兰阴性杆菌中仅次于大肠埃希菌[2]。近些年来,广谱抗生素尤其是三代头孢应用越来越广泛,且存在一些不合理使用现象,使其耐药性呈逐年上升的趋势[3]。分析本院近两年来,普通病房及ICU病房所分离到的常见肠杆菌科中主要细菌的分布及耐药性的发展趋势,指导和推动本院临床合理应用抗菌药物、制定各种抗感染的经验治疗方案及细菌耐药性的防治都具有极大的参考意义。
1 材料与方法
1.1 标本来源及鉴定
收集本院2016~2017年临床各科室送检标本,包括痰液、血液、尿液、分泌物、脓液等。同一患者多次分离的菌株不重复计入(除非药敏结果不同时),菌株的分离培养按照《全国临床检验操作规程第四版》[4]进行,所有菌株鉴定采用法国梅里埃VITEK 2 compact微生物分析系统鉴定至种。
1.2 药敏试验
采用法国梅里埃VITEK 2 compact微生物分析系统相配套的药敏试验卡进行,所测抗生素包括:氨苄西林、阿莫西林/棒酸、头孢唑啉、头孢他啶、头孢曲松、头孢吡肟、氨曲南、厄他培南、亚胺培南、阿米卡星、庆大霉素、环丙沙星、左氧氟沙星等。
1.3 质量控制
以标准菌株大肠埃希菌ATCC25922和肺炎克雷伯菌ATCC700603,分别作为药敏MIC法质控菌株和ESBLs阳性对照菌株,每次质控结果符合美国临床实验室标准化委员会(CLSI)的质控要求。
1.4 药敏试验结果判断标准
按CLSI 2017年版执行。
1.5 统计分析
菌株及药敏检测数据应用WHONET 5.6软件进行统计。数据分析应用SPSS 17.0统计软件。计数资料的比较行χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 菌种分布
2016年与2017年所分离的肠杆菌科中的主要病原菌为大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌和粘质沙雷菌。其中2016年、2017年普通病房分离率最高均为大肠埃希菌(39.6%、44.3%),而ICU病房分离率最高则为肺炎克雷伯菌(30.0%、47.5%),见表1。
2.2 药物耐药率的比较
从普通病房分离出的大肠埃希菌的耐药率可见,2017年大肠埃希菌ESBLs的阳性检出率,氨苄西林、头孢唑啉的耐药率显著性低于2016年,差异有统计学意义(P<0.05)。见表2。
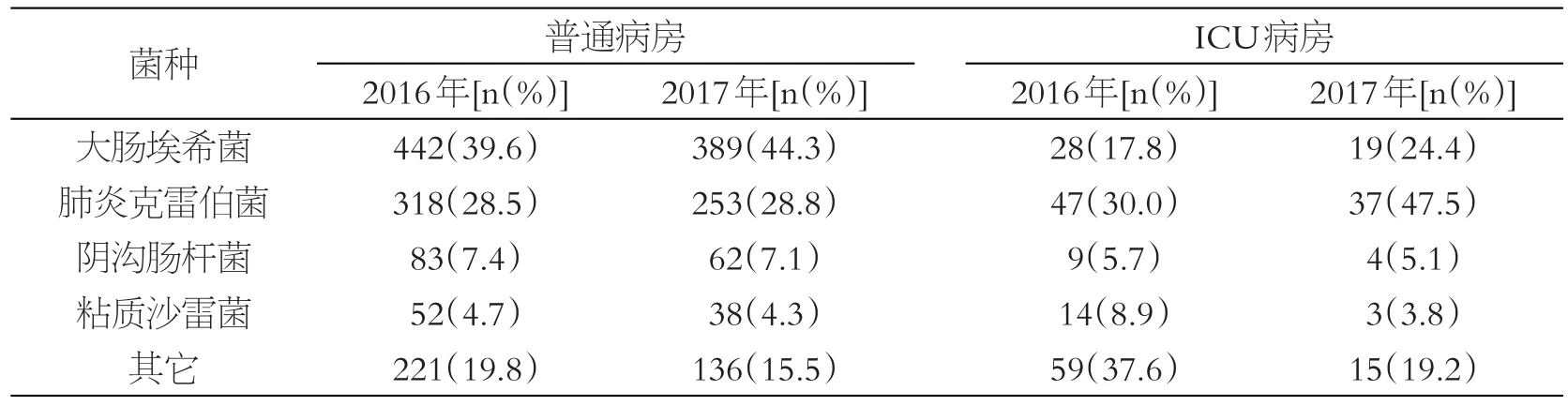
表1 两年普通病房、ICU病房肠杆菌分离情况的比较
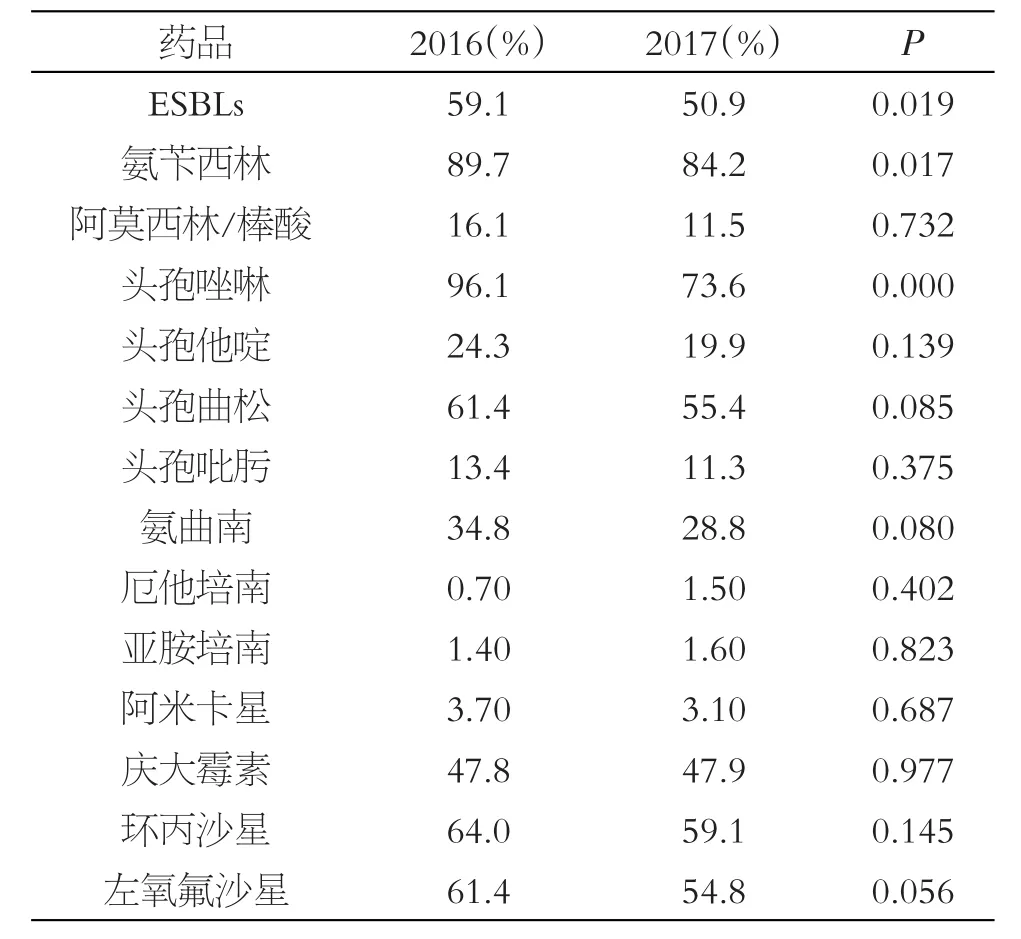
表2 普通病房大肠埃希菌耐药率比较

ICU病房分离出的肺炎克雷伯菌的耐药率表明,2017年阿米卡星、环丙沙星、左氧氟沙星的耐药率显著性高于2016年,差异有统计学意义(P<0.05)。见表3。
2016、2017两年中,大肠埃希菌在ICU病房的耐药谱中,阿莫西林/棒酸、阿米卡星、头孢唑啉、头孢他啶、头孢曲松的耐药率高于普通病房,差异有统计学意义(P< 0.05)。见表4。
2016年,2017年肺炎克雷伯菌在ICU病房的耐药率远远高于普通病房,差异有统计学意义(P<0.05),见表5。

表4 大肠埃希菌在普通病房与ICU病房耐药率比较
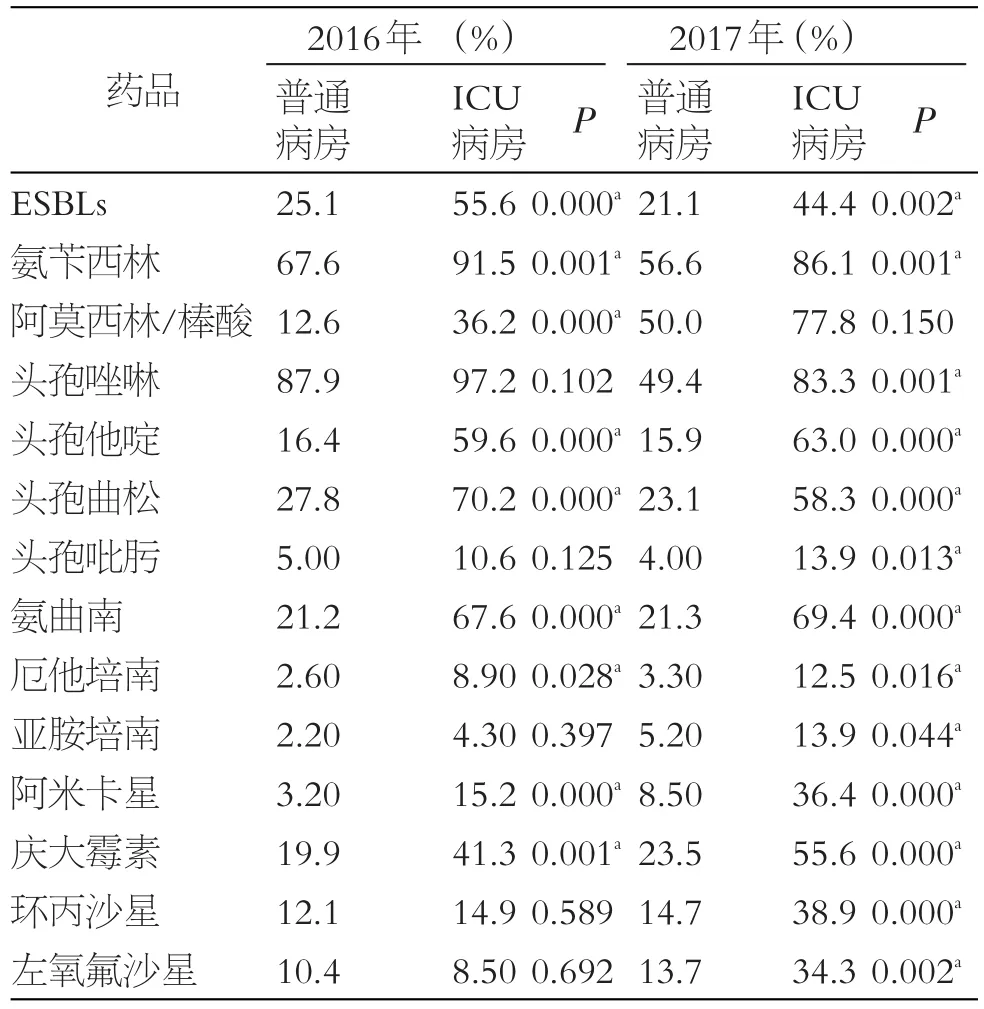
表5 克雷伯菌在不同病房肺炎耐药率比较
3 讨 论
当前,肠杆菌科细菌仍然是医院和社区获得性感染的重要病原菌,治疗宜根据细菌种类及药敏试验结果等选用适当的抗生素。从表1结果显示,所分离菌株中,普通病房以大肠埃希菌分离率最高,占39.6%~44.3%。表2中大肠埃希菌对氨苄西林、头孢唑啉、头孢曲松、环丙沙星、左氧氟沙星的耐药率较高,均超过50%,应限制此类药物的应用;对阿莫西林/棒酸、头孢他啶、头孢吡肟、厄他培南、亚胺培南的耐药性较低,可作为临床用药的选择。2017年大肠埃希菌ESBLs的阳性检出率,氨苄西林、头孢唑啉的耐药率显著性低于2016年;两年中,大肠埃希菌在普通病房与ICU病房的耐药率分析中,普通病房的阿莫西林/棒酸、阿米卡星、头孢唑啉、头孢他啶、头孢曲松、头孢吡肟的耐药率显著性低于ICU病房,见表4。本研究认为:其一,这与2015年国家卫计委出台的《抗菌药物临床应用指导原则(2015年版)》有关。原则指出[5],各医疗机构应根据抗菌药物特点、临床疗效、细菌耐药、不良反应以及当地社会经济状况、药品价格等因素,将抗菌药物分为非限制性使用、限制使用与特殊使用三类进行分级管理,明确各级医师使用抗菌药物的处方权限;本院积极响应卫计委政策,对全院的抗生素使用实行严格分级管理。其二,普通病房的患者多为社区获得性感染后首次就诊,基础疾病少,联合用药几率小,住院时间短,周转期快,院内感染机会小。
肺炎克雷伯菌属于临床上比较常见的病原菌,近几年的分离率不断升高[6],甚至已经达到了第二位[7]。它是医院内获得性感染最主要的病原菌[8]。从表1可见,ICU病房以肺炎克雷伯菌分离率最高,占30.0%~47.5%。表3中肺炎克雷伯菌对氨苄西林、头孢唑啉、头孢他啶、头孢曲松、氨曲南的耐药率已超过50%,应限制此类药物的应用。有文献报道,在临床分离的菌株中喹诺酮类药物耐药率高达50%以上[9-10],而本院分离自ICU病房的耐药率在8.5%~38.9%之间,这一差别可能跟细菌的来源、不同的耐药机制、患者的基础疾病、住院时间、用药选择、研究对象等有关,所以在临床中对此类药的使用应慎重。本研究中,喹诺酮类的耐药率有逐年增高的趋势:2017年环丙沙星、左氧氟沙星的耐药率显著性高于2016年。喹诺酮类抗菌药物的耐药机制有[11]:①细菌改变外膜的一种OmpF蛋白,从而改变胞膜的通透性,减少药物进入细菌内;②细菌DNA螺旋酶和拓扑异构酶Ⅳ的改变;③质粒介导耐药,有qnr基因、aac(6')-lb-cr基因、qepA和oqxAB基因[12];④抗菌药物剂量、疗程不足造就耐药。本文中耐药率的增加可能为以上一种机制或几种机制共同参与导致。阿米卡星的耐药率也有逐年增高的趋势:有文献显示[13-15],由于肺炎克雷伯菌存在氨基糖苷乙酰转移酶(AAC)耐药基因,并且该耐药基因可以被阿米卡星诱导而表达增加。因AAC等耐药基因的存在,氨基糖苷修饰酶的大量表达,抗生素被修饰后与细菌核糖体氨酰-tRNA的亲和力大大减弱,失去了干扰细菌蛋白质合成的能力,使细菌对氨基糖苷类药物产生抗性。另外,表5中,ICU病房分离出的肺炎克雷伯菌,13种抗菌药物的耐药率几乎全部显著性高于普通病房。这与ICU病房的患者基础疾病重,接受侵入性操作以及长期、大量使用广谱抗菌药物以及医患间频繁接触增加了院内交叉感染的危险性有关[16];据文献报道,肺炎克雷伯菌的泛耐药性,与产ESBLs的细菌具有多个耐药基因和多种耐药酶有关:比如AcrAB外排泵基因的高表达可致喹诺酮类抗生素MIC值升高[17]、通过质粒介导的外排泵基因使得耐药基因在不同种属菌株之间进行水平传播[18]、肺炎克雷伯菌对碳青霉烯类抗菌药物耐药主要是产KPC-2碳青霉烯酶,产碳青霉烯酶的某些菌株可同时产ESBLs或AMPC酶,即存在外排泵过度表达或膜孔蛋白突变[19]、β-内酰胺类耐药主要为产β-内酰胺酶,β-内酰胺酶基因由MGEs介导容易传播[20]等。
4 结 论
本院普通病房所分离的大肠埃希菌的部分药物的耐药率有降低趋势;而ICU病房所分离的肺炎克雷伯菌的部分药物的耐药率有增高趋势;ICU病房分离的大肠埃希菌与肺炎克雷伯菌的抗生素耐药率显著性高于普通病房。所以临床上应根据药敏试验结果、感染部位、抗菌药物耐药机制等综合因素,合理应用抗菌药物,尽量减少经验性用药,并加强院内感染的预防和控制。同时,微生物室每月应做好各类细菌的检出率和药物耐药率的统计上报工作,及时反馈给临床,为临床调整抗生素的使用提供依据。

