跑台运动通过激活AMPK减少APP/PS1小鼠海马Aβ沉积
闫清伟,赵 娜,夏 杰,李百侠,崔海燕
单磷酸腺苷活化蛋白激酶(adenosine 5'-monophosphateactivated protein kinase,AMPK)是能量代谢的开关,对维持机体能量代谢稳态有重要调节作用。研究证实,大脑能量代谢减退与阿尔茨海默症(Alzheimer's disease,AD)病理进程密切相关,能源物质ATP可抑制β-淀粉样蛋白(beta-Amyloid,Aβ)的高分子聚集,减弱其神经毒性,降低脑内老年性斑块(Senile plaques,SPs)的形成,继而发挥抗AD效应;而ATP合成不足,则可加速AD病理(Coskuner et al.,2014;Jung et al.,2012;Muller et al.,2017)。β-位淀粉样前体蛋白裂解酶1(beta-site amyloid precursor protein cleaving enzyme 1,BACE1)是Aβ生成的一种关键裂解酶,另外,能量代谢相关因子,如AMPK、去乙酰化酶1(Sirtuin1,Sirt1)、过氧化物酶体增殖物激活受体γ(peroxisome proliferatoractivated receptor gamma,PPARγ)、过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor gamma coactivator 1 alpha,PGC1α)等可调节BACE1表达。有研究认为,AMPK-BACE1(即AMPK-Sirt1-PPARγ-PGC1α-BACE1)通路可调节Aβ生成,大脑能量代谢减退可通过下调AMPK活性及后续相关因子表达,产生级联反应,最终上调BACE1的脑内表达(Wang et al.,2013),继而增加脑内Aβ沉积,这可能是大脑能量代谢减退造成脑内SPs增多、认知功能减退的重要病理机制。
合理的运动对AD病理有积极的改善作用。2013年9月,华盛顿召开了国际大脑与营养学会议,会议上有学者指出,保持运动和健康生活方式是防治AD发病的有效措施(Barnard et al.,2014)。另有研究通过对MEDLINE,CINAHL,Web of Science,and Scopus等数据库文献研究发现,运动可提高AD患者的持续注意力、视觉记忆及前额叶认知功能(Hernandez et al.,2015)。对人体进行的实验研究也证实,3个月的有氧运动可以改善轻度AD患者的认知功能(Yang et al.,2015)。近年来有动物实验研究证实,运动可抑制Aβ生成,改善AD认知功能(余锋 等,2016;Koo et al.,2017;Moore et al.,2016;Zhang et al.,2017)。然而,关于运动改善AD病理,抑制Aβ沉积的分子机制,目前仍未探明。体育科学领域的研究证实,适当的运动可提高骨骼肌AMPK活性,上调Sirt1蛋白表达,影响AMPK/PGC1α信号(许杰 等,2018;Hoffman et al.,2015;Liao et al.,2017;Niederberger et al.,2015),但关于运动是否可提高脑内AMPK活性,影响AMPK-BACE1通路信号,继而影响Aβ生成与沉积的系统研究,目前鲜见报道。
APP/PS1小鼠是AD研究领域中一种经典的转基因动物模型,该模型小鼠体内被转入人类突变的APPSwe和PS1(PSEN1dE9)2个AD致病基因,导致APP/PS1小鼠自3月龄开始,脑内Aβ沉积逐渐增多,至5~6月龄时,脑内Aβ沉积更加显著,此时可检测出明显SPs,同时小鼠学习记忆能力显著下降(Collins et al.,2015;Guo et al.,2015;Mei et al.,2016;Sorrentino et al.,2017)。为探讨运动降低Aβ的分子机制,本研究采用APP/PS1小鼠为研究对象,对小鼠海马AMPK-BACE1通路及其相关因素进行系统检测与研究。
1 材料与方法
1.1 实验动物及分组
本实验所用APP/PS1转基因小鼠和同窝野生型(wide type,WT)小鼠均购自南京模式动物中心,生产许可证号:SCXK(2015-0001),饲养环境温度:23℃~26℃,湿度50%~65%,12 h光照/12 h黑暗,SPF级转基因动物标准饲料,所有小鼠均自由饮食。
将3月龄APP/PS1小鼠48只及WT小鼠48只分别随机分组,即APP/PS1型小鼠分为APP/PS1安静对照组(ADC组,n=24)和APP/PS1运动组(ADE组,n=24),WT小鼠分为野生安静对照组(WTC组,n=24)和野生运动组(WTE组,n=24)。
1.2 运动方案
自3月龄开始,对ADE组、WTE组小鼠进行12周跑台运动。运动方案参考Baker等(1999)的研究,并做适当调整。本实验采用45%~55%最大摄氧量(45%~55%O2max)的中等强度有氧运动,通过文献分析及适应性训练发现,该运动方案在各组小鼠的可承受范围内,各组小鼠均能完成本运动训练。具体方案由1周运动适应和12周正式运动组成。
1周运动适应:第1~2天速度5 m/min,第3~4天速度8 m/min,第5~6天速度12 m/min。第1天运动时间20 min,之后每天延长5 min,至第6天运动时间延长至45 min。每天运动时间固定在18:00-20:00。周日休息。
12周正式运动:适应性运动1周后进行12周正式运动,每周一、二、三、五、六的18:00-20:00运动,周四、六休息。每天运动方案:5 m/min×5 min,8 m/min×5 min,12 m/min×30 min,最后以5 m/min×5 min后结束,总运动时间为45 min。同时,为避免跑台环境刺激的干扰,减少各组小鼠运动之外的刺激差异,每天将WTC组和ADC组小鼠置于安静跑台相同时间。
1.3 取材
12周正式运动结束后,小鼠禁食12 h,取各组小鼠18只,异氟烷吸入法麻醉后脱颈处死,取海马组织,置液氮降温后转移至-80℃冰箱保存待测。各组余6只小鼠,腹腔注射10%的水合乙醛(3.5 ml/kg)麻醉后,进行心脏灌注法固定,先用0.9%的生理盐水灌注,待肝脏变白后改用4%多聚甲醛灌注固定,至小鼠身体僵直变硬后取全脑,并将全脑置入4%多聚甲醛浸泡固定24 h后,进行脱水、石蜡包埋。
1.4 ELISA实验
取小鼠海马组织20 mg,按质量/体积比mg:μl=1:9加入预冷的1×PBS,制备海马组织匀浆,采用AMP、ATP试剂盒(上海酶联,ml6037251,ml9037510)进行ELISA实验,测定海马AMP、ATP浓度,计算AMP/ATP比值。ELISA实验基本步骤包括:试剂的室温平衡、划分板区与上样、抗体孵育、洗涤、底物反应、终止及检测、计算浓度等。
1.5 RT-qPCR实验
取海马组织20 mg,采用Trizol法加相应试剂提取海马总RNA。按照TOYOBO反转录试剂盒(FSQ-101)说明书进行反转录,制备海马cDNA。采用SYBR Green法进行RT-qPCR实验,根据所测目的基因和内参基因CT值,计算ΔCT值,采用2-ΔΔCT法计算目的基因相对表达水平。基因引物如表1所示。

表1 基因引物序列Table 1 Gene Primers Sequence
1.6 Western Blot实验
取海马组织20 mg,按mg:μl=1:7比例加入相应体积RIPA裂解液,提取海马总蛋白,BCA法测定蛋白浓度后配平,蛋白变性后,进行电泳、转膜、封闭、一抗孵育、洗涤、二抗孵育、洗涤、蛋白印迹成像,用Alpha Ease FC软件进行数据采集。抗体信息如表2所示。
表2 抗体信息Table 2 Antibody Information
1.7 免疫组织化学实验
取制备好的蜡块进行制片、脱蜡、抗原修复、内源过氧化物酶的阻断、封闭、抗体孵育(Aβ,ab2539,1:100;羊抗兔,Jackson Immuno Research,1:1 000)、DAB显色、细胞核染色、脱水封片、拍照。采用Image-Pro Plus 6.0软件,计算脑内单位面积SPs水平,本实验采用图像视野内SPs的积分光密度值(IOD sum)除以视野区域面积(area sum,即视野内的全部像素数量总和)反映单位面积内SPs水平。
1.8 数据统计
数据统计与作图采用Graphpad Prism 7.0软件,数据以均值±标准差(M±SD)表示,统计方法采用双因素方差分析(two-way ANOVA),事后检验采用Bonferroni法,以P<0.05代表差异具有显著性,P<0.01代表差异具有极显著性。
2 结果
2.1 小鼠海马AMP、ATP浓度及其比值结果
2.1.1 小鼠海马AMP浓度结果
基因和运动对AMP影响的主效应均不显著[F(1,20)=7.2342.707,P=0.115 5;F(1,20)=2.396,P=0.137 3],交互作用显著[F(1,20)=7.147,P=0.014 6]。进一步分析发现,ADC组小鼠海马AMP较WTC组显著降低(P<0.05),ADE组小鼠海马AMP较ADC组显著升高(P<0.05,图1)。
2.1.2 小鼠海马ATP浓度结果
基因对ATP影响的主效应不显著[F(1,20)=2.396,P=0.137 3],运动对ATP影响的主效应显著[F(1,20)=10.17,P=0.004 6]。二者对ATP的交互作用显著[F(1,20)=26.41,P<0.000 1]。进一步分析发现,ADC组小鼠海马ATP较WTC组显著降低(P<0.01),ADE组小鼠海马ATP较ADC组显著升高(P<0.01,图1)。
2.1.3 小鼠海马AMP/ATP比值结果
基因和运动对AMP/ATP比值影响的主效应显著[F(1,20)=25.78,P<0.000 1;F(1,20)=9.954,P=0.005],二者对AMP/ATP的交互作用不显著[F(1,20)=2.221,P=0.151 8]。进一步分析发现,ADC组小鼠海马AMP/ATP比值较WTC组显著降低(P<0.01),ADE组小鼠海马AMP/ATP较ADC组显著升高(P<0.05,图1)。
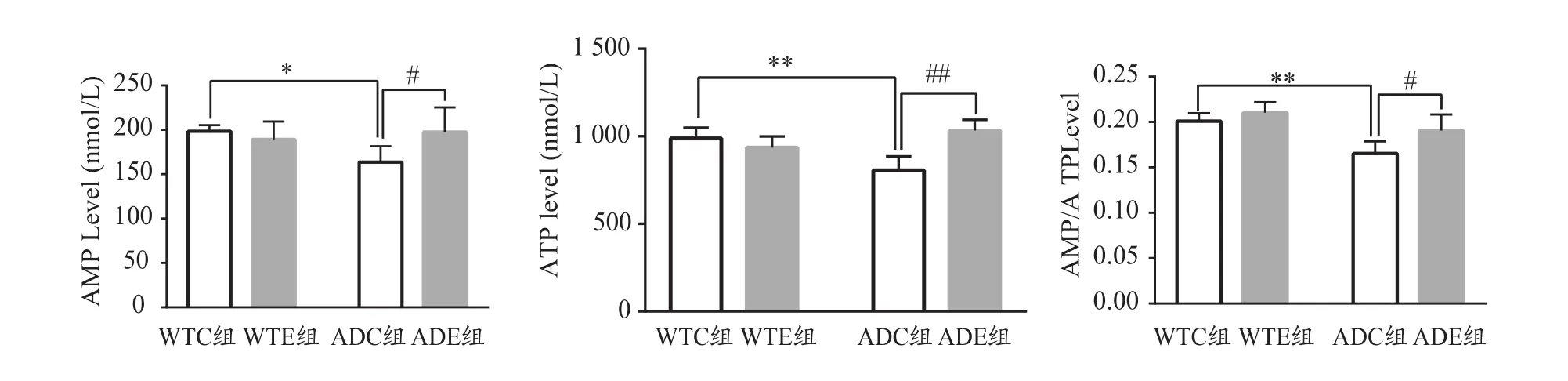
图1 各组小鼠海马ATP、AMP及AMP/ATP水平(n=6)Figure 1. Levels of ATP,AMP and AMP/ATP in the Mice Hippocampus of Each Group
2.2 小鼠海马AMPK表达结果
2.2.1 小鼠海马AMPK mRNA表达结果
基因和运动均对AMPK mRNA影响的主效应显著[F(1,20)=15.82,P=0.000 7;F(1,20)=10.33,P=0.004 3]。二者对AMPK mRNA的交互作用不显著[F(1,20)=1.26,P=0.274 9]。进一步分析发现,ADC组小鼠海马AMPK mRNA较WTC组显著降低(P<0.05),ADE组小鼠海马AMPK mRNA较ADC组显著升高(P<0.05,图2)。
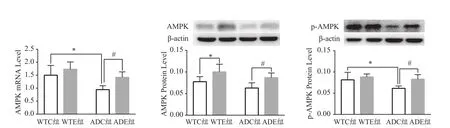
图2 各组小鼠海马AMPK表达结果(n=6)Figure 2. Expression of AMPK in Mice Hippocampus
2.2.2 小鼠海马AMPK蛋白表达结果
基因和运动均对AMPK 蛋白质影响的主效应显著[F(1,20)=6.631,P=0.018 1;F(1,20)=18.61,P=0.000 3]。二者对小鼠海马AMPK蛋白的交互作用不显著[F(1,20)=0.018 53,P=0.893 1]。进一步分析发现,与WTC组相比,ADC组小鼠AMPK蛋白表达有所降低,但差异不具有统计学意义(P>0.05),而WTE组AMPK蛋白较WTC组显著升高(P<0.05),ADE组AMPK蛋白较ADC组显著升高(P<0.05,图2)。
2.2.3 小鼠海马磷酸化AMPK蛋白表达结果
基因和运动均对磷酸化AMPK(phosphorylation AMPK,p-AMPK)影响的主效应显著[F(1,20)=7.517,P=0.012 6;F(1,20)=9.585,P=0.005 7]。二者对p-AMPK的交互作用不显著[F(1,20)=2.583,P=0.123 7]。进一步分析发现,ADC组小鼠海马p-AMPK蛋白较WTC组显著降低(P<0.05),ADE组小鼠海马p-AMPK较ADC组显著升高(P<0.05,图2)。
2.3 小鼠海马Sirt1、PPARγ、PGC1α蛋白表达结果
2.3.1 小鼠海马Sirt1蛋白表达结果
基因和运动均对Sirt1 蛋白影响的主效应显著[F(1,20)=15.96,P=0.000 7;F(1,20)=10.22,P=0.004 5]。二者对Sirt1蛋白的交互作用不显著[F(1,20)=1.644,P=0.214 4]。进一步分析发现,ADC组小鼠海马Sirt1蛋白较WTC组显著降低(P<0.01),ADE组小鼠海马Sirt1蛋白较ADC组显著升高(P<0.05,图3)。
2.3.2 小鼠海马PPARγ蛋白表达结果
基因和运动均对PPARγ蛋白影响的主效应显著[F(1,20)=15.16,P=0.000 9;F(1,20)=7.195,P=0.014 3]。二者对PPARγ蛋白的交互作用不显著[F(1,20)=2.509,P=0.128 9]。进一步分析发现,ADC组小鼠海马PPARγ蛋白较WTC组显著降低(P<0.01),ADE组小鼠海马PPARγ蛋白较ADC组显著升高(P<0.05,图3)。
2.3.3 小鼠海马PGC1α蛋白表达结果
基因和运动均对PGC1α蛋白的主效应显著[F(1,20)=11.44,P=0.003 0;F(1,20)=9.747,P=0.005 4]。二者对PGC1α蛋白的交互作用不显著[F(1,20)=2.84,P=0.107 5]。进一步分析发现,ADC组小鼠海马PGC1α蛋白较WTC组显著降低(P<0.05),ADE组小鼠海马PGC1α蛋白较ADC组显著升高(P<0.05,图3)。
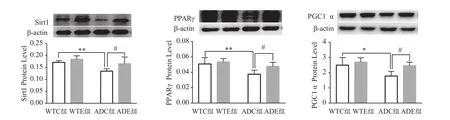
图3 各组小鼠海马Sirt1、PPARγ、PGC1α蛋白表达结果(n=6)Figure 3. Protein Expression of Sirt1、PPARγ、PGC1α in Mice Hippocampus
2.4 小鼠海马BACE1表达结果
2.4.1 小鼠海马BACE1 mRNA表达结果
基因对BACE1 mRNA影响的主效应显著[F(1,20)=14.5,P=0.001 1],运动对BACE1 mRNA的主效应不显著[F(1,20)=3.634,P=0.071 1]。二者对BACE1 mRNA的交互作用显著[F(1,20)=5.535,P=0.029 0]。进一步分析发现,ADC组小鼠海马BACE1 mRNA较WTC组显著升高(P<0.01),ADE组小鼠海马BACE1 mRNA较ADC组显著降低(P<0.05,图4)。
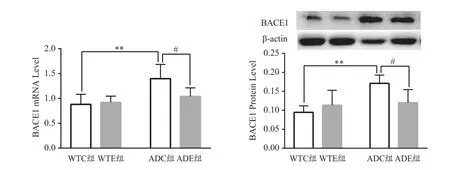
图4 各组小鼠海马BACE1的mRNA和蛋白表达结果(n=6)Figure 4. mRNA and Protein Expression of BACE1in Mice Hippocampus
2.4.2 小鼠海马BACE1蛋白表达结果
基因对BACE1蛋白影响的主效应显著[F(1,20)=11.87,P=0.002 6],运动对BACE1蛋白的主效应不显著[F(1,20)=1.752,P=0.200 5]。二者对BACE1蛋白的交互作用显著[F(1,20)=8.243,P=0.009 4]。进一步分析发现,ADC组小鼠海马BACE1蛋白较WTC组显著升高(P<0.01),ADE组小鼠海马BACE1蛋白较ADC组显著降低(P<0.05,图4)。
2.5 小鼠海马Aβ蛋白及SPs结果
2.5.1 小鼠海马Aβ蛋白结果
基因和运动对Aβ蛋白影响的主效应显著[F(1,20)=62.17,P<0.000 1;F(1,20)=23.05,P=0.000 1]。二者对Aβ蛋白影响的交互作用不显著[F(1,20)=3.311,P=0.083 8]。进一步分析发现,ADC组小鼠海马Aβ蛋白较WTC组极显著性升高(P<0.01),ADE组小鼠海马Aβ蛋白较ADC组极显著性降低(P<0.01,图5)。
2.5.2 小鼠海马SPs结果
基因和运动对SPs影响的主效应显著[F(1,20)=140.5,P<0.000 1;F(1,20)=18.46,P=0.000 4]。二者对SPs的交互作用不显著[F(1,20)=2.618,P=0.121 3]。进一步分析发现,ADC组小鼠海马SPs较WTC组显著升高(P<0.01),ADE组小鼠海马SPs较ADC组显著降低(P<0.01,图6)。
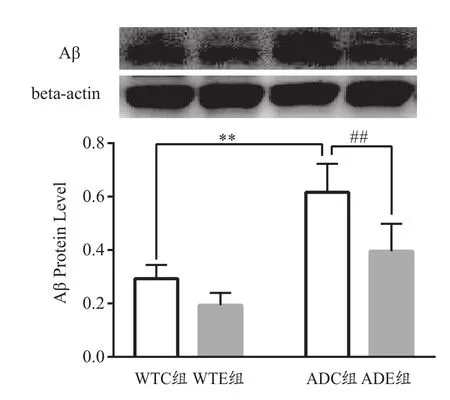
图5 各组小鼠海马Aβ蛋白水平(n=6)Figure 5. Aβ Protein Level in Mice Hippocampus of Each Group
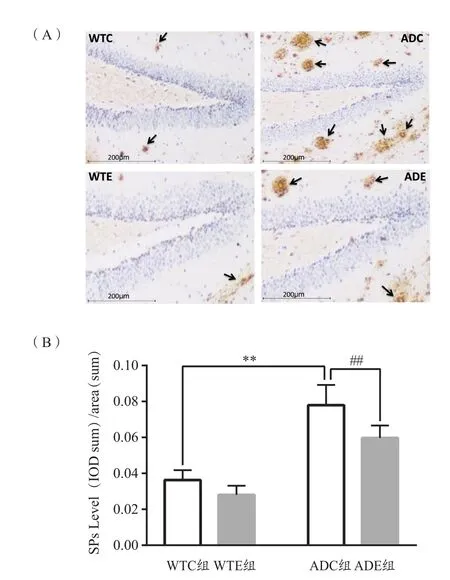
图6 各组小鼠海马Aβ蛋白和SPs水平(n=6)Figure 6. SPs Level in Mice Hippocampus of Each Group
3 讨论
3.1 运动对小鼠AMPK-BACE1通路的影响
海马能量代谢减退可能导致和加剧AD病理。研究证实,能量代谢不足可上调Aβ的产生和沉积,其分子机制与AMPK-BACE1通路有关(Wang et al.,2013),该通路包括AMPK、Sirt1、PPARγ、PGC1α、BACE1等几个关键基因。本研究证实,12周跑台运动可降低6月龄APP/PS1小鼠海马Aβ,而运动对Aβ的这一抑制效应是否与上述通路有关,目前尚不清楚。因此,为探讨运动下调BACE1基因表达,减少Aβ的分子机制,本实验对AMPK-BACE1通路关键基因及相关因素进行了系统研究。
3.1.1 运动对小鼠海马AMPK的影响
AMPK是机体能量代谢的开关,对细胞能量代谢稳态起关键作用。AMPK活性受AMP/ATP调节,即AMP/ATP比值增高,AMPK活性增强,比值下降,AMPK活性降低(Ke et al.,2018)。p-AMPK是AMPK的活性形式,其表达水平反映了AMPK活性水平。
AMPK活性降低可加剧AD病理。对6月龄APP/PS1小鼠的研究证实,大脑海马p-AMPK降低,Aβ增多(Ou et al.,2018)。7月龄APP/PS1小鼠海马p-AMPK显著低于野生对照组,二甲双胍可上调APP/PS1小鼠海马p-AMPK,下调BACE1,改善AD病理(Pedros et al.,2014)。上述研究提示,AMPK与AD病理密切相关,AMPK活性下降可能诱发AD病理。与上述研究一致,本研究证实,6月龄APP/PS1小鼠(ADC组)海马AMPK mRNA和p-AMPK均显著低于同月龄WTC组水平,提示其AMPK活性下降。尽管两组间AMPK mRNA存在显著差异,但两组间AMPK蛋白水平差异不具有统计学意义(P>0.05),进一步分析认为,造成这一现象的原因可能与两组小鼠AMPK蛋白的降解程度不同有关,并且,磷酸化形式的AMPK(p-AMPK)可能更容易降解,本研究结果显示,WTC组小鼠海马p-AMPK显著高于ADC组,这可能是导致两组AMPK蛋白差异不明显的原因。本研究同时证实,APP/PS1小鼠海马AMP、ATP浓度及AMP/ATP比值显著低于WTC组,进一步佐证了APP/PS1小鼠海马AMPK活性的下降。另外,本研究证实APP/PS1小鼠海马ATP含量降低,提示,该模型小鼠脑能量代谢受阻,脑内可能存在低能量代谢应激。
研究证实,上调脑p-AMPK,可提高AMPK活性,继而减少脑内Aβ的生成(Vingtdeux et al.,2010;Zhu et al.,2013),这可能是AD治疗的一个有效靶标。对骨骼肌和脑组织的研究均证实,运动可上调AMPK活性(Ke et al.,2018;Kjobsted et al.,2017;Krishna et al.,2017)。本研究也证实,12周跑台运动可上调APP/PS1小鼠海马AMPK mRNA水平,同时上调AMPK和p-AMPK的蛋白表达水平,进一步佐证了运动可增强APP/PS1小鼠海马AMPK活性。本研究同时证实,12周跑台运动可增加APP/PS1小鼠海马AMP、ATP含量,上调AMP/ATP比值,进一步证明了运动对海马AMPK的激活效应。综上研究提示,6月龄APP/PS1小鼠海马AMPK活性下降,ATP含量降低,脑内存在相应能量代谢应激,12周跑台运动可上调AMPK活性,改善海马能量代谢。
3.1.2 运动对小鼠海马Sirt1表达的影响
Sirt1是一种NAD依赖性去乙酰化酶,可调控基因的表观遗传学沉默,与能量代谢相关,上调Sirt1可增强胰岛素敏感性(Liu et al.,2016)。另外,Sirt1与AD病理密切相关。研究证实,Sirt1可促进Aβ降解,抑制Aβ造成的神经凋亡,Sirt1不足,认知功能下降(Chen et al.,2016;Cho et al.,2015;Kumar et al.,2017)。激活中枢神经系统Sirt1可延缓AD转基因小鼠的神经退变进程,抑制Aβ生成(Hou et al.,2016;Marques et al.,2012)。研究证实,2、4、6月龄3xTg-AD小鼠海马Sirt1水平持续下降,脑内Aβ增多(Torres-lista et al.,2014)。上述研究提示,Sirt1可抑制脑内Aβ生成,Sirt1表达不足可导致脑内Aβ增多,加速AD病理。本研究证实,与WTC组相比,ADC组小鼠海马Sirt1蛋白表达降低,与上述研究结果一致,提示,Sirt1参与了APP/PS1小鼠病理进程。上调Sirt1表达,可能有助于改善AD病理。研究证实,6个月跑轮运动可上调3xTg-AD小鼠脑内Sirt1表达,改善其认知功能(Revilla et al.,2014)。本研究证实,12周跑台运动可上调APP/PS1小鼠海马Sirt1蛋白表达,抑制脑内Aβ,与上述研究结果一致。
3.1.3 运动对小鼠海马PPARγ表达的影响
PPARγ可抑制AD病理。有研究发现,β-丁香烯可激活大麻素受体2和PPARγ通路,减少APP/PS1小鼠大脑Aβ沉积,改善认知功能(Cheng et al.,2014)。传统中药三七可激活PPARγ,减少6月龄APP/PS1小鼠脑内Aβ沉积,改善小鼠认知功能,而采用PPARγ拮抗剂GW9662则可阻断这一效应(Li et al.,2015)。对8月龄APP/PS1小鼠腹腔注射姜黄素4周,可激活PPARγ,抑制Aβ沉积,改善小鼠记忆能力,PPARγ拮抗剂GW9662同样也可阻断这一效应(Liu et al.,2016)。综上研究提示,PPARγ可通过抑制Aβ,改善AD病理,PPARγ表达及活性降低可能与大脑认知功能障碍有关。本研究证实,6月龄APP/PS1小鼠海马PPARγ蛋白表达显著低于WTC组,12周跑台运动可上调海马PPARγ表达,提示,PPARγ表达下调可能介导了6月龄APP/PS1小鼠海马Aβ的大量沉积,而12周跑台运动可抑制这一现象。
3.1.4 运动对小鼠海马PGC1α表达的影响
PGC1α是线粒体生物发生的主要调节蛋白,是调节细胞能量代谢相关基因的转录共激活因子(Dorn et al.,2015;Sanchis-gomar et al.,2014;Valero et al.,2014)。通过核受体PPARγ,PGC1α可与多种转录因子相互作用,调控相关基因的转录与翻译。近期研究证实,PGC1α可抑制Aβ生成(Xia et al.,2017)。AD患者大脑PGC1α表达下降,且伴有线粒体功能异常(Austin et al.,2012;Sweeney et al.,2016)。研究证实,自3月龄开始,APP/PS1小鼠海马即表现出PGC1α蛋白表达下降(Ettcheto et al.,2016)。上述研究提示,PGC1α表达下调可能参与了AD病理进程。本研究证实,6月龄APP/PS1小鼠海马PGC1α蛋白表达显著降低,提示,PGC1α表达下调可能介导了该模型小鼠的病理进程,这可能和本实验中6月龄小鼠所表现出的能量代谢减退有关。PGC1α蛋白表达受Sirt1调控,Sirt1可与PGC1α绑定结合,并通过去乙酰化作用激活PGC1α(Gurd,2011;Yu et al.,2018)。近年来的研究显示,运动可上调PGC1α蛋白表达(Erlich et al.,2018)。本研究也证实,12周跑台运动可显著上调PGC1α蛋白质表达水平,这可能和运动抑制APP/PS1小鼠海马Aβ,改善AD病理有关。有研究显示,AMPK可通过调节NAD+/NADH调控Sirt1表达,Sirt1还可影响PGC1α、PPARγ等能量代谢调控因子(Chen et al.,2016;Shin et al.,2014)。提示,12周跑台运动上调PPARγ和PGC1α表达,改善APP/PS1小鼠病理的机制可能和激活AMPK,进而上调Sirt1表达有关。
3.1.5 运动对小鼠海马BACE1及海马区Aβ沉积的影响
BACE1是AD病理中重要的β-裂解酶。Aβ学说认为,正常情况下,APP经α-裂解酶裂解生成C83片段,C83再经γ-裂解,此过程不产生Aβ,而在衰老和AD病理进程中,更多的APP经β-裂解酶裂解产生C99片段,再经γ-裂解产生神经毒性物质Aβ,可见BACE1在AD病理中扮演着重要角色。对11月龄APP/PS1雌性小鼠的研究证实,上调BACE1,脑内Aβ沉积增多,下调BACE1,脑内Aβ沉积减少(Li et al.,2015)。该研究结果提示,BACE1是介导脑内Aβ沉积的关键,BACE1的表达变化可作为评价AD病理的一个重要指标。
本研究证实,6月龄APP/PS1小鼠海马BACE1基因mRNA和蛋白表达均显著高于WTC组,大脑海马区Aβ蛋白增多,SPs增多,提示,6月龄APP/PS1小鼠海马β-裂解作用增强。然而也有研究显示,6月龄APP/PS1小鼠脑Aβ沉积增多,SPs周围BACE1聚集增多,学习记忆能力下降,但与野生对照组相比,BACE1蛋白表达未表现出显著性差异(Luo et al.,2016)。进一步分析认为,检测组织不同可能是造成检测结果不同的主要原因,该研究检测组织为全脑,而本研究检测的是海马组织,海马是学习记忆的关键脑区,在衰老和AD病程中,海马首先受到侵害。6月龄APP/PS1小鼠可能尚未表现出全脑BACE1蛋白上调,如脑干、小脑等脑区尚未发生相应的病理学变化,当提取整个脑组织蛋白时,其海马BACE1蛋白的有限上调可能会被全脑组织蛋白所稀释。
下调BACE1可能有利于AD病理改善。对7月龄APP/PS1小鼠补充8周叶酸可显著下调BACE1基因的转录与翻译,减少脑内Aβ,改善AD病理(Tian et al.,2016)。5个月中等强度跑台运动可降低10月龄APP/PS1小鼠海马及皮质BACE1蛋白,减少Aβ沉积(Zhang et al.,2017)。与上述结果一致,本研究证实,12周跑台运动可显著降低6月龄APP/PS1小鼠海马BACE1基因的mRNA和蛋白表达,下调海马Aβ蛋白,减少SPs。提示,跑台运动可通过下调海马BACE1,改善APP/PS1小鼠病理。近期有研究认为,运动对BACE1的下调效应仅对大脑功能受损组有效,而对正常组无效(Alkadhi et al.,2018),本研究也证实,12周跑台运动并未改变WTC组小鼠海马BACE1基因的mRNA和蛋白水平。提示,12周跑台运动可能对正常组小鼠海马APP代谢无显著影响,这可能与正常组小鼠海马APP及BACE1表达较低,尚处于正常生理代谢范围有关。
3.2 运动对小鼠海马AMPK-BACE1通路影响的整体分析
海马能量代谢减退可能参与了APP/PS1小鼠的病理进程,能量代谢不足可上调Aβ的产生和沉积。有研究认为,能量代谢应激造成脑内Aβ增多的分子机制与AMPKBACE1通路有关(Wang et al.,2013)。其分子机理为,能量代谢应激可造成AMPK活性下降,继而引起Sirt1表达下降,造成Sirt1去乙酰化作用减弱,下调PPARγ及PGC1α的蛋白表达。而后两者是BACE1基因表达的关键抑制因子,二者可与BACE1基因启动子区的PPRE和YY1位点结合,抑制BACE1基因的转录与翻译。但在衰老及AD大脑中,由于AMPK活性下降,Sirt1表达下降,引起PPARγ和PGC1α表达下降,造成其对BACE1基因的转录抑制效应减弱,导致BACE1表达上调,最终增强APP的β-裂解,这被认为是能量代谢应激上调Aβ,加剧AD病理的分子机制。本研究证实,与同窝WT小鼠相比,6月龄APP/PS1小鼠海马ATP减少,AMP/ATP降低,p-AMPK降低,Sirt1、PPARγ、PGC1α蛋白表达下降,BACE1基因的mRNA和蛋白表达水平均表现为上调,与上述研究结果一致。本研究同时证实,APP/PS1小鼠海马SPs增多,进一步印证,该模型小鼠海马BACE1表达上调,APP的β-裂解作用增强。综上提示,海马能量代谢减退,可通过AMPK-BACE1通路增加6月龄APP/PS1小鼠Aβ生成,这可能是该模型小鼠脑内Aβ增多的重要机制。运动可改善脑内能量代谢,降低脑内Aβ沉积。有研究证实,12周跑台运动可上调12月龄APP/NSE雌性小鼠脑Sirt1、PGC1α蛋白表达,下调BACE1蛋白表达,最终减少Aβ生成(Koo et al.,2017)。本研究也证实,12周跑台运动可提高APP/PS1小鼠海马ATP含量,增加AMP/ATP比值,上调AMPK、p-AMPK、Sirt1、PPARγ、PGC1α等蛋白表达水平,下调BACE1基因的mRNA和蛋白表达水平,最终表现为海马区Aβ沉积的减少。综上研究提示,运动下调APP/PS1小鼠脑内Aβ,可能和运动激活AMPK,改善AMPK-BACE1通路,下调BACE1表达有关,这可能是连接“运动-脑能量代谢-Aβ-脑认知功能”的一个直接通路。
4 结论
6月龄APP/PS1小鼠海马Aβ增多的机制可能和AMPKBACE1通路异常有关,即AMP/ATP下降,AMPK磷酸化水平降低造成其活性减弱,进而下调Sirt1、PPARγ、PGC1α等蛋白表达,引起BACE1基因表达增高,上调APP的β-裂解作用,最终导致Aβ增多。
12周跑台运动减少6月龄APP/PS1小鼠海马Aβ的分子机制可能和运动改善AMPK-BACE1通路有关,即运动增加AMP/ATP比值,上调AMPK磷酸化水平,增强AMPK活性,继而上调Sirt1、PPARγ、PGC1α蛋白表达,引起BACE1基因表达下降,减弱APP的β-裂解,最终减少Aβ的生成和沉积。

