桐-药复合经营模式下泡桐丛枝菌根真菌群落结构特征
贾全全,龚 斌,李康琴,夏诗琪,邓绍勇,胡小红,朱培林
江西省林业科学院,南昌 330032
泡桐(Paulowniafortunei)是我国特有的速生阔叶树种,栽培历史悠久,是重要的用材和绿化树种。泡桐生长速度快,轮伐周期短,对土壤养分消耗过大,导致林地质量下降,严重影响了泡桐林地的生态效益[1]。研究表明,农桐间作能够有效的改善林地土壤质量,同时提高经济效益[2]。目前对泡桐林间作模式的研究多集中在产量及土壤养分方面,对间作模式下丛枝真菌方面的相关研究尚未见报道[3- 4]。早在20世纪80年代我国就开始对泡桐组培苗进行人工接种丛枝真菌,接种后可以大大缩短缓苗期,提高幼苗的抵抗力,是培育泡桐壮苗的重要措施之一[5]。但丛枝真菌在泡桐生长后期所发挥的功能及产生的作用尚未见报道。
丛枝菌根真菌(arbuscular mycorrhizae fungi,AMF)是一类在土壤中广泛存在的功能微生物,能与绝大多数陆地植物共生形成丛枝菌根[6- 7]。丛枝菌根能够提高植物对水分和营养物质的利用率,增强植物的耐旱和抗逆能力[8- 10]。此外,AMF能在植物根际形成庞大的菌丝网络系统,具有改善土壤生态环境的作用,能有效地缓解连作障碍,提高植物产量和品质[11]。虽然AMF与植物的共生无专一性,但由于植物生理代谢、根系形态结构以及分泌物等方面的差异,AMF对宿主植物的侵染也会具有选择性[12],且间作后土壤环境的改变对菌根的形成和效应也会产生影响[13- 14]。而AMF群落组成是其功能的基础,为此,本研究采用Illumina MiSeq高通量测序技术,在江西鄱阳湖周边平原岗地研究泡桐-玉竹(Polygonatumodoratum)、泡桐-麦冬(Ophiopogonjaponicus)和泡桐-射干(Belamcandachinensis)3种常见的桐-药复合经营模式对泡桐AMF群落组成的影响,以期为研究桐-药复合模式下泡桐AMF的功能及其对泡桐生长后期和土壤环境产生的作用方面提供理论支持。
1 材料方法
1.1 研究地概况
采样地点位于江西省共青城市江益镇跃进村泡桐种植基地(29°11′8.97″N,115°47′20.47″E),该地属亚热带季风气候,四季分明,雨量充沛,年平均降雨量为1350—1710 mm,日照时数为2000 h,无霜期约200 d。泡桐林于2009年用1年生根繁苗造林,株行距4 m×6 m,2014年间伐后株行距为8 m×6 m,2015年4月林下行间间作中药材麦冬和射干,2018年1月间作玉竹。
1.2 根系样品采集
2018年5月,分别在泡桐纯林、泡桐-玉竹、泡桐-麦冬和泡桐-射干复合种植地设立实验样地,每种样地间隔16 m。林分平均胸径29.3 cm,平均树高15.6 m。林地土壤信息详见表1。中药材根系采用全挖法获得,泡桐根系采用挖土块法,每个样地随机选3—5株,在距树干1—2 m处,用铁铲挖取3—5个体积30 cm×30 cm×20 cm大小的土块,从与主根相连的侧根上判断泡桐根系的特征,将采集的泡桐细根样品装入封口袋后置于冷藏箱中。带回实验室后,挑选10—20条具有1—2级根的根枝放入装有酒精浓度50%的塑料瓶中,用于菌根侵染率的测定;挑选50条左右带有1级根的根枝,洗净后放入硅胶中,用于AMF多样性检测。

表1 泡桐林地土壤养分情况
1.3 AMF侵染率测定
采用碱解离-乳酸墨水染色法对根系样品进行染色[15]。从染色完成的根段中随机挑选10个根段制片,在显微镜下观测菌根侵染情况,每个样品观测不少于300个视野。依据McGonigle等[16]方法计算菌根侵染率,并按照菌根侵染率将侵染等级分为5级:0—5%为1级;6%—25%为2级;26%—50%为3级;51%—75%为4级;76%—100%为5级。
1.4 根内AMF分子多样性测定
1.4.1DNA提取和PCR扩增
采用E.Z.N.A.® soil试剂盒并按照说明书进行总DNA提取,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用AMV4- 5NF(5′-AAGCTCGTAGTTGAATTTCG- 3′)和AMDGR(5′-CCCAACTATCCCTATTAATCAT- 3′)引物对丛枝真菌18S rDNA基因片段进行PCR扩增[17],扩增程序为:95℃预变性3 min,32个循环(95℃变性30 s,55℃退火30 s,72℃延伸45 s),最后72℃延伸10 min。扩增体系为20 μL,4 μL 5*FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL Forward Primer(5 μmol/L),0.8 μL Reverse Primer(5 μmol/L),0.4 μL FastPfu聚合酶,2 μL BSA,10ng DNA模板。
1.4.2Illumina Miseq测序数据处理
利用Illumina公司的Miseq PE300平台进行测序。使用UPARSE 7.1软件,根据97%的相似度对序列进行操作分类单元(Operational taxonomic units,OTU)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier对每条序列进行物种分类注释,参考MaarjAM丛枝真菌数据库,得到具有丰度和物种信息的OTU表用于后续分析。
1.5 统计分析
采用SPSS 20.0和Microsoft Excel 2010对数据进行统计分析。数据符合正态分布且方差齐性,采用单因素方差分析(one-way ANOVA)和Duncan法分析不同样品侵染率差异是否显著(α=0.05)。并利用I-Sanger云平台进行Alpha多样性分析。文中作图由Microsoft Excel 2010和I-Sanger云平台完成。
2 结果
2.1 菌根侵染率
在不同经营模式下泡桐菌根侵染率存在较大差异,其中泡桐-射干复合模式(PB)下泡桐菌根侵染率最低(19.33%),其次是泡桐-麦冬复合模式(PO),二者与泡桐纯林(PCK)的菌根侵染率存在显著差异(P<0.05);而PCK和泡桐-玉竹复合模式(PP)的泡桐菌根率差异不显著(P>0.05),且侵染程度较高,侵染等级均为4级,PO、PB的泡桐菌根侵染等级分别为3级和2级(图1)。林下中药材玉竹的菌根侵染率为0,中药材射干和麦冬菌根侵染率分别为2级和1级(图1)。

图1 不同样地类型物种的丛枝菌根真菌侵染率Fig.1 Arbuscular mycorrhizal infection rate of different species in different plotsPCK代表泡桐纯林,PP代表泡桐-玉竹林,PB代表泡桐-射干林,PO代表泡桐-麦冬林;不同小写字母表示不同样地泡桐菌根侵染率差异显著(P<0.05);误差线代表标准差
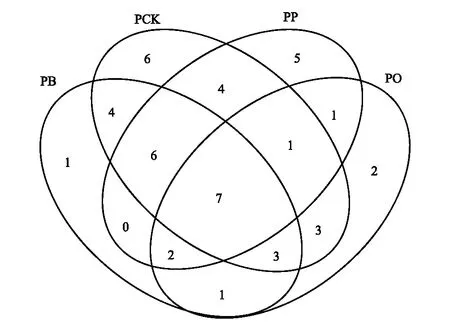
图2 不同样地类型的泡桐独有和共有OTU数 Fig.2 The unique and common OTU numbers of Paulownia fortunei from different plotsPCK代表泡桐纯林中泡桐,PP代表泡桐-玉竹林中泡桐,PB代表泡桐-射干林中泡桐,PO代表泡桐-麦冬林中泡桐
2.2 测序结果
对4类泡桐根系样品(PCK、PP、PB和PO模式下的泡桐菌根)进行高通量测序,共获得159183条有效的高质量序列,采用97%的相似性聚类分析,共获得46条AMF的OTU。在PCK、PP、PB和PO等4种样地类型中,泡桐分别有34、26、24和20条OTUs。此外,每种样地类型中泡桐都有其独有的OTUs,且泡桐纯林中,独有的OTUs(6条)和OTUs总数最多(图2)。
2.3 Alpha多样性分析
所有样地的泡桐菌根真菌群落覆盖率均为100%;除PO的泡桐Ace指数(物种丰富度)最高以外,与PCK相比,3种桐-药复合样地的泡桐菌根真菌的Ace指数和Shannon指数(物种多样性)均有所降低,其中PP和PO的泡桐Ace指数和Shannon指数略高于PB;而PCK的Shannoneven指数(物种均匀度)最低(表2)。
2.4 AMF群落结构分析
在不同经营模式的样地中,泡桐AMF群落主要由球囊霉科(Glomeracea)、巨孢囊霉科(Gigasporaceae)、无梗囊霉科(Acaulosporaceae)和多孢囊霉科(Diversisporaceae)组成(图3)。其中球囊霉科的丰度最大,除PO外(相对丰度为73.97%),其他类型样地泡桐的球囊霉科相对丰度均在90%以上(图3)。除PP的泡桐外,其他物种的AMF群落都存在巨孢囊霉科真菌,但丰度差异较大,其中PO中泡桐的巨孢囊霉科AMF丰度最大(18.13%),其次为中药材射干和麦冬,另外两种样地泡桐的巨孢囊霉科AMF丰度均小于1%。除麦冬外,其他五个物种均含有无梗囊霉科AMF。只有PB的泡桐含有多孢囊霉科AMF,且相对丰度为2.73%(图3)。
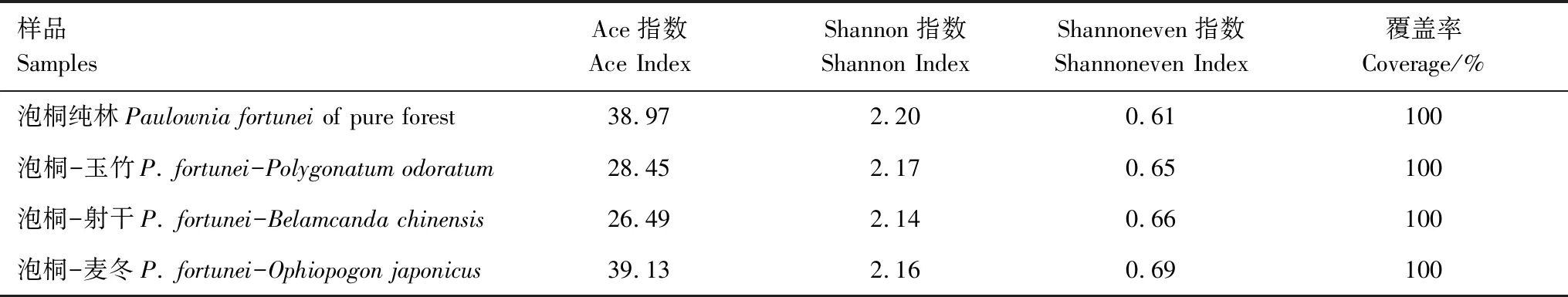
表2 不同样地类型的泡桐丛枝菌根真菌群落Alpha多样性指数
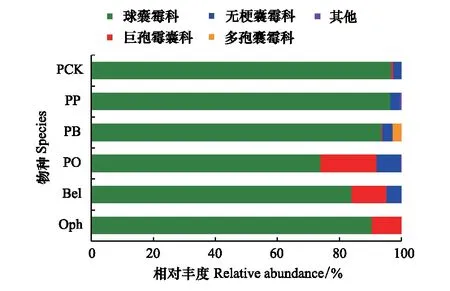
图3 不同样地类型物种的AMF科的相对丰度 Fig.3 Relative abundance of abuscular mycorrhizal fungal families of different species in different plotsPCK代表泡桐纯林中泡桐,PP代表泡桐-玉竹林中泡桐,PB代表泡桐-射干林中泡桐,PO代表泡桐-麦冬林中泡桐,Bel代表射干,Oph代表麦冬
3 讨论
泡桐是AMF共生树种,其组培苗接种球囊霉科真菌可以显著提高其对养分的吸收效率[7]。本研究采用Illumina MiSeq高通量测序技术,测定了泡桐纯林、泡桐-玉竹林、泡桐-麦冬林和泡桐-射干林不同经营模式下泡桐AMF的群落组成,从中获得了46个可操作分类单元,分属于4个科(图3)。吴铁航等[18]调查发现,球囊霉科是江西红壤地区林地和耕地土壤中最常见的丛枝真菌类型,这与我们调查的泡桐样地的优势科结果一致。同时,也说明这些球囊霉科AMF与泡桐具有极强的亲和性,这为筛选泡桐高效共生AMF菌种提供了依据。
AMF作为联系宿主植物根系与土壤环境之间的桥梁,其分布必然受到宿主植物和根际土壤环境的直接影响[19]。研究结果显示,泡桐-麦冬和泡桐-射干林的泡桐菌根侵染率显著低于泡桐纯林(图1),这可能与间作中药材后土壤的理化性质的改变有关[20],也可能是中药材根系及其AMF产生的分泌物影响了泡桐根系AMF的侵染能力[12]。然而,泡桐-玉竹复合模式的泡桐菌根侵染率与纯林差异并不显著,这可能与玉竹间作的时间较短有关。多年生玉竹菌根侵染率可达60%以上[21],但由于本研究样地中玉竹的间作时间较短,还没有AMF侵染,因此对泡桐根系的AMF也没有产生显著影响。所以,推测泡桐林内长期间作中药材会影响AMF对泡桐根系的侵染水平。
在本研究中,泡桐-玉竹和泡桐-射干林中泡桐AMF的物种丰富度、多样性和均匀度均低于纯林(图1,表2),且泡桐纯林中,独有的OTUs和OTUs总数最多(图2),但在泡桐-麦冬样地中,泡桐AMF的物种多样性和均匀度略高于纯林,这可能是由于泡桐-麦冬样地中泡桐的AMF中巨孢囊霉科和无梗囊霉科的相对丰度较高,而优势科球囊霉科的相对丰度明显低于其他模式,造成了群落结构格局的变化。泡桐-麦冬林中泡桐AMF中巨孢霉囊科的相对丰度高达18.13%,这可能与中药材麦冬根系中巨孢霉囊科相对丰度较高有关。所以泡桐林下间作中药材,会因间作的物种不同而影响AMF对泡桐的侵染能力,也就是说,植物群落的物种多样性改变及群落内种间的相互作用,会对不同物种的AMF群落结构产生不同程度地影响[22]。
另外,在所有调查的泡桐样地中,只有泡桐-射干林中的泡桐AMF中含有多孢囊霉科真菌(图3),在射干根系中也没有发现多孢囊霉科真菌,而且多孢囊霉科并不是红壤地区常见的真菌类型,因此,多孢囊霉科真菌出现的原因及其对泡桐生长的影响还有待进一步研究。
4 结论
AMF是陆地生态系统中重要的微生物资源之一,本研究通过对泡桐纯林、泡桐-玉竹林、泡桐-麦冬林和泡桐-射干林中泡桐AMF群落特征的研究发现,桐-药间作模式会降低泡桐根系AMF的侵染率,改变其群落结构组成,但这些群落结构的差异是否影响了其生态功能目前尚不明确,另外,不同复合经营模式下AMF群落结构的差异,对泡桐的生长以及保持土壤健康与可持续经营方面的影响还有待进一步研究。

