术前PLR、LMR与胃癌患者预后的相关性研究
王邦杰, 王葆春
目前胃癌是我国最常见的消化道恶性肿瘤,近年来胃癌的3年生存率和5年生存率没有显著改善[1]。目前尚缺乏有效监测胃癌预后和复发的指标。血小板与淋巴细胞比值(PLR)、淋巴细胞与单核细胞比值(LMR)是检测炎性反应的重要指标,其在结直肠癌和乳腺癌等恶性肿瘤检测中也发挥着重要作用[2-3],但在胃癌检测方面鲜有涉及。本研究通过分析112例胃癌患者的临床和随访资料,探讨术前外周血PLR和LMR在胃癌患者预后评估中的意义。
1 资料与方法
1.1 一般资料 收集2011年1月至2017年12月海南省人民医院胃肠外科收治的胃癌患者的病例资料。入选标准:术后病理确诊为原发性胃癌;术前无感冒、发热、凝血功能障碍或其他可影响血常规结果的因素;患者术前1周的血常规检查资料完整;未行术前化疗、放疗、免疫治疗等。排除标准:有多种基础疾病,随访期间死亡;非原发性胃癌;早期失访(随访时间<12个月)。共有112例随访数据完整的胃癌患者被纳入研究,其中男73例,女39例,年龄22~79(56.7±3.4)岁。全部行手术治疗,术后病理均证实为胃癌。
1.2 信息采集与随访 使用院内病案管理系统收集112例胃癌患者的性别、年龄、肿瘤直径、淋巴结转移、肿瘤分化程度、TNM分期(根据UICC/AJCC第八版胃癌分期标准评定)等资料,并根据术前1周内采集的外周血数据计算PLR、LMR指标。查询病案首页信息,通过电话联系、门诊复查等方式随访。复发由病理证实,并且参考影像学检查如消化道钡餐和CT等。随访开始时间为患者术后出院日期,截至2019年1月31日,所有患者随访13~96个月,中位随访时间为65.45个月。
1.3 统计学方法 数据经SPSS 25.0统计软件分析。采用受试者工作特征曲线(ROC曲线)界定PLR与LMR的截点,使用χ2检验分析比较不同PLR分组、LMR分组患者的临床资料,运用Kaplan-Meier法、Log-rank检验分析不同临床资料间生存率的差异,用Cox回归分析影响胃癌术后预后的因素,P<0.05为差异有统计学意义。
2 结果
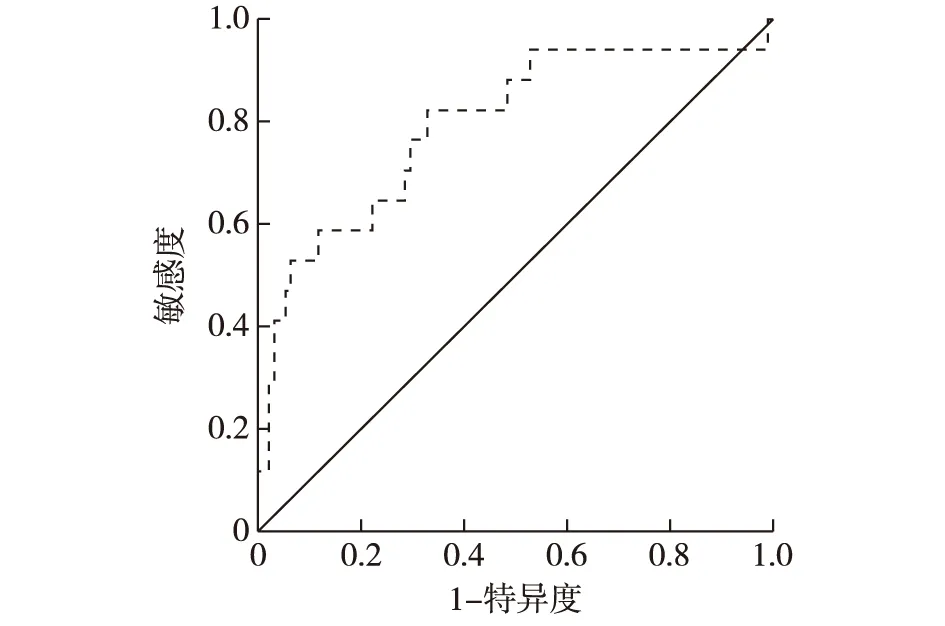
图1 PLR的ROC曲线图2 LMR的ROC曲线
2.1 PLR、LMR界值的确定与分组 分别绘制PLR、LMR的ROC曲线,PLR的ROC曲线下面积为0.795,PLR取152.73时约登指数最大,此时敏感度为0.824,特异度为0.674,见图1;LMR的ROC曲线下面积为0.704,LMR取2.99时约登指数最大,此时敏感度为0.588,特异度为0.874,见图2。因此本研究取PLR=152.73,LMR=2.99作为评价的分界点,分为低PLR组(PLR<152.73)67例、高PLR组(PLR≥152.73)45例,低LMR组(LMR<2.99)22例、高LMR组(LMR≥2.99)90例。
2.2 不同PLR、LMR分组的临床资料比较 低PLR组和高PLR组在肿瘤直径、分化程度及TNM分期方面差异有统计学意义,在年龄、性别、淋巴结转移方面差异无统计学意义。低LMR组和高LMR组在性别、淋巴结转移方面差异有统计学意义,在年龄、肿瘤直径、分化程度、TNM分期方面差异无统计学意义,见表1。
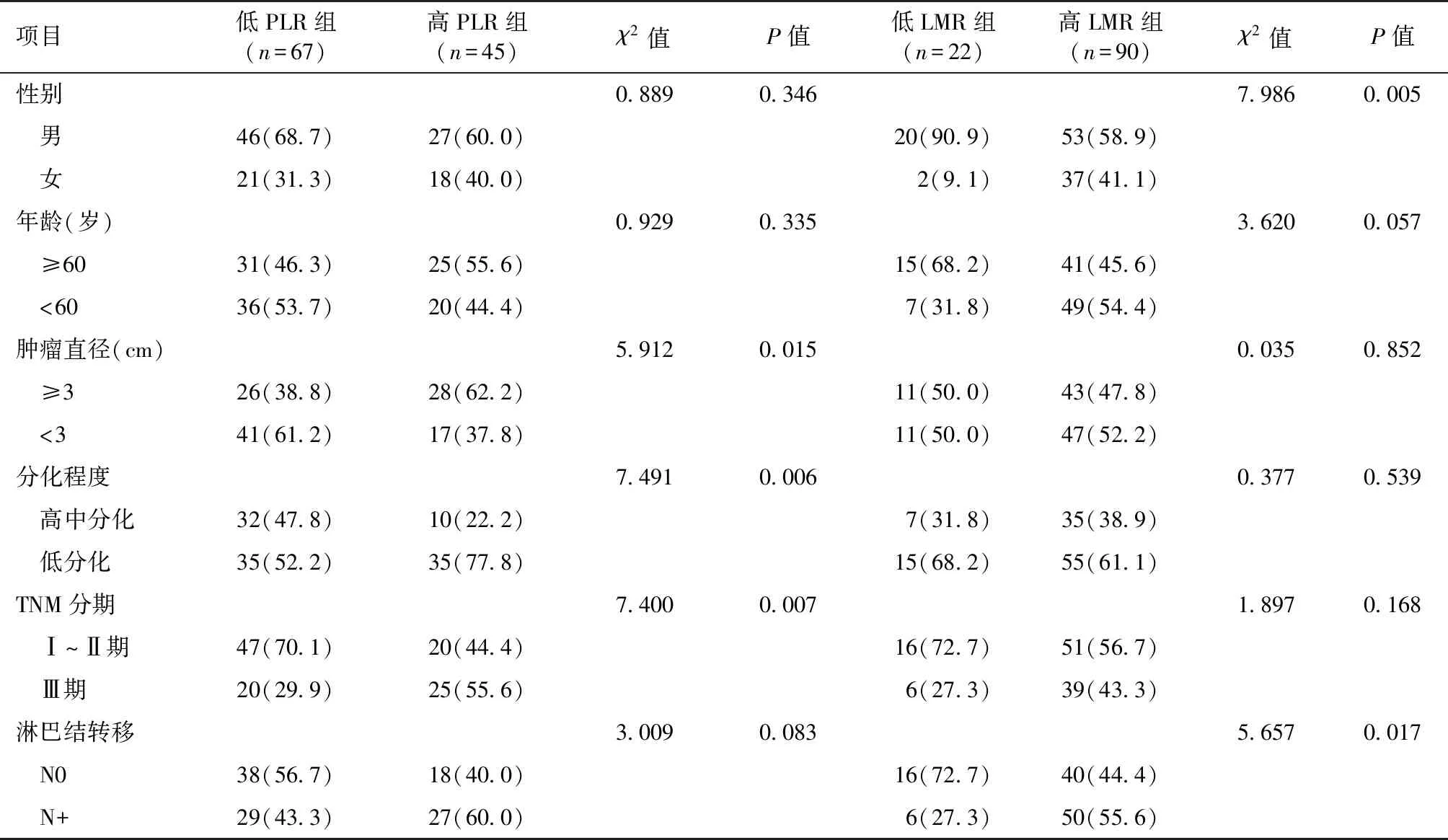
表1 不同PLR、LMR分组的临床资料比较 例(%)
2.3 影响胃癌预后的单因素分析结果 术前PLR、术前LMR与肿瘤TNM分期均是影响胃癌术后无病生存率的因素,肿瘤TNM分期为Ⅲ期、术前PLR高组与术前LMR低组的患者预后较差,见表2。
表2 影响胃癌患者术后无病生存的单因素分析结果
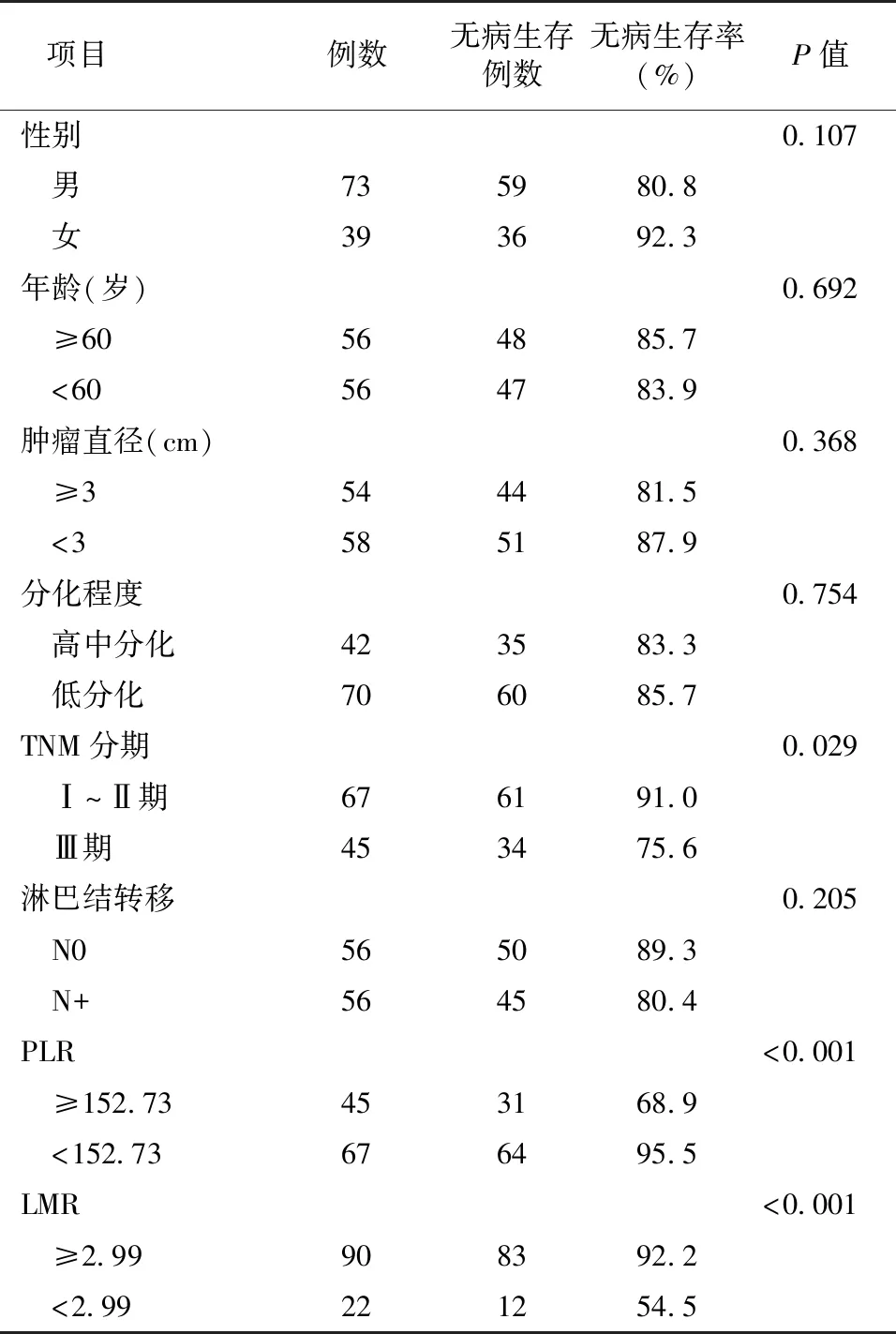
项目例数无病生存例数无病生存率(%)P值 性别0.107 男735980.8 女393692.3 年龄(岁)0.692 ≥60564885.7 <60564783.9 肿瘤直径(cm)0.368 ≥3544481.5 <3585187.9 分化程度0.754 高中分化423583.3 低分化706085.7 TNM分期0.029 Ⅰ~Ⅱ期676191.0 Ⅲ期453475.6 淋巴结转移0.205 N0565089.3 N+564580.4 PLR<0.001 ≥152.73453168.9 <152.73676495.5 LMR<0.001 ≥2.99908392.2 <2.99221254.5
2.4 影响胃癌预后的多因素分析结果 以胃癌患者的预后(无病生存=0,复发或死亡=1)为因变量,以表2中的因素为自变量,进行Cox模型多因素分析,结果示高PLR值、低LMR值和肿瘤TNM分期较高是影响胃癌术后无病生存的独立危险因素,见表3。
3 讨论
胃癌具有复发率高、生存率低的特点,是最常见的消化道恶性肿瘤。胃癌的进展与预后不仅与其临床分期有关,而且与其所导致的全身系统炎性反应有关。胃癌的恶性程度越高,其周边组织的坏死和崩解越严重,引起的非特异性炎性反应越明显,产生的炎性介质可破坏正常细胞内环境的稳定性,从而导致异常细胞增殖和进一步向恶性趋化。这种恶性循环将产生更多的炎性细胞和炎性介质,并建立恶性肿瘤进展的微环境。炎症促进肿瘤的发生、发展,肿瘤为炎症的持续提供了条件,两者相互补充[4-5]。因此,本研究选用PLR、LMR这两种细胞数目绝对值的比值来代表全身系统炎性反应指标,研究其对胃癌预后的预测作用,使研究更具有相对的稳定性。
表3 影响胃癌患者术后无病生存的多因素Cox回归分析结果
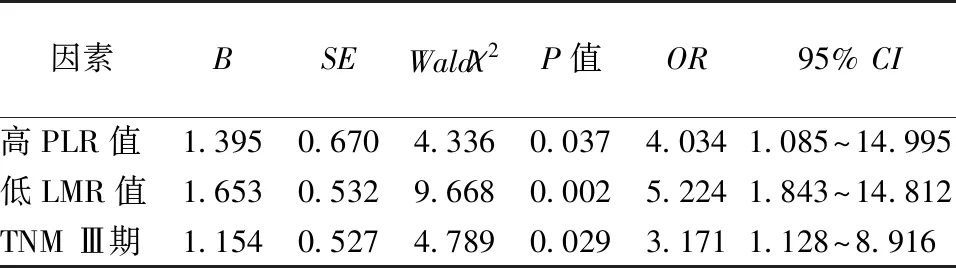
因素BSEWaldχ2P值OR95% CI 高PLR值1.3950.6704.3360.0374.0341.085~14.995 低LMR值1.6530.5329.6680.0025.2241.843~14.812 TNM Ⅲ期1.1540.5274.7890.0293.1711.128~8.916
PLR被证明与肿瘤患者的生存结果密切相关,在肿瘤活动中具有重要作用[6-7]。较高的PLR与子宫内膜样腺癌、鼻窦癌、乳腺癌和结直肠癌患者的预后不良有关[8-10]。肝细胞癌中PLR值的升高可预测癌症复发[11]。肿瘤细胞可以促进血小板增殖,而血小板又可以为促血管生成因子生成提供原料,有利于血管内肿瘤细胞的迁移[12]。血小板还可以和纤维蛋白原一起促进肿瘤新生血管形成并支持肿瘤细胞的持续黏附,在肿瘤的生长、侵袭中起重要作用。在肿瘤微环境中,非特异性炎性反应进一步使得CD4+、CD8+T淋巴细胞的活性和数量受到抑制,从而显著削弱了先天性的细胞免疫能力[13]。因此,胃恶性肿瘤引起的非特异性炎性反应能导致患者体内血小板升高和淋巴细胞降低,使PLR的比值升高,促进癌症的发展,最终导致胃癌患者预后不良。本研究示高PLR组患者的术后无病生存率为68.9%,明显低于低PLR组(95.5%),差异有统计学意义。单因素和多因素Cox回归分析结果均提示PLR高值是影响胃癌术后无病生存的独立危险因素。
LMR偏低也常常作为多种肿瘤预后不良的指标[14-16]。Ni等[17]研究表明,晚期乳腺癌患者LMR升高(≥4.25)与无病生存率相关(P=0.011)。Hirahara等[18]研究发现,LMR可用于食管癌患者术后无病生存期和总生存的预测因子,即使在根治性食管切除术后也可用其鉴别预后不良。淋巴细胞是宿主抗击各种恶性肿瘤的基本免疫因素,他们对于手术后残留的微量癌细胞和微转移病灶具有清除作用。淋巴细胞可以渗透到肿瘤微环境中并表达为肿瘤浸润淋巴细胞(TILs)等各种因子,从而影响和破坏肿瘤细胞的增殖与转移,起到免疫保护作用[19]。另外,单核细胞可以分化为肿瘤相关巨噬细胞(TAMs),并成为肿瘤细胞的基质及肿瘤微环境的主要组成部分[20]。TAMs具有免疫抑制作用,其能够促进肿瘤周围微血管生成,从而导致肿瘤的扩散与转移[21]。因此,当外周血淋巴细胞降低或单核细胞升高时,肿瘤负荷也随之增高,二者的联合指标LMR有作为判断胃癌患者预后的价值。本研究结果示高LMR组患者的术后无病生存率为92.2%,高于低LMR组的54.5%,差异有统计学意义。单因素和多因素Cox回归分析结果均提示LMR低值为影响胃癌术后无病生存的危险因素。
综上,术前PLR、LMR与胃癌的预后具有相关性,即PLR值越高、LMR值越低,可能预示着胃癌的分期越晚、预后越差,术后应经常监测胃癌相关指标并积极实施化疗。PLR、LMR均来源于外周血检查,是手术前常规检测项目,有采集方便、价格低廉、统计简单、结果可靠等优点,为胃癌患者的预后分析提供了新的有效方法。但本研究是回顾性研究,选取的样本数较少、选择偏倚或不明因素可能会影响结果,尚需大样本、多中心的队列研究以取得更可靠的结果。

