外源乙烯对镉处理下玉米幼苗生理代谢的影响*
刘 娟, 赵欢蕊, 刘永华, 王镜惠
外源乙烯对镉处理下玉米幼苗生理代谢的影响*
刘 娟1, 赵欢蕊1, 刘永华1, 王镜惠2
(1. 榆林学院生命科学学院 榆林 719000; 2. 榆林学院化学与化工学院 榆林 719000)
为探讨外源乙烯缓解玉米()幼苗镉(Cd)毒害的生理机制, 通过水培试验研究了Cd处理下, 外源乙烯对玉米幼苗相关生理指标与Cd的亚细胞分布的影响, 以不做任何处理为空白对照, 以Cd处理和(NH4)2SO4处理为试验对照。结果显示, 相对Cd处理, 乙烯和(NH4)2SO4处理可显著降低Cd胁迫下玉米幼苗H2O2和丙二醛(MDA)含量, 使净光合速率分别提升1.23倍和1.22倍; 显著降低抗氧化物酶[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)]活性, 抗氧化物质[抗坏血酸(AsA)、谷胱甘肽(GSH)]含量则显著上升。另外, 相对于Cd处理, 乙烯+Cd处理可使玉米幼苗ATP硫酸化酶活性、谷胱甘肽还原酶(GR)活性、半胱氨酸和还原型谷胱甘肽(GSH)含量分别上升54.43%、27.93%、50.77%和49.85%, 而对非蛋白硫醇(NPT)和植物螯合素(PCs)含量无显著性影响。在乙烯+Cd处理的基础上添加GSH合成抑制剂BSO(buthionine sulfoximine)可导致玉米叶片GSH含量显著降低, H2O2含量上升, 光合速率下降。外源乙烯可显著降低Cd胁迫下玉米叶片Cd含量, 而显著提升根部细胞壁和液泡中Cd含量。因此, 外源乙烯一方面通过提升玉米叶片GSH和AsA含量, 增强叶片非酶促抗氧化能力, 而非通过抗氧化酶促反应和NPT、PCs的螯合作用; 另一方面则通过根细胞壁的固定作用和液泡区室化作用, 减少Cd向玉米叶片中的转移, 从而缓解Cd毒害。研究结果可为乙烯作为潜在的作物重金属拮抗剂提供理论依据。
镉; 乙烯; 玉米; 生理机制; 硫; 幼苗
镉(cadmium, Cd)的生物半衰期长, 即使是低浓度Cd对人体也会造成潜在的威胁。我国农业土壤遭受Cd污染点位超标率达7%, Cd已成为我国土壤重金属污染中的首要污染物[1]。Cd胁迫导致植物体内活性氧(ROS)含量上升, 破坏叶绿体结构、抑制碳固定酶活性, 并通过影响蛋白酶活性而导致细胞代谢紊乱等[2-3]。另外, Cd胁迫抑制营养元素吸收而导致植株生长受限[4], 还能通过食物链危害人体健康[5]。因此, 研究缓解或解除植物中Cd毒害的措施及其机理, 是当前国内外研究的热点问题。
为应对Cd胁迫环境, 植物会采取多种途径增强自身对Cd的耐受性。细胞壁是植物抵御Cd胁迫的第一道屏障, 可以在Cd进入细胞之前, 通过配合作用固定住部分Cd[6]。另外, 液泡的区室化作用也是重金属解毒的重要措施[7]。Cd胁迫诱导产生的过量ROS可以在抗氧化酶[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)等]和抗氧化物质(抗坏血酸、谷胱甘肽等)的作用下加以清除。另一方面, 通过非蛋白硫醇(non-protein thiol)和植物螯合素的螯合作用, 可降低Cd的毒害效应[8-9]。
乙烯是一种调控植物生长的重要气态植物激素, 参与种子萌发、生长、下胚轴顶钩形成、器官衰老、果实成熟等过程, 同时也涉及多种逆境胁迫过程[10], 如干旱、高温、低温、高盐、病害等胁迫下, 通过影响植物的碳代谢、糖代谢、激素代谢和蛋白质代谢等多方面, 调节植物的光合作用与生长, 以应对逆境胁迫[11-13]。添加外源乙烯可以增强Cd胁迫下芥菜()叶片的光合作用, 从而提升其Cd耐受能力[14]。对其中的机理也有较多报导, 如研究发现, 乙烯可以通过抑制拟南芥()叶片中Cd胁迫诱导ROS的产生[15], 增加主根长度和分生根数量[16], 以增强拟南芥对Cd胁迫的耐受性。同时, 外源乙烯可以通过增强植物体内硫代谢物的合成, 以提升植物对Cd胁迫的耐受性[14]。虽然这些研究对明确乙烯调节植物响应Cd胁迫的内在机理具有一定作用, 但是不同作物的遗传背景差异, 导致不同植物在响应逆境胁迫中所采用的机制不同。因此, 本研究分析了外源乙烯对Cd胁迫下玉米()幼苗生理代谢的影响, 并揭示其内在机制。
玉米是榆林地区的第二大粮食作物, 但由于该区多年煤矿资源的过度开采, 导致重金属污染, 尤其是表层土壤受到Cd污染较严重[17]。当前, 已有研究发现, 添加外源物质可促进玉米在Cd污染环境中的生长, 如薛洪宝等[8]揭示了硫醇化合物在玉米发芽过程中与Cd的相互作用, 可缓解Cd对玉米的毒害; 王玉萍等[18]研究发现Ca2+可以通过增强玉米光合速率和PSⅡ功能而促进玉米在Cd胁迫环境中的生长。
然而, 当前对外源乙烯缓解Cd毒害的研究在玉米中尚少涉及。因此, 本研究以玉米为试材, 探讨Cd胁迫下外源乙烯对玉米光合作用、氧化还原水平、内源硫代谢物含量等生理代谢的影响, 以揭示外源乙烯缓解玉米Cd毒害的作用机理, 为提高重金属污染环境中的作物产量和安全、改良土壤重金属污染等提供理论依据。
1 材料与方法
1.1 供试材料与试验设计
试验玉米品种为春播玉米‘中榆968’。选取籽粒饱满、大小均匀无虫害的种子, 用0.1% HgCl2溶液消毒8 min后, 用蒸馏水漂洗干净, 置于有湿润滤纸的培养皿中催芽72 h, 发芽条件为温度(25±1) ℃、相对湿度75%的生化培养箱。玉米出苗后, 选取长势一致健康植株移栽到装有1/2 Hoagland(pH 6.0)营养液的白色方盆(38 cm×31 cm×13cm)中, 于人工气候室内常规培养, 培养条件为: 光照/黑暗时间为16 h/8 h, 昼夜温度为25 ℃/20 ℃, 光照强度为110 μmol∙m-2∙s-1, 相对湿度为70%。培养期间, 持续用真空抽气泵向营养液中泵气, 每2 d更换营养液, 并交换塑料盆的位置, 以保证光照均匀, 在4叶一心期, 选择长势良好和长势一致的植株进行试验处理, 所有处理均同时进行。
Cd2+供体为氯化镉(CdCl2∙2.5H2O, 国产分析纯, 上海迈瑞尔化学技术有限公司), 在上述培养条件下, 我们前期研究了不同浓度Cd和乙烯利(乙烯供体)处理对玉米幼苗生长的影响, 发现Cd胁迫可抑制玉米幼苗叶片和根的延伸, 并降低其生物量, 而添加外源乙烯可缓解Cd对玉米幼苗的抑制作用。为验证玉米Cd耐受能力的提升确实是通过外源乙烯的作用而获得, 以乙烯活性抑制剂二环庚二烯(norbornadiene, NBD)处理玉米幼苗, 研究其对玉米幼苗生长的影响。为验证外源乙烯是通过增强玉米硫(sulphur, S)代谢以提升玉米的耐Cd能力, 以(NH4)2SO4处理作为样品对照之一。通过前期试验筛选得到玉米Cd胁迫临界浓度为100 mg∙L-1, 外源乙烯、SO42-和NBD最佳浓度分别为200 µL∙L-1、400 mg∙L-1和100 µmol∙L-1。因而, 本研究共设5个处理, 详情见表1。因为SO42-是以(NH4)2SO4的形式提供, 为排除NH4+的影响, 所有处理(包括对照)中除已经添加(NH4)2SO4的处理组, 均添加800 mg∙L-1的NH4Cl, 以维持NH4+浓度的一致。
另外, 为验证外源乙烯是通过增强玉米幼苗谷胱甘肽(GSH)的生物合成而起到缓解Cd毒害的作用, 在T1、T2和T4处理中添加0.5 mmol∙L-1的GSH合成抑制剂丁硫氨酸-亚砜亚胺(buthionine sulphoximine, BSO)。培养条件与上述一致。
每个处理8盆, 每盆种植玉米幼苗15株。胁迫处理10 d后取样。

表1 试验设计
1.2 测定项目与方法
1.2.1 H2O2与丙二醛(MDA)
H2O2含量的测定参考Okuda等[19]的方法进行。MDA含量测定参考张志良等[20]的方法, 略微改动: 取玉米根或叶片组织0.5 g, 加入10 mL 0.5%(/)三氯乙酸进行充分研磨, 将研磨液倒入10 mL离心管于3 000×g离心10 min。取上清液2 mL与2 mL 0.67%(/)的硫代巴比妥酸(TBA)充分混匀。混合液于100 ℃水浴锅中反应, 30 min后, 放于冰上迅速冷却, 然后3 000×g离心10 min。上清液在450 nm、532 nm和600 nm波长处用紫外可见分光光度计测吸光值。根据张志良等[20]的计算公式, 计算样品中MDA含量。
1.2.2 光合作用参数
选取充分伸展的玉米最上端叶片, 利用LI-6400XT便携式光合测定仪测定光合速率、蒸腾速率、气孔导度、胞间二氧化碳浓度, 选用红蓝光源, 光强为1 000 μmol∙m-2∙s-1。叶室温度25 ℃左右, 每次测定于10:00—14:00进行。
1.2.3 相关酶活性
Rubisco酶活性测定参考Per等[21]的方法进行。超氧化物歧化酶(superoxide dismutase, SOD)活性参照Zhou等[22]的方法测定, 过氧化氢酶(catalase, CAT)活性参照Aebi[23]的方法测定, 谷胱甘肽还原酶(glutathione reductase, GR)活性参照Foyer等[24]的方法测定。ATP硫酸化酶(ATP-S)活性参照Khan等[14]的方法测定。
1.2.4 抗氧化物质和硫代谢物含量
抗坏血酸(ascorbic acid, AsA)含量参考张志良等[20]的方法测定, 还原型谷胱甘肽(glutathione, GSH)含量参考Anderson[25]的方法测定, 半胱氨酸(cysteine, Cys)含量参考Gaitonde[26]的方法测定, 非蛋白硫醇(non-protein thiol, NPT)与植物螯合素(phytochelatins, PCs)含量参照Devi等[27]的方法测定。
1.2.5 Cd在植物组织的含量和亚细胞分布
在处理后10 d, 随机选取对照(CK)、Cd处理(T1)与Cd+乙烯处理(T2)的玉米幼苗3株, 先用自来水快速冲洗掉叶片和根部附着物, 再用去离子水冲洗3次, 用吸水纸吸干表面水珠, 剪开苗的根系和地上部分, 分别于天平上称鲜重, 然后于110 ℃干燥箱中进行杀青1 h, 60 ℃恒温干燥至恒重, 称干重。干样用HNO3-HClO4(4∶1/)消煮(160 ℃)至澄清, 定容以后, 利用原子吸收分光光度计(Thermo Scientific™, iCE 3300 AAS)测定各组织中的Cd含量。
利用差速离心法分离不同的亚细胞组分: 称取0.2 g玉米叶片和根于预冷的研钵中, 加入10 mL预冷的提取缓冲液[250 mmol∙L-1蔗糖, 50 mmol∙L-1Tris-HCl (pH 7.5)和10 mmol∙L-1的二硫苏糖醇], 研磨至匀浆。将匀浆液在300×g下离心10 min, 沉淀即为细胞壁组分(F1组分); 将上清液在2 000×g下离心15 min, 沉淀为细胞核与叶绿体部分(F2组分); 上清液在10 000×g下离心20 min, 沉淀为线粒体部分(F3组分); 上清液则为含有液泡的可溶性组分(F4组分)。F2与F3组分合为细胞器组分。提取出的各组分进行微波消解, 利用原子吸收法测定Cd的含量, 消解液组成为5 mL HNO3、1 mL H2O2, 消解后用原子吸收分光光度计测定Cd的含量, 其中F4组分直接上机测定[28-29]。
1.3 数据统计
所得数据以3次重复的平均值±标准差(=3)表示。采用SPSS 18.0对试验数据进行统计分析, 各处理间数据采用方差分析(ANOVA), 显著性差异水平为<0.05, 采用Microsoft excel 2007作图。
2 结果与分析
2.1 外源乙烯和(NH4)2SO4对Cd胁迫下玉米幼苗氧化胁迫和光合作用的影响
与对照(CK)相比, 100 mg∙L-1Cd处理(T1)10 d后的玉米叶片H2O2和MDA含量显著上升, 分别提升了2.24倍与2.37倍。Cd胁迫下添加外源乙烯(T2)和(NH4)2SO4(T3)以后, 均可使H2O2和MDA含量与仅Cd处理(T1)相比显著降低。同时添加外源乙烯和(NH4)2SO4(T4), 可使H2O2和MDA含量进一步降低, 而在NBD(T5)的作用下, H2O2和MDA含量相对T4显著上升(表2)。结果表明, 外源乙烯和(NH4)2SO4可通过降低膜脂质过氧化程度, 缓解Cd处理对玉米幼苗叶片的毒害, 且两种外源物质对缓解玉米Cd毒害具有协同效应。
与T1相比, Cd胁迫下添加外源乙烯或(NH4)2SO4均可显著提升玉米叶片气孔导度和净光合速率, 同时添加外源乙烯和(NH4)2SO4(T4), 气孔导度和净光合速率得到进一步提升, 分别为T1处理的1.81倍和3.50倍, 而胞间二氧化碳浓度的变化趋势与气孔导度和净光合速率的变化趋势相反(表2)。而添加NBD处理(T5), 与T4相比, 则可显著降低玉米幼苗叶片气孔导度和净光合速率, 胞间二氧化碳浓度则呈相反的变化趋势(表2)。
玉米幼苗叶片中Rubisco酶活性在Cd处理(T1)后, 与对照(CK)相比下降57.26%。而再添加外源乙烯(T2)或(NH4)2SO4(T3)后, Rubisco酶活性相对T1, 分别提升了34.76%、38.98%, 同时添加乙烯和(NH4)2SO4(T4)则可使Rubisco酶活性与T1相比提升107.84%(表2)。另外, 添加NBD后(T5), Rubisco酶活性与T4相比下降10.82%(表2)。结果表明, Cd处理下玉米幼苗Rubisco酶活性降低, 影响光合作用的正常进行, 外源乙烯和(NH4)2SO4处理能不同程度地提升Rubisco酶活性, 并一定程度上恢复玉米幼苗的光合作用(表2)。
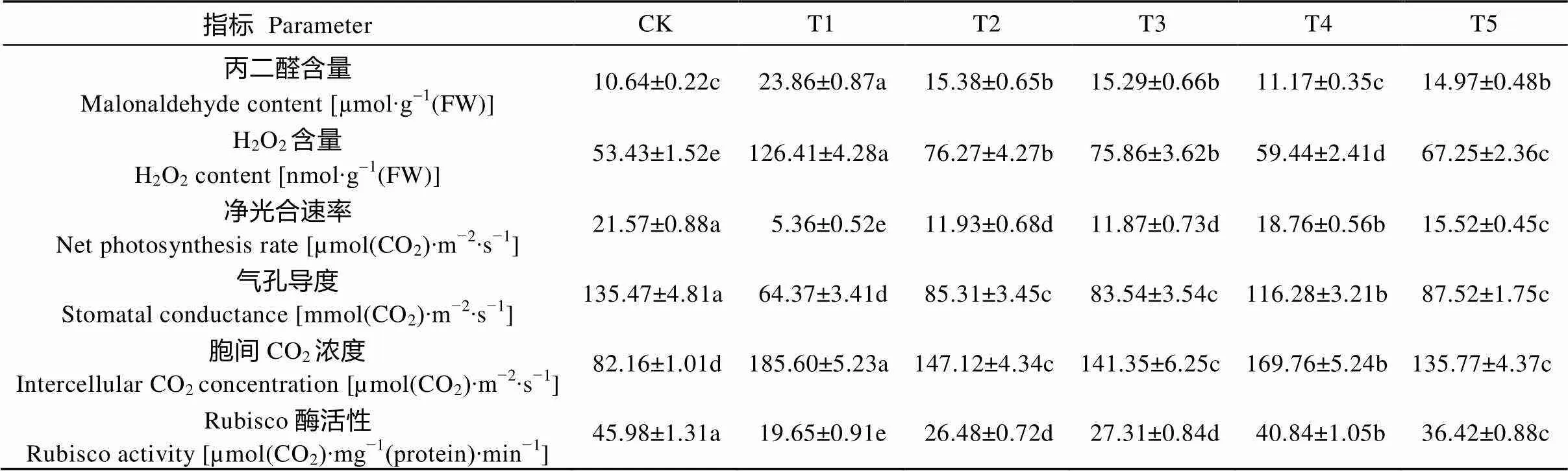
表2 外源乙烯和(NH4)2SO4对Cd胁迫下玉米幼苗氧化胁迫和光合作用的影响
同行不同小写字母表示各处理间差异显著(<0.05)。Different lowercase letters in the same row indicate significant differences among treatments at 0.05 level.
2.2 外源乙烯和(NH4)2SO4对Cd胁迫下玉米幼苗抗氧化酶活性和抗氧化物质含量的影响
与对照相比, Cd处理(T1)可显著提升玉米幼苗叶片中的抗氧化酶(SOD、CAT)活性。而外源乙烯或(NH4)2SO4处理以后, 相对Cd处理, SOD活性下降至近乎对照水平, 而CAT活性虽然也呈降低趋势, 但仍显著高于对照。同时添加外源乙烯和(NH4)2SO4(T4), SOD和CAT活性与对照相比已无显著差异(表3)。
Cd处理(T1)下玉米幼苗中AsA含量与对照相比上升但无显著差异, GSH含量则显著上升; 在外源乙烯(T2)或(NH4)2SO4处理(T3)以后, 与单独Cd处理(T1)相比AsA与GSH含量均显著上升; 同时添加外源乙烯和(NH4)2SO4(T4), AsA和GSH含量达到最大值(表3)。GSH合成关键酶GR的活性与GSH含量的变化趋势一致(表3)。而在添加NBD以后, 乙烯活性受到抑制, GR活性、GSH和AsA含量与T4比较显著下降, CAT活性则显著上升(表3)。结果表明, 抗氧化酶(SOD、CAT)在仅仅Cd处理(T1)下的玉米幼苗中发挥主要的抗氧化作用, 而AsA和GSH则在外源乙烯或(NH4)2SO4介导的Cd耐受过程中发挥重要作用。
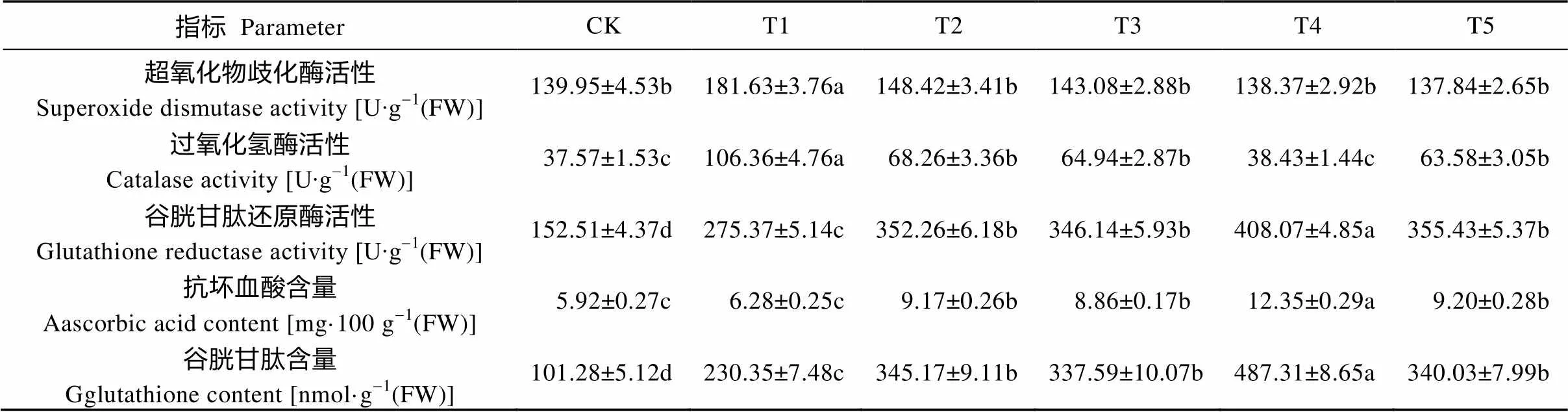
表3 外源乙烯和(NH4)2SO4对Cd处理下玉米幼苗抗氧化酶活性和抗氧化物质含量的影响
同行不同小写字母表示各处理间差异显著(<0.05)。Different lowercase letters in the same row indicate significant differences among treatments at 0.05 level.
2.3 外源乙烯和(NH4)2SO4对Cd胁迫下玉米幼苗硫代谢的影响
玉米幼苗叶片中ATP-S活性、Cys含量在Cd处理(T1)后较对照分别上升38.93%、102.97%, 而在添加外源乙烯(T2)或(NH4)2SO4(T3)以后, 两者的含量进一步上升, 相对Cd胁迫(T1)T2处理分别增加54.43%和50.77%, T3处理分别增加54.15%和46.11%, 同时添加外源乙烯和(NH4)2SO4, ATP-S活性与Cys含量相对Cd处理(T1)分别提升71.06%和114.34%; NBD处理(T5)可显著降低ATP-S活性、Cys含量, 并使之降至T2水平(表4)。然而, NPT与PCs含量在各处理的叶片中均无显著差异(表4)。推测外源乙烯和(NH4)2SO4调节玉米Cd耐受能力, 与叶片ATP-S活性和Cys含量的上升导致GSH的合成增强相关, 而不是通过增强NPT和PCs等重金属螯合剂的合成。
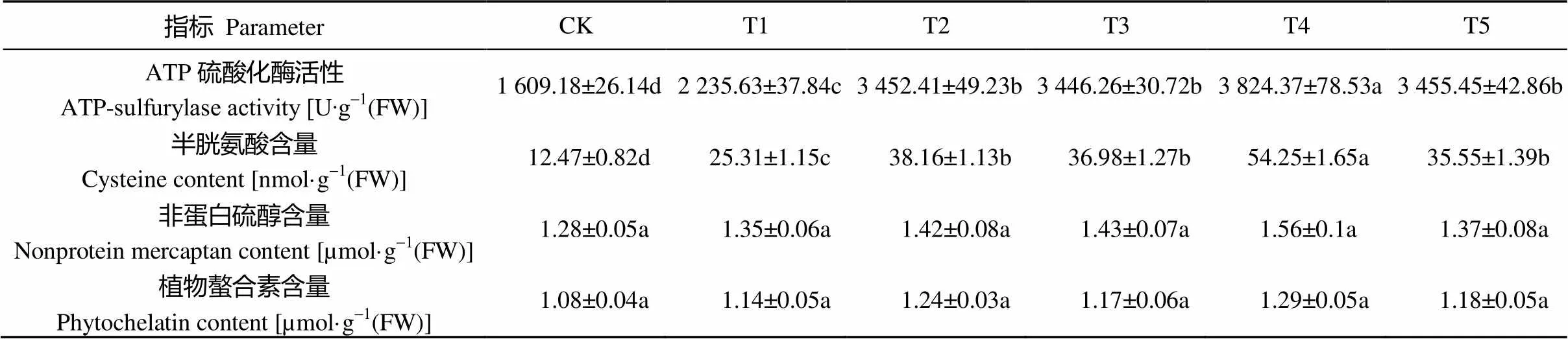
表4 外源乙烯和(NH4)2SO4处理对玉米幼苗硫代谢的影响
同行不同小写字母表示各处理间差异显著(<0.05)。Different lowercase letters in the same row indicate significant differences among treatments Sat 0.05 level.
2.4 BSO对外源乙烯诱导的玉米Cd耐受性的影响
为进一步验证GSH在乙烯诱导玉米Cd耐受过程中的作用, 本研究利用GSH专一性合成抑制剂BSO, 研究其对GSH含量、H2O2含量、Rubisco酶活性和光合作用的影响。由表5可知, 添加BSO对玉米幼苗中的GSH合成有显著负作用, Cd+BSO处理与Cd处理相比, GSH含量显著降低, 在Cd+BSO处理的基础上, 添加乙烯可以提升玉米幼苗中GSH含量, 同时添加乙烯和(NH4)2SO4, GSH含量进一步提升, 但相对单独Cd处理(T1)的含量要显著降低; 另一方面, 添加BSO可导致H2O2含量显著上升, 进而影响光合作用, 导致Rubsico酶活性、光合速率、气孔导度、胞间二氧化碳降低(表5)。结果表明, 外源乙烯缓解Cd胁迫对玉米的毒害作用与GSH生物合成的增强紧密相关。
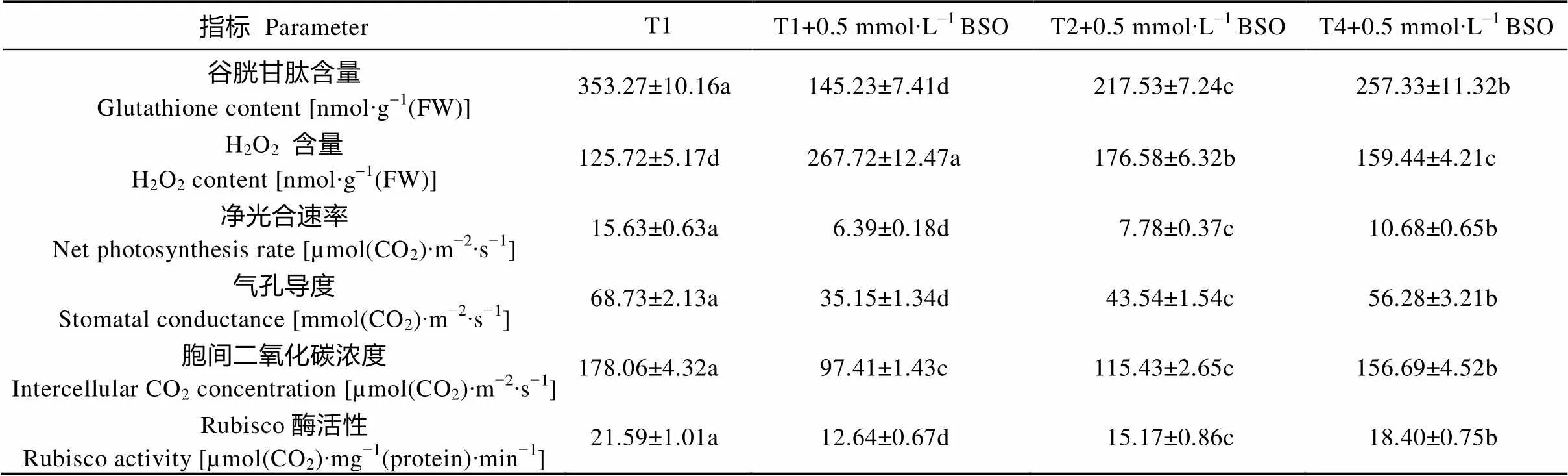
表5 谷胱甘肽合成抑制剂丁硫氨酸-亚砜亚胺(BSO)对玉米幼苗谷胱甘肽、H2O2含量和光合作用的影响
同行不同小写字母表示各处理间差异显著(<0.05)。Different lowercase letters in the same row indicate significant differences among treatments at 0.05 level.
2.5 外源乙烯对玉米体内Cd含量与亚细胞分布的影响
从表6可知, Cd胁迫可导致玉米叶片与根中Cd含量急剧上升。在添加外源乙烯以后, 相对Cd处理, 叶片中的Cd含量下降50.55%, 而根中Cd含量则上升71.14%。进一步进行Cd的亚细胞分布分析, 发现叶片细胞壁中Cd含量上升, 但变化不显著; 在细胞器和含有液泡的可溶性组分中, Cd含量显著下降(表6)。根细胞壁和可溶性组分中的Cd含量显著上升, 而在细胞器中的含量则有少量降低(表6)。结果表明, 根细胞壁的固定和液泡区室化作用, 可降低Cd向玉米叶片中的转移。
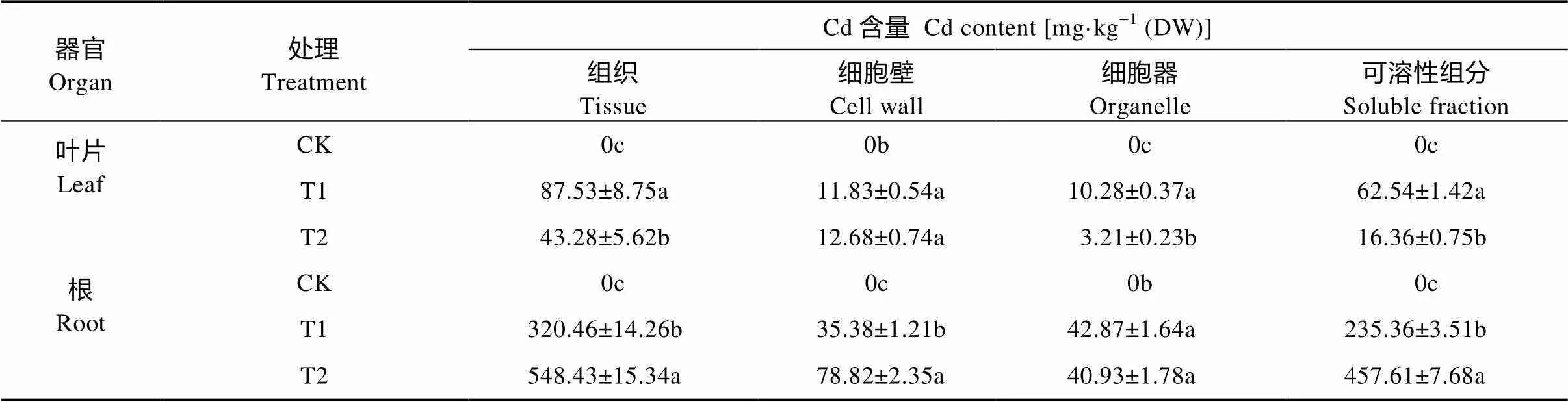
表6 外源乙烯对Cd胁迫下玉米幼苗Cd分布的影响
不同小写字母表示各处理间差异显著(<0.05)。Different lowercase letters indicate significant differences among different treatments at 0.05 level.
3 讨论与结论
Cd是环境中广泛存在的一种对植物和动物均能产生毒害的污染物, 它易被高等植物体吸收, 并引起植物生长抑制作用, 其中Cd胁迫诱导植物体内产生ROS, 而产生氧化胁迫, 是抑制植物生长的主要原因。ROS可使细胞膜脂质过氧化, 继而破坏植物器官和组织, 胞内电解质流出, 电导率升高[30]。MDA是细胞膜脂质过氧化的最终产物, 可反映逆境胁迫对植物造成的伤害程度[30]。刘艳菊[15]研究表明, 添加外源乙烯可以显著降低拟南芥幼苗中Cd胁迫诱导产生的H2O2和MDA含量。本研究结果亦表明, 与Cd处理相比, 添加外源乙烯或(NH4)2SO4可降低玉米幼苗叶片与根中的H2O2和MDA含量, 同时添加乙烯和(NH4)2SO4的效果最佳, 表明乙烯与(NH4)2SO4对缓解玉米幼苗Cd毒害具有协同效应。
通常植物在逆境胁迫下产生的过量ROS可以通过抗氧化酶促反应(SOD、CAT等)和非酶促反应(AsA、GSH等)加以清除[30]。刘艳菊[15]发现外源乙烯处理可以降低Cd胁迫下拟南芥中的SOD和GR活性, 而CAT活性增强。Abozeid等[31]研究发现, 外源乙烯可以促进Cd胁迫油菜()幼苗SOD、CAT等抗氧化酶活性, 表明SOD、CAT等抗氧化酶在外源乙烯介导的拟南芥、油菜Cd耐受过程中发挥重要作用。而本研究发现, Cd胁迫下补充外源乙烯或(NH4)2SO4, SOD与CAT活性显著降低, 与上述研究结果不一致, 表明乙烯处理后的玉米幼苗中有其他机制参与解Cd毒过程, 以清除过量的ROS。为此, 我们测定了部分抗氧化物质(AsA、GSH)在Cd、Cd+乙烯、Cd+(NH4)2SO4处理下玉米幼苗中的变化。结果发现玉米幼苗中AsA与GSH含量在Cd处理后上升(相对CK), 在添加外源乙烯和(NH4)2SO4以后, 其含量得到进一步显著提升, 这与外源NO对Cd处理下芥菜()幼苗中AsA、GSH等的变化趋势一致[32]。表明外源乙烯或(NH4)2SO4可能与外源NO的作用机理类似, 都是通过抗氧化物质非酶促反应清除植物中Cd处理诱导产生的ROS, 而非通过抗氧化酶促反应。
Cd处理可严重影响植物光合作用, 如Cd处理下的芥菜, 与光合作用紧密相关的叶绿素含量和Rubisco酶活性相对对照显著降低, 从而影响了芥菜的光合作用; 而在Cd处理的基础上, 添加外源乙烯、S或者NO, 均可缓解Cd处理造成的芥菜幼苗光合抑制作用, 这与叶绿素合成和Rubisco酶活性的增强, 以及叶片中气孔的完整性和开张紧密相关[14,21,33]。本研究亦发现外源乙烯与(NH4)2SO4处理可通过显著提升Rubisco酶活性, 从而减轻Cd处理对玉米幼苗光合作用的影响。
植物细胞中一些非蛋白硫醇化合物(NPT, PCs)在植物体内可以与Cd、Pb等重金属离子进行螯合, 从而起到解毒和平衡植物体内重金属水平的作用[8]。PCs是植物中报导最多、作用最强的重金属螯合剂之一, 它可将细胞质中低分子量Cd螯合, 然后转运至液泡中, 并在液泡中聚合形成性状稳定的高分子量复合物, 从而解除Cd对植物的毒害[34]。许多研究表明, 添加外源生长调节剂, 可以促进植物体内硫代谢物(NPT、PCs、GSH)的合成, 如添加外源S, 可促进小白菜()幼苗中PCs、AsA和GSH的合成, 从而提升小白菜幼苗的Cd耐受能力[35-36]; 外源NO亦可以通过促进芥菜幼苗硫代谢(GSH、PCs、NPT等)而增强其在Cd处理环境中的生长[21,37]。本研究发现, 与单独Cd处理相比, 添加外源乙烯和(NH4)2SO4处理可显著提升玉米幼苗中ATP-S和GR酶活性, Cys、AsA和GSH含量显著上升, 而对NPT和PCs含量则无明显影响。推测外源乙烯主要通过促进叶片AsA和GSH等硫代谢物的合成, 以保障玉米幼苗在Cd处理环境中的生长, 而不是通过提升NPT、PCs的作用。为验证该推论, 我们利用GSH合成抑制剂BSO处理乙烯和Cd胁迫下的玉米幼苗, 结果发现, 添加BSO可导致叶片GSH含量降低, H2O2含量显著上升, 进而导致Rubsico酶活性、光合速率、气孔导度、胞间二氧化碳降低, 影响光合作用, 这些结果在一定程度上验证了我们推论的可靠性。也有研究发现石竹()[38]、天蓝遏蓝菜()[39]的Cd超富集能力与PCs、NPT等含量的高低无关。因此, 在外源乙烯介导的玉米幼苗Cd耐受过程中有其他作用机制起着关键作用。
细胞壁是植物抵御重金属胁迫的第一道屏障, 其中的草酸氧化酶、果胶、半纤维素可以与Cd2+结合, 降低Cd向细胞内的转运量, 从而降低Cd向地上部位的运输量[28,37]。为进一步分析外源乙烯处理对玉米幼苗中Cd分布的影响, 我们测定了玉米叶片和根, 及其亚细胞中的Cd含量。结果发现外源乙烯处理可以显著降低叶片中Cd含量, 而在根中的含量则显著上升。亚细胞分析结果表明, 外源乙烯处理对叶片中细胞壁的Cd含量影响不显著, 而在细胞器和含有液泡的可溶性组分中的含量则急剧降低; 根细胞壁和可溶性组分中的Cd含量显著上升, 在细胞器中的含量变化无显著性差异。结果表明, 玉米幼苗根细胞壁固定作用和液泡区室化作用, 在外源乙烯介导的玉米幼苗Cd耐受过程中发挥重要作用。
因此, 外源乙烯增强玉米幼苗Cd耐受性的可能机制为: ①增强玉米根细胞壁对Cd的吸附作用和液泡的区室化作用, 减少Cd向地上部位的转运。②对转运至叶片的Cd, 则通过提升幼苗叶片GSH的合成和AsA含量, 增强Cd诱导产生的ROS的清除能力, 从而缓解Cd对叶片的毒害。
[1] 李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104–107 LI J, ZHOU Y W, CHEN S, et al. Actualities, damage and management of soil cadmium pollution in China[J]. Anhui Agricultural Science Bulletin, 2015, 21(24): 104–107
[2] KOVÁČIK J, BABULA P, KLEJDUS B, et al. Comparison of oxidative stress in fourspecies exposed to cadmium[J]. Plant Physiology and Biochemistry, 2014, 80: 33–40
[3] CHOPPALA G, SAIFULLAH, BOLAN N, et al. Cellular mechanisms in higher plants governing tolerance to cadmium toxicity[J]. Critical Reviews in Plant Sciences, 2014, 33(5): 374–391
[4] RIZWAN M, ALI S, ADREES M, et al. A critical review on effects, tolerance mechanisms and management of cadmium in vegetables[J]. Chemosphere, 2017, 182: 90–105
[5] CHANEY R L. How does contamination of rice soils with Cd and Zn cause high incidence of human Cd disease in subsistence rice farmers[J]. Current Pollution Reports, 2015, 1(1): 13–22
[6] HUGUET S, BERT V, LABOUDIGUE A, et al. Cd speciation and localization in the hyperaccumulator[J]. Environmental and Experimental Botany, 2012, 82: 54–65
[7] VERBRUGGEN N, HERMANS C, SCHAT H. Molecular mechanisms of metal hyperaccumulation in plants[J]. New Phytologist, 2009, 181(4): 759–776
[8] 薛洪宝, 常华兰, 陶兆林, 等. 玉米发芽过程中Cd和硫醇化合物相互作用的研究[J]. 农业环境科学学报, 2011, 30(5): 824–829 XUE H B, CHANG H L, TAO Z L, et al. The interaction between Cd and thiol compounds during the maize seed germination[J]. Journal of Agro-Environment Science, 2011, 30(5): 824–829
[9] COBBETT C S. Phytochelatins and their roles in heavy metal detoxification[J]. Plant Physiology, 2000, 123(3): 825–832
[10] WANG F F, CUI X K, SUN Y, et al. Ethylene signaling and regulation in plant growth and stress responses[J]. Plant Cell Reports, 2013, 32(7): 1099–1109
[11] 于延文. 乙烯和赤霉素调控植物耐逆性的分子基础[D]. 保定: 河北农业大学, 2016 YU Y W. Molecular mechanism of ethylene and gibberelin in regulating stress tolerance[D]. Baoding: Hebei Agricultural University , 2016
[12] VAN LOON L C, GERAATS B P J, LINTHORST H J M. Ethylene as a modulator of disease resistance in plants[J]. Trends in Plant Science, 2006, 11(4): 184–191
[13] ACHARD P, CHENG H, DE GRAUWE L, et al. Integration of plant responses to environmentally activated phytohormonal signals[J]. Science, 2006, 311(5757): 91–94
[14] KHAN N A, ASGHER M, PER T S, et al. Ethylene potentiates sulfur-mediated reversal of cadmium inhibited photosynthetic responses in mustard[J]. Frontiers in Plant Science, 2016, 7: 1628
[15] 刘艳菊. 外源镉及乙烯对拟南芥幼苗生理代谢的影响研究[D]. 哈尔滨: 东北林业大学, 2013 LIU Y J. Studies on physiological metabolism of arabidopsis under exogenous cadmium and ethylene[D]. Harbin: Northeast Forestry University, 2013
[16] 陈丹丹. 乙烯调节镉胁迫下拟南芥根构型的研究[D]. 哈尔滨: 东北林业大学, 2014 CHEN D D. Studies on ethylene regulate root configuration of arabidopsis under cadmium stress[D]. Harbin: Northeast Forestry University, 2014
[17] 祁迎春, 王建, 陆斌, 等. 榆林市区周边土壤重金属污染特征与评价[J]. 陕西农业科学, 2017, 63(6): 50–53 QI Y C, WANG J, LU B, et al. The characteristics and evaluation of heavy metal contamination for soils at the suburb of Yulin City[J]. Shaanxi Journal of Agricultural Sciences, 2017, 63(6): 50–53
[18] 王玉萍, 常宏, 李成, 等. Ca2+对镉胁迫下玉米幼苗生长、光合特征和PSⅡ功能的影响[J]. 草业学报, 2016, 25(5): 40–48 WANG Y P, CHANG H, LI C, et al. Effects of exogenous Ca2+on growth, photosynthetic characteristics and photosystem Ⅱ function of maize seedlings under cadmium stress[J]. Acta Prataculturae Sinica, 2016, 25(5): 40–48
[19] OKUDA T, MATSUDA Y, YAMANAKA A, et al. Abrupt increase in the level of hydrogen peroxide in leaves of winter wheat is caused by cold treatment[J]. Plant Physiology, 1991, 97(3): 1265–1267
[20] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 第3版. 北京: 高等教育出版社, 2003 ZHANG Z L, QU W J. The Experimental Guide for Plant Physiology[M]. 3rd ed. Beijing: High Education Press, 2003
[21] PER T S, MASOOD A, KHAN N A. Nitric oxide improves S-assimilation and GSH production to prevent inhibitory effects of cadmium stress on photosynthesis in mustard (L.)[J]. Nitric Oxide, 2017, 68: 111–124
[22] ZHOU W, ZHAO D, LIN X. Effects of waterlogging on nitrogen accumulation and alleviation of waterlogging damage by application of nitrogen fertilizer and mixtalol in winter rape (L.)[J]. Journal of Plant Growth Regulation, 1997, 16(1): 47–53
[23] AEBI H. Catalase[J]. Methods in Enzymology, 1984, 105: 121–126
[24] FOYER C H, HALLIWELL B. The presence of glutathione and glutathione reductase in chloroplasts: A proposed role in ascorbic acid metabolism[J]. Planta, 1976, 133(1): 21–25
[25] ANDERSON M E. Determination of glutathione and glutathione disulfide in biological samples[J]. Methods in Enzymology, 1985, 113: 548–555
[26] GAITONDE M K. A spectrophotometric method for the direct determination of cysteine in the presence of other naturally occurring amino acids[J]. Biochemical Journal, 1967, 104(2): 627–633
[27] DEVI S R, PRASAD M N V. Copper toxicity inL. (coontail), a free floating macrophyte: Response of antioxidant enzymes and antioxidants[J]. Plant Science, 1998, 138(2): 157–165
[28] 潘瑶, 尹洁, 高子平, 等. 硫对水稻幼苗镉积累特性及亚细胞分布特征的影响[J]. 农业资源与环境学报, 2015, 32(3): 275–281 PAN Y, YIN J, GAO Z P, et al. Effects of sulfur on the accumulation and subcellular distribution of cadmium in rice seedlings[J]. Journal of Agricultural Resources and Environment, 2015, 32(3): 275–281
[29] 张雯. 硫硒交互对水稻幼苗镉累积和毒害的影响机制研究[D]. 上海: 华东理工大学, 2014 ZHANG W. Influence mechanism of sulfur and selenium interaction on cadmium accumulation and toxicity in rice seedling[D]. Shanghai: East China University of Science and Technology, 2014
[30] APEL K, HIRT H. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55: 373–399
[31] ABOZEID A, YING Z J, LIN Y C, et al. Ethylene improves root system development under cadmium stress by modulating superoxide anion concentration in[J]. Frontiers in Plant Science, 2017, 8: 253
[32] MASOOD A, KHAN M I R, FATMA M, et al. Involvement of ethylene in gibberellic acid-induced sulfur assimilation, photosynthetic responses, and alleviation of cadmium stress in mustard[J]. Plant Physiology and Biochemistry, 2016, 104: 1–10
[33] DONG Y J, CHEN W F, XU L L, et al. Nitric oxide can induce tolerance to oxidative stress of peanut seedlings under cadmium toxicity[J]. Plant Growth Regulation, 2016, 79(1): 19–28
[34] MENDOZA-CÓZATL D G, MORENO-SÁNCHEZ R. Control of glutathione and phytochelatin synthesis under cadmium stress. Pathway modeling for plants[J]. Journal of Theoretical Biology, 2006, 238(4): 919–936
[35] LIANG T, DING H, WANG G D, et al. Sulfur decreases cadmium translocation and enhances cadmium tolerance by promoting sulfur assimilation and glutathione metabolism inL.[J]. Ecotoxicology and Environmental Safety, 2016, 124: 129–137
[36] LUO L L, KANG J Q, PANG H X, et al. Sulfur protects pakchoi (L.) seedlings against cadmium stress by regulating ascorbate-glutathione metabolism[J]. International Journal of Molecular Sciences, 2017, 18(8): 1628
[37] ZHAO H, JIN Q J, WANG Y J, et al. Effects of nitric oxide on alleviating cadmium stress in[J]. Plant Growth Regulation, 2016, 78(2): 243–251
[38] WÓJCIK M, DRESLER S, PLAK A, et al. Naturally evolved enhanced Cd tolerance ofL. is not related to accumulation of thiol peptides and organic acids[J]. Environmental Science and Pollution Research, 2015, 22(10): 7906–7917
[39] EBBS S, LAU I, AHNER B, et al. Phytochelatin synthesis is not responsible for Cd tolerance in the Zn/Cd hyperaccumulator(J. & C. Presl)[J]. Planta, 2002, 214(4): 635–640
Effect of exogenous ethylene on physiological metabolism ofseedlings under cadmium stress*
LIU Juan1, ZHAO Huanrui1, LIU Yonghua1, WANG Jinghui2
(1. College of Life Science, College of Yulin, Yulin 719000, China; 2. College of Chemistry and Chemical Engineering, College of Yulin, Yulin 719000, China)
There has been increasing heavy metals [especially cadmium (Cd)] pollution in farmlands in China. Studies have identified the crucial role of exogenous ethylene in the reversal of Cd stress in plants such asmustard. However, few studies have been done on maize (), which is the second largest staple crop in China. To investigate the potential process by which exogenous ethylene alleviates Cd stress in maize, hydroponic experiments were conducted. The experiments included a treatment that served as a blank control and others that were Cd and (NH4)2SO4treatments. Changes in physiological indexes of maize seedling leaf along with subcellular distribution of Cd in leaves and roots of the plant were determined under Cd treatment, exogenous ethylene treatment and exogenous sulphur treatment. The results suggested that H2O2and malondialdehyde (MDA) contents of maize seedling leafdecreased under exogenous ethylene and exogenous (NH4)2SO4treatments, comparing with Cd treatment alone. Also, the rate of net photosynthesis was promoted by 1.23 times and 1.22 times respectively under exogenous ethylene and exogenous (NH4)2SO4treatments. The activity of antioxidant enzymes [superoxide diamutase (SOD), catalase (CAT)] significantly decreased, while the contents of antioxidants [ascorbic acid (AsA) and glutathione (GSH)] significantly increased under exogenous ethylene or exogenous (NH4)2SO4treatments with Cd stress. The results suggested that exogenous ethylene reduced Cd-induced oxidative stress and the degree of lipid peroxidation by enhancing non-enzymatic antioxidant reaction. However, it did not affect enzymatic antioxidant reaction, but then promoted photosynthetic processes. Compared with Cd treatment alone, the activities of ATP sulfurylase and glutathione reductase (GR), and the contents of cysteine and GSH in maize seedlings increased respectively by 54.43%, 27.93%, 50.77%, and 49.85% with exogenous ethylene treatment. However, there was no significant change in non-protein thio (NPT) and phytochelatins (PCs) contents. The results showed that ethylene potentiated GSH biosynthesis to resist Cd conditions. To show this that was the case, a GSH biosynthetic inhibitor — buthionine sulfoximine (BSO) — was applied on maize seedlings under Cd and exogenous ethylene conditions. Compared with Cd plus exogenous ethylene treatment, BSO significantly decreased GSH content, increased H2O2content and reduced net photosynthesis rate. Furthermore, Cd content in roots significantly increased while it decreased in leaves after treatment with exogenous ethylene under Cd stress. Further analysis showed that Cd content in cell wall and vacuole of roots was enhanced with exogenous ethylene treatment. Totally, exogenous ethylene reversal of the effect of Cd stress on maize was a complex process involving the promotion of GSH and AsA contents and Cd distribution in roots. On the one hand, exogenous ethylene treatment enhanced non-enzymatic antioxidant capacity by increasing the contents of GSH and AsA, and not by improving the activities of antioxidant enzymes nor chelating NPT and PC in maize leaf. On the other hand, translocation of Cd from maize root to leaf was reduced by enhancing Cd sequestration in cell walls and vacuoles of maize root. The results provided the fundamental information for the application of ethylene in the reversal of heavy metal stress.
Cadmium; Ethylene;; Physiological mechanism; Sulphur; Seedling
LIU Juan, E-mail: c253781777@126.com
Oct. 15, 2018;
Dec. 24, 2018
Q945.78
A
2096-6237(2019)05-0757-09
10.13930/j.cnki.cjea.180915
2018-10-15
2018-12-24
* This study was supported by the National Natural Science Foundation of China (31760209), the Special Research Program in Science of Education Department of Shaanxi Province (17JK0898), and the Start Research Grant for PhD of College of Yulin (16GK08).
* 国家自然科学基金项目(31760209)、陕西省教育厅专项科学研究计划项目(17JK0898)和榆林学院博士科研启动基金(16GK08)资助
刘娟, 赵欢蕊, 刘永华, 王镜惠. 外源乙烯对镉处理下玉米幼苗生理代谢的影响[J]. 中国生态农业学报(中英文), 2019, 27(5): 757-765
LIU J, ZHAO H R, LIU Y H, WANG J H. Effect of exogenous ethylene on physiological metabolism ofseedlings under cadmium stress[J]. Chinese Journal of Eco-Agriculture, 2019, 27(5): 757-765
刘娟, 主要从事植物生理方面的研究。E-mail: c253781777@126.com

