脑卒中患者血清PARK7及ADMA水平与神经功能缺损的关系
曹 康 张永全 蔡碧清 胡洒洒 潘珠娣
1)广西中医药大学,广西 南宁 530000 2)广西中医药大学附属瑞康医院神经内科二区,广西 南宁 530000
脑卒中为神经系统常见病之一,现已高居全球死亡病因第2位[1],是致死率和致残率最高的神经系统疾病之一。因而发病早期准确的诊断对脑卒中的预防和诊断有重要意义,也是降低其致死率和致残率的方案之一[2]。虽然目前影像学检查包括颅脑CT、MRI等基本可确诊脑急性脑卒中,但还应注意在影像学不容易获取的环境中,亦或影像学检查不能很好地显示轻度脑缺血损伤的患者中,是否有生物标志物指标可能也是一种重要的诊断工具[3]。由于脑卒中存在个体异质性,因此需要更多可以早期判断脑缺血损伤的指标得以辅助诊断。随着近年来新的脑卒中生物标志物检测的引入,对于脑损伤的诊疗、病情评估和预后有重要指导意义[4]。研究发现,一些单独检测的标记物具有显著的敏感性和特异性[5-6]。但这些标志物大多在短期队列研究中进行,其出现在脑卒中发病后的血液中较晚,且血浆浓度无相对较高的敏感性和特异性,其检测指标提示脑损伤和脑卒中的能力相对较低。因而引入新的脑特异性标记物可使其更容易在血液样本中检测到,并可在卒中发生后较早提供诊断、治疗及预后等方面的预测依据。回顾多项研究可以发现,在急性卒中发生后,血浆中即可出现人帕金森蛋白7(PARK7)、非对称二甲基精氨酸(ADMA)水平变化,预示着其可作为中风早期诊断的血浆生物标志物之一[7-9]。因此对血清PRAK7、ADMA的研究或许可以为脑卒中早期诊断提供依据。本文选择82例损害不同程度的脑卒中患者,研究其血清PARK7、ADMA水平与神经功能缺损的相互关系。
1 资料与方法
1.1临床资料随机选取2017-01-01―2018-01-01至广西中医药大学附属瑞康医院治疗的脑卒中患者82例为实验组,同时随机选取非脑卒中患者82例为对照研究。入组标准:(1)脑卒中组患者症状判别依据“FAST”判断法[10]并及时送至医院;(2)经神经学体格检查、颅脑CT等明确诊断;(3)对照组排除神经系统疾病;(4)心电图、肝肾功能提示无明显异常;(5)无精神类疾病;(6)患者或其家属知情本研究并同意。本研究经广西中医药大学附属瑞康医院医学临床研究伦理委员会审查批准。2组一般资料差异无统计学意义(P<0.05),具有可比性。见表1。依据《脑卒中疾病神经功能相关缺损程度评分标准》[11-12]对脑卒中组患者进行量化评分,并以此分为轻度损害组48例、中度损害组20例及重度损害组14例。
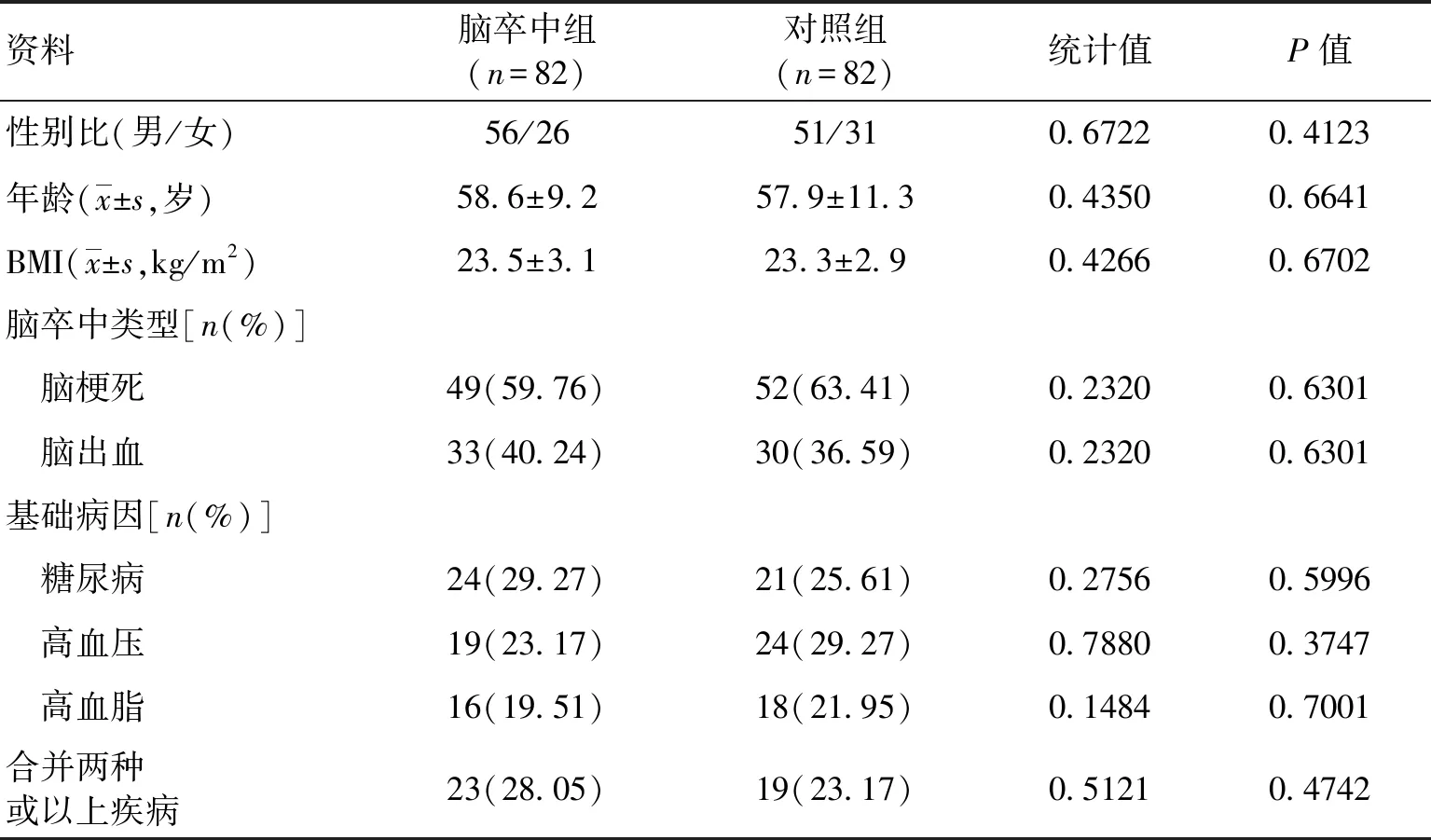
表1 2组一般资料比较
1.2方法及观察指标依据《脑卒中疾病神经功能相关缺损程度评分标准》对所有入院的脑卒中组患者进行量化评分,1~15分为轻度损害组,16~30分为中度损害组,31~45分为重度损害组。治疗前测定所有患者血清PARK7、ADMA水平,作为参考依据。

2 结果
2.1各组神经功能相关评分及血清PARK7、ADMA水平情况比较轻、中及重度损害组血清PARK7水平及ADMA水平均明显高于对照组,差异有统计学意义(P<0.05),且3组间对比差异也有统计学意义(P<0.05)。见表2。
2.2血清PARK7、ADMA水平变化与神经功能缺损程度相互关系2组血清学数据使用Speaman等级相关和Pearson相关性分析发现,其水平变化与脑卒中患者神经功能相关评分严重程度呈正相关变化,即脑卒中病情越重,相应神经功能相关评分也越高,血清PARK7、ADMA水平越高(rPARK7=0.996 7,PPARK7=0.003 3;rADMA=0.999 7,PADMA=0.000 3),差异有统计学意义(P<0.05)。见图1、图2。
3 讨论
脑卒中分为脑梗死和脑出血,其中脑梗死约占70%,常见的卒中危险因素,如糖尿病、高血压、高血脂、心脏病、年龄及吸烟等均可引起脑血管内皮损伤[13]。研究表明,急性脑卒中事件发生后,血清PARK7及ADMA水平即出现变化,且随卒中严重程度呈时间型增加[7-9,14]。
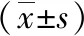
表2 各组神经功能相关评分及血清PARK7、ADMA水平比较
注:与对照组比较,1P<0.05;与轻度损害组比较,2P<0.05;与中度损害组比较,3P<0.05;与重度损害组比较,4P<0.05
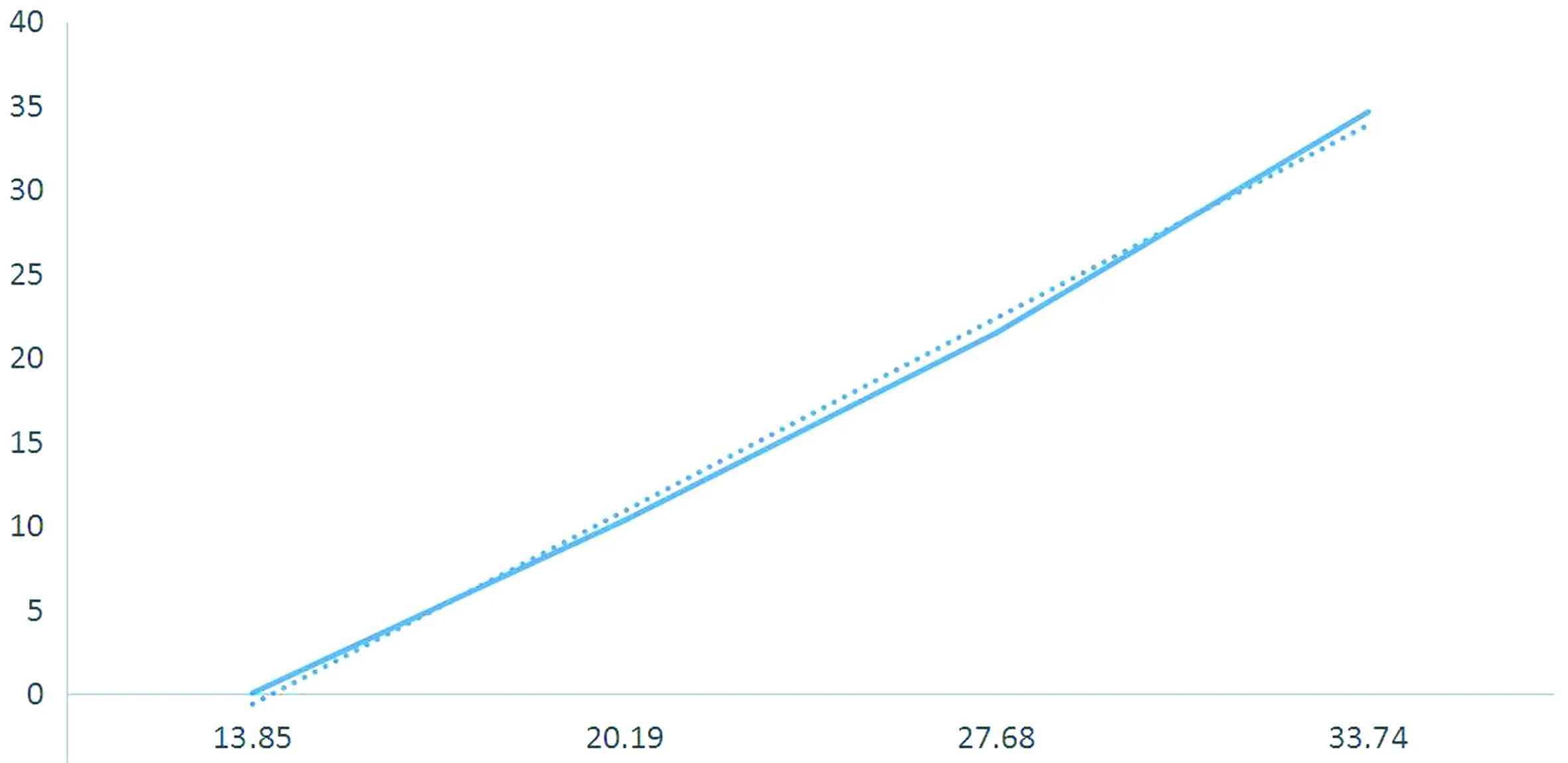
图1 血清PARK7水平变化与神经功能缺损程度的相互关系Figure 1 Correlation between changes in serum PARK7 levels and degree of neurological deficits

图2 血清ADMA水平变化与神经功能缺损程度的相互关系Figure 2 Correlation between changes in serum ADMA levels and degree of neurological deficits
血清PARK7在正常机体内含量较低,研究发现其在脑损害区域表达十分丰富。主因PARK7是一种关键的抗活性氧的氧化应激反应蛋白。可通过线粒体途径参与中风后的急性内源性神经保护,从而减少线粒体依赖的氧化应激导致细胞凋亡,从而对缺血/再灌注损伤引起的神经变性具有神经保护作用[7,15-17]。研究发现PARK7是与中风密切相关的生物标志物。卒中3 h内即可见PARK7浓度均高,其敏感性54%~91%,提示其可作为急性卒中早期诊断的可靠生物标志物[18]。PARK7在不同类型的卒中均可通过抗氧化作用防止细胞凋亡事件,但其具体机制仍然在研究中[19-21]。关于小鼠缺血性卒中模型诱导脑中动脉闭塞的实验发现,PARK7相关化合物可降低小鼠梗死体积,预防神经元死亡,从而减轻神经功能障碍[22-24]。因此可以预测,PARK7在缺血性卒中的早期诊断、对卒中后脑保护机制以及对卒中的治疗中可能都发挥着重要的作用。由于血清学改变往往均快于影像学的变化,在不能获取影像学检查或轻型卒中患者影像学无法辨别时,有效的生物学指标会更加敏感,对提高脑卒中的早期诊断率以及治疗方面可能起着十分重要的作用。
研究证实,诸多危险因素均可诱发一种因子产生过多ADMA[25-26]。ADMA是动脉粥样硬化和内皮细胞功能障碍的中介物质,属于内源性一氧化氮合酶抑制剂。研究发现ADMA可能在以某种特异性方式促进动脉粥样硬化进程[27]。多项研究也表明血浆ADMA水平在高胆固醇、高血压[28-29]、高同型半胱氨酸血症[30-31]、糖尿病[32]、年龄和吸烟[33]等血管性高危因素存在的患者中升高[34]。而这些高危因素恰恰也是脑血管事件的高危因素,可以预测ADMA与脑卒中的发生也存在某种关联。由此开展的临床研究发现,急性脑卒中事件发生后,ADMA水平随脑卒中严重程度的升高而升高,可能是通过减少脑血流、促进氧化应激和炎症反应而在脑损伤中发挥作用[9,35]。很多临床研究也探讨了血浆ADMA水变化与脑血管疾病的相关性,发现急性脑卒中后血浆ADMA浓度随脑卒中严重程度的增加呈时间型增加[36-39]。虽ADMA对卒中风险的作用愈发明显,但其在急性卒中损伤中的作用尚不清楚。研究表明,氧化应激引起的两种不同机制均可导致细胞内ADMA水平升高[40-41]。在卒中患者中ADMA的增加可能不仅是卒中后脑损伤的标志物,也是脑损伤的中介物质。它可通过抑制NOS对静息状态和急性卒中后脑血管顺应性以及限制脑血流发挥重要作用[42]。 ADMA对急性缺血性脑卒中的另一个影响可能是抑制nNOS NO的产生,保护神经元不受过度表达NO介导的损伤从而对中枢神经系统起到保护作用[43]。
基于上述研究,或许在卒中后早期ADMA浓度可以诊断和预测卒中结局,对脑卒中诊治及评估预后价值可能超越传统的危险因素,从而指导脑卒中预防的新方法[44-50]。血清PARK7、ADMA虽作用机制不同,但均在脑卒中发生时明显升高,且在卒中治疗、结局预测方面具有一定的相关性[51-56],为本研究提供充足了的理论依据。
本研究显示,卒中发生时血清PARK7可见升高,可能是其抗氧化、保护神经元等机制作用引起,同时ADMA水平亦增高,与ADMA减少脑血流、促氧化应激等作用机制相关。两者虽作用机制不同,但均在急性脑卒中发挥重要作用。另外,利用Speaman等级相关和Pearson相关性分析,发现2组血清学数据与脑卒中患者神经功能相关评分严重程度呈正相关变化。即脑卒中病变越重,相应神经功能相关评分也越高,血清PARK7、ADMA水平亦越高,提示可以通过这两个血清学分子提高脑卒中早期诊断及疗效的判定。
脑卒中发生时,患者常出现不同程度的神经功能缺损,而血清中PARK7、ADMA水平呈正相关变化,或许能为脑卒中的早期诊断及治疗提供新的血清生物学依据,也可对不同程度脑卒中转归的判断具有指导作用,有利于卒中治疗及病情评估,可以解决社会医疗的大难题。

