胃癌患者组织中FOXP3和P21表达水平的相关性及与预后的关系*
欧阳杰, 李洪, 王力斌, 李爱辉, 谢书勤, 梁卓虹
东莞东华医院肿瘤外科(广东东莞 523110)
胃癌是世界上最常见的恶性肿瘤之一,目前在国内是最高发的癌症之一,且胃癌是全球癌症相关死亡的第二大原因[1]。虽然目前胃癌的多种体细胞及相关机制研究已经比较深入,但目前针对胃癌中免疫调节相关的机制仍需要进一步明确。FOXP3是参与CD25+调节性T细胞(Treg)发育和功能的forkhead家族转录因子[2]。FOXP3表达被认为仅限于T细胞谱系。然而,一些研究人员利用免疫组织化学和流式细胞术分析人类黑色素瘤组织,发现FOXP3不仅在肿瘤浸润性Treg中表达,而且在黑色素瘤细胞中也表达[3]。因此,FOXP3基因在肿瘤发生中的功能以及调节FOXP3表达的机制目前成为了研究的热点。研究[4]表明,乳腺癌细胞中FOXP3的表达水平与患者的生存相关,提示肿瘤FOXP3的表达可能与转移潜能有关。但在胃癌中,肿瘤FOXP3的作用及仍需要进一步明确。最近的研究[5]表明肿瘤FOXP3在胃腺癌细胞中的表达抑制细胞增殖并增加细胞凋亡。普遍的细胞周期蛋白依赖性激酶(CDK)抑制因子P21通过作用于G1检查点,在阻止细胞周期进程中发挥重要作用[6]。最近的一项研究显示FOXP3和P21在乳腺癌组织中的表达强烈相关,特别是在FOXP3诱导后P21上调并有助于其肿瘤抑制活性[7]。关于FOXP3和P21之间的在胃癌组织中的关系仍需要进一步明确。因此,本研究旨在探讨胃癌患者组织中FOXP3和P21表达水平的相关性及与预后的关系。
1 资料与方法
1.1 一般资料 选取2014年7月至2017年1月因胃癌于我院治疗的患者86例,纳入标准:(1)经病理确诊为胃癌的患者;(2)病历资料及病理报告完整;(3)获得完整随访。排除标准:(1)合并免疫系统疾病的患者;(2)不能获得随访及了解预后情况的患者。本研究经向医院伦理委员会申请并审核通过。86例胃癌患者,男48例,女38例,年龄34~79岁,平均(49.8±10.7)岁。
1.2 免疫组化检测 每例患者的组织保存在甲醛溶液,并常规石蜡包埋,并制成4 μm的切片。在Leica 全自动免疫组化染色仪Bond软件操作,使用BondDewaxSolution(Vision BioSystems)常规进行的组织脱蜡,在100℃下采用Bond ER溶剂进行抗原修复30 min。通过将组织与过氧化氢温育5 min来淬灭内源性过氧化物酶。将切片在室温下与anti-FOXP3(1 ∶ 100,ab20034, Abcam,UK),anti-P21(1∶ 200,ab109520; Abcam,UK)按程序室温孵育1 h,使用不含生物素的聚合物辣根过氧化物酶二抗孵育1 h,细胞核用苏木精复染。在显微镜下评估FOXP3和P21的表达水平。
1.3 免疫组化统计 在高倍镜下(200×)评估肿瘤细胞质FOXP3的表达水平。至少有20%的核和细胞质染色被认为是FOXP3表达阳性。P21的表达≥30%的肿瘤细胞则定义为阳性细胞质表达。P21和FOXP3在胃癌组织中表达均至少选择5个视野进行评估,取平均值作为结果进行计算。
1.4 临床资料收集 收集所有患者的基本资料,包括肿瘤大小,组织类型、肿瘤TNM分期,病理分期,淋巴结和血管浸润情况,记录患者病理结果中的P53、Ki67表水平,记录患者随访的生存时间。
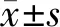
2 结果
2.1 FOXP3表达与临床特征的关系 其中胃癌组织中FOXP3表达水平与患者的性别、年龄、肿瘤大小、肿瘤分化程度、血管侵袭比例没有显著的相关性(P>0.05),而TNM分期为Ⅰ~Ⅱ期、病理分期为Ⅰ~Ⅱa期和没有淋巴侵袭的胃癌患者其FOXP3阳性比例显著高于阴性表达,差异有统计学意义(P<0.05),见表1。

表1 胃癌组织中FOXP3表达水平与临床特征的关系例(%)
2.2 FOXP3表达与P21及相关蛋白表达的关系 胃癌组织中FOXP3表达阳性其P21表达阳性的比例显著高于P21表达阴性(2=5.217,P=0.022),且呈显著的正相关(r=0.246,P=0.022),FOXP3表达与P53和Ki67表达无显著的相关性(P>0.05),见表2和图1。

表2 FOXP3表达与P21及相关蛋白表达的关系例(%)
2.3 胃癌组织中FOXP3表达水平与预后的关系 其中86例患者其随访时间为6~48个月,中位随访时间为33个月,总体存活率为69.8%,Kaplan-Meier生存曲线结果显示胃癌组织中FOXP3表达阳性的患者其总体生存率显著优于表达阴性的患者,差异有统计学意义(HR=0.429,95CI% 0.197~0.934,P=0.033),见图2。
3 讨论
目前研究表明FOXP3的表达多被认为仅限于T细胞系,而肿瘤细胞中的FOXP3表达本身并不涉及肿瘤发生[8]。在一些癌症包括胃癌、肝癌、乳腺癌、胰腺癌和肺癌、肿瘤微环境中浸润的FOXP3阳性Tregs增加已被报道为预后不良的风险因素[9-10]。而最近的研究表明肿瘤细胞本身中的FOXP3表达与肿瘤的进展同样具有密切的联系。FOXP3在多种肿瘤细胞中也表达,如乳腺癌细胞、黑色素瘤细胞、胰腺腺癌细胞和各种实体瘤[11]。进一步的研究结果显示FOXP3基因是乳腺癌、前列腺癌和非小细胞肺癌的肿瘤抑制基因。FOXP3表达的丧失通过允许HER-2/ErbB2癌基因的增强表达促进肿瘤发生,从而FOXP3参与HER-2/ErbB2癌基因在乳腺癌进展中的调节作用[12]。肿瘤FOXP3的上调同时可抑制了卵巢癌细胞的增殖,减少细胞的迁移和细胞侵袭[13]。但对于胃癌中FOXP3的表达水平是否与临床特征具有联系仍未明确。

图1胃癌组织中FOXP3和P21阳性和阴性表达(免疫组化,×200)

图2 胃癌组织中FOXP3表达与临床总体生存率的关系
本研究结果显示胃癌组织中癌细胞中也存在FOXP3阳性表达的情况,同时进一步分析胃癌组织FOXP3阳性表达与患者临床特征的情况,表明了胃癌FOXP3表达与TNM、病理分期和淋巴侵袭密切相关,同时FOXP3表达与P21的表达呈显著的正相关,表明了FOXP3在调控Treg的功能时,也调控了肿瘤本身的生长。本研究结果也与既往研究中FOXP3与P21在人类乳腺癌中的相关性结果相似。既往研究[6]显示了P21作为FOXP3转录调控的下游靶点发挥重要作用,并且其表达介导的乳腺癌细胞系的生长抑制。P21是肿瘤抑制基因的主要下游靶点,由于P21能够引起G1期细胞周期停滞[14],因此它是P53信号通路中G1/S转换的重要检查位点。
最后,本研究也分析了胃癌FOXP3表达与患者预后的关系,结果显示了胃癌FOXP3阳性表达的患者其临床预后显著优于FOXP3阴性表达的患者,这也进一步确认了胃癌中FOXP3的阳性表达是胃癌中的一个抑癌因素。既往关于肿瘤FOXP3亚细胞定位的研究报道了其在细胞质和细胞核中的异源定位[15]。尽管体外证据表明肿瘤FOXP3的肿瘤抑制功能,一种理论认为体外实验和临床应用之间的这种差异是因为肿瘤FOXP3的差异细胞质定位,在癌细胞中发现的FOXP3的各种亚细胞定位模式可能并不反映特定的功能状态[16]。但其如何调控胃癌病情进展的分子机制仍需要进一步明确。
综上所述,胃癌组织中FOXP3表达与肿瘤TNM、病理分期和淋巴侵袭密切相关,FOXP3表达与P21表达呈正相关,癌组织中FOXP3阳性是胃癌患者良好预后的重要因素。

