不同体外照射技术联合三维后装腔内放疗根治性治疗宫颈癌的结果比较*
杨利, 陈仙, 陈素玲, 韩颖, 徐志渊
香港大学深圳医院临床肿瘤中心(广东深圳 518053)
宫颈癌是女性生殖系统最常见的恶性肿瘤,2018年全球新发病例约60万例,死亡约31万例[1]。根治性同步放化疗(体外照射联合腔内近距离放疗+同期顺铂每周方案化疗)是失去手术机会或拒绝手术的宫颈癌患者的标准治疗模式[2]。随着计算机及影像学技术的不断发展和放疗设备的改进,宫颈癌的外照射放疗技术由既往的二维放疗向三维适形放疗(three-dimensional conformal radiotherapy,3D-CRT)、调强放疗(intensity modulated radiation therapy,IMRT)等精确放疗技术发展。3D-CRT因其在三维适形方面的优势以及技术相对简单的特点,目前在临床上应用较广泛;与3D-CRT相比,IMRT在保证靶区照射剂量合理分布的同时能更有效地降低危及器官的剂量,减少放疗反应、提高患者生活质量[3-4],因此IMRT技术的应用也逐渐增加。容积弧形调强放射治疗技术(RapidArc)是IMRT放疗技术的一种,不同于常规IMRT,RapidArc提供的是整个靶区的剂量,治疗计划算法保证了治疗准确度,并且能尽量减少对周围正常组织的投照剂量[5]。RapidArc在一次360°旋转过程中将剂量投照到整个肿瘤,缩短了每次治疗的时间,提高了工作效率,提高患者的舒适度,能减少因治疗期间患者体位移动而造成的放疗不良反应。尽管RapidArc较其他放疗技术在靶区剂量分布及保护危及器官方面具有优势,但其在宫颈癌根治性放疗中的研究仍然处于初步阶段。目前在宫颈癌根治性放疗中直接比较RapidArc与3D-CRT的研究少见。随着科室的发展,本科室对根治性放疗的宫颈癌患者先后采用了3D-CRT和RapidArc两种外照射技术,现将本科室经两种技术治疗的宫颈癌患者做对比分析,评估在日常医疗条件下两种技术的应用结果,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月至2017年12月我院收治的53例行根治性同步放化疗联合三维后装治疗(three dimensional brachytherapy,3D-BT)的ⅠB1~ⅢB期宫颈癌患者。体外照射技术采用四野盒式3D-CRT或RapidArc技术。所有患者资料均从医院医生工作站及Varian放射治疗系统中收集,对未按期门诊复诊的患者采用电话随访。病例入选标准:(1)病理证实的宫颈鳞癌或腺癌;(2)国际妇产科联盟(FIGO)分期ⅠB1~ⅢB期;(3)既往未进行过盆腔放疗;(4)年龄≥18岁;(5)ECOG (Eastern Cooperative Oncology Group)评分0~2分;(6)充分的造血功能(中性粒细胞绝对值≥1.5×109·L-1,血小板≥100×109·L-1);(7)血胆红素及转氨酶小于2倍正常值上限;肌酐清除率≥60 mL/分;(8)无化放疗禁忌证。治疗前基线检查包括:(1)病史采集及体格检查(包括ECOG评分、有经验的妇科肿瘤医生进行妇科检查并进行FIGO分期);(2)血常规,肝肾功能;(3)盆腔增强磁共振;(4)胸腹盆腔增强CT或PET/CT;(5)有临床指征时进行膀胱镜和乙状结肠镜检查。所有患者根据外照射技术的不同分为两组: RapidArc组与3D-CRT组。比较两组患者的治疗结果及急性毒性不良反应。所有患者治疗前均签署知情同意书。该研究取得我院医学伦理委员会的批准并且严格遵守赫尔辛基宣言。
1.2 治疗
1.2.1 CT 模拟定位 仰卧位,真空发泡胶或真空袋固定。宫颈肿物远端采用放射显影物标记。增强定位CT扫描,扫描范围从第10胸椎至股骨上1/3,3 mm层厚。分别采集充盈膀胱及排空膀胱2套CT图像。将CT图像传输至治疗计划系统(TPS),并与盆腔MRI图像融合。
1.2.2 RapidArc与3D-CRT外照射
1.2.2.1 靶区定义及勾画 参考公开发表的国际指引[6-7],GTV (Gross Tumor Volume,肿瘤区):结合妇科检查、CT、磁共振及PET-CT等多种检查结果确定,单独勾画转移淋巴结靶区为GTVn。CTV(Clinical Target Volume,临床靶区):CTV45:包括宫颈、宫体、宫旁、部分阴道及淋巴结引流区,肿瘤侵及阴道下 1/3的患者,应包括腹股沟淋巴结;CTV55:盆腔内GTVn外扩3 mm。ITV(Internal Target Volume,内靶区):对比CT模拟定位充盈和排空膀胱状态下采集的2套CT图像,依据器官和靶区的移动确定ITV的边界。PTV(Planning Target Volume,计划靶区):依据我科质量控制与质量保证团队测得的实际摆位和机器误差确定,PTV=ITV+5 mm。
1.2.2.2 处方剂量及照射计划 RapidArc组:采用同步缩野加量放疗,PTV45:45 Gy/25次, PTV55:55 Gy/25次,均5次/周;3D-CRT组:第一阶段PTV45:45 Gy/25次,5次/周;第2阶段:宫旁加量,ⅢB期16Gy/8次、ⅠB1~ⅢA期10 Gy/5次, 5次/周。
1.2.2.3 外照射危及器官OAR(Organ At Risk)剂量体积限定 直肠:V30≤60%、V50≤35%、Dmax<65 Gy;膀胱:V45≤35%、Dmax<65 Gy;股骨头:V35≤15%、Dmax<65 Gy;肾脏:单侧肾的2/3≤18 Gy;小肠:V40≤30%、Dmax<65 Gy;脊髓:≤ 45 Gy。外照射加后装近距离全段放疗计划评价标准:HR(high risk) CTV D90>80 Gy(EQD2), 直肠D2cc<70 Gy(EQD2), 乙状结肠D2cc<70 Gy(EQD2), 膀胱D2cc<90 Gy(EQD2)。
1.2.3 后装治疗 外照射放疗开始后第4~5周开始后装放疗。采用CT引导三维后装放疗,后装治疗采用192Ir(铱)高剂量率治疗,A点处方剂量:6 Gy/次,每周1次,共4次。外照射加后装治疗累计生物剂量80~85 Gy。
1.2.4 同期化疗 顺铂 40 mg/m2,1次/周,最多6周。
1.3 治疗评估及随访 治疗期间通过问诊、体格检查、每周1次查血评估毒性不良反应,所有毒性不良反应均根据“常见不良反应事件评价标准(CTCAE)4.03版本” 进行评估。治疗结束后患者由妇科肿瘤医生及放射治疗医生规律随访,临床怀疑肿瘤残留或复发时尽可能取得病理证实。
1.4 统计学方法 采用SPSS 19.0统计软件,对患者基线资料、治疗结果及毒性不良反应采用描述性统计分析及2检验、Fisher精确检验。无进展生存(Progression free survival,PFS)定义为治疗开始至疾病进展或死亡之间的时间。采用Kaplan-Meier及log-rank 进行生存分析及比较。双侧检验P≤0.05差异有统计学意义。
2 结果
2.1 患者临床资料 宫颈鳞癌患者53例,其中RapidArc组28例 (52.8%),3D-CRT组25例 (47.2%)。RapidArc组患者基线血红蛋白明显低于3D-CRT组(P=0.025),治疗前贫血(血红蛋白低于110 g/L)患者比例也较3D-CRT组高,两组患者其余基线资料均衡(表1)。
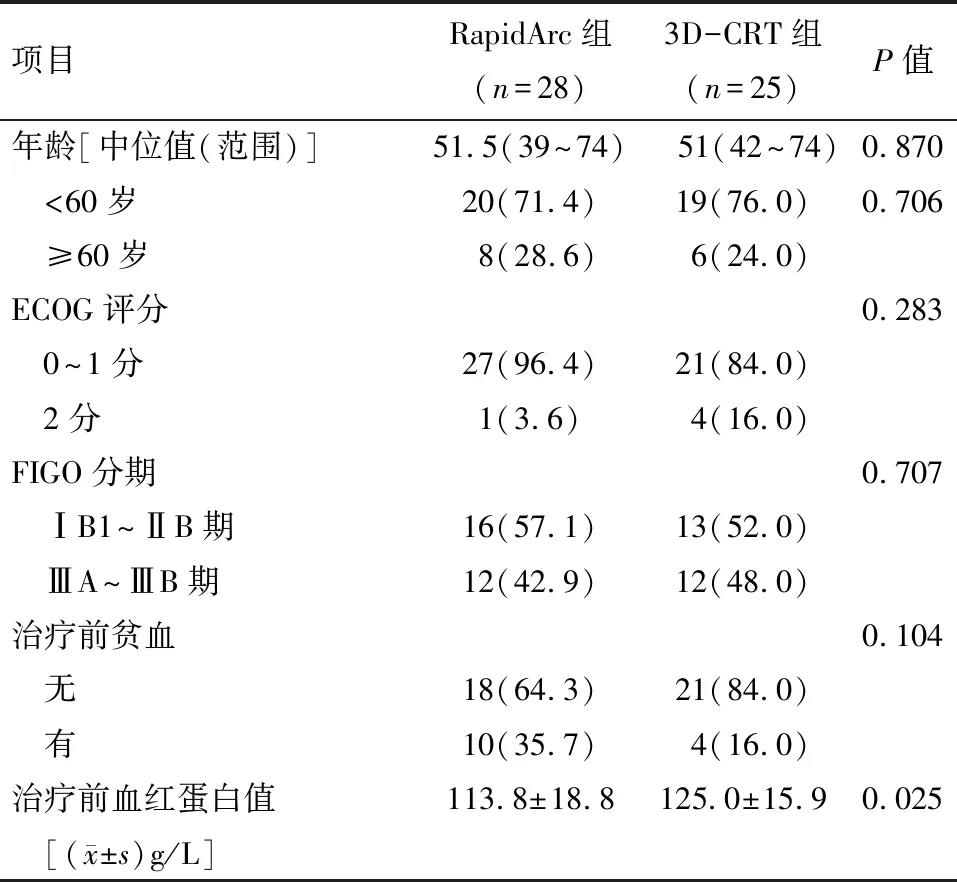
表1 患者临床资料 例(%)
2.2 治疗结果 53例患者中52例完成了计划的外照射及后装放疗,1例RapidArc组患者在第1次后装放疗时引导CT提示肿瘤范围仍较大,放弃后装放疗,改为外照射补量。所有患者治疗结束后2~3个月均无经病理证实的肿瘤残留。RapidArc组完成外照射治疗的时间比3D-CRT组缩短6.7 d(P=0.001)。同期化疗耐受性好,92%的RapidArc组患者接受了5~6周同期顺铂,95.7%的3D-CRT组患者接受了5~6周同期顺铂,两组患者同期顺铂的周期数及药物剂量强度均差异无统计学意义。见表2。
中位随访13.9个月(5.1~31.9个月),RapidArc组共有2例患者出现复发,其中1例宫颈及盆腔复发,另1例双肺转移;3D-CRT组有6例患者复发,其中1例宫颈及盆腔复发,1例宫颈及盆腔复发合并肾、肾上腺、胰腺及肝被膜转移,1例腹膜后淋巴结转移,1例多发骨转移,2例肺转移。RapidArc组及3D-CRT组的1年PFS分别为94.4%与92.0%(P=0.89),见表2及图1。
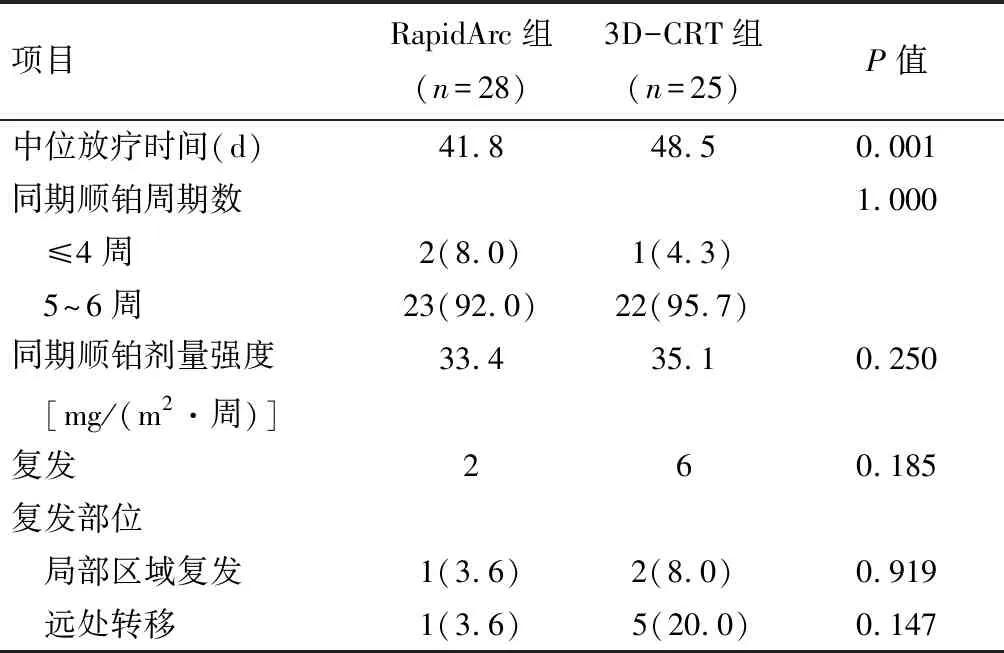
表2 治疗结果 例(%)

图1 患者PFS曲线
2.3 急性毒性不良反应 RapidArc组3~4级贫血发生率高于3D-CRT组(P=0.045),其他血液学毒性不良反应两组间没有差别。两组中各1例患者出现3级腹泻,没有3级及以上泌尿系毒性不良反应,没有治疗相关的死亡。见表3。
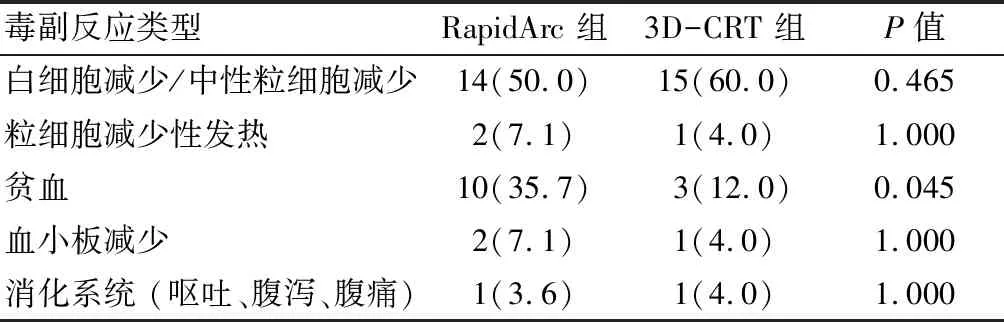
表3 3~4级急性毒副反应 例(%)
3 讨论
根治性同步放化疗(体外照射联合腔内近距离放疗+同期顺铂每周方案化疗)是失去手术机会或拒绝手术的宫颈癌患者的标准治疗模式[2]。随着计算机及影像学的进步,体外照射放疗已从二维放疗技术向精确化、个体化的方向发展,先后出现了3D-CRT、IMRT、RapidArc等精确放疗技术。对于腔内近距离放疗,影像引导的自适应近距离放疗(Image Guided Adaptive Brachytherapy, IGABT)已逐渐取代二维模式成为宫颈癌后装放疗的标准模式[8-10]。本研究中的两组患者均采用相同的顺铂每周方案同期化疗及CT引导下三维腔内近距离放疗,仅体外照射方式不同(Rapidarc或3D-CRT),比较发现Rapidarc组的外照射放疗时间明显比3D-CRT短(P=0.019),Rapidarc组治疗期间的贫血发生率更高(P=0.045),其他治疗结果及治疗耐受性方面(同期顺铂化疗的周期数及剂量强度,1年PFS,除贫血外的其他急性毒性不良反应)均无明显差异。
与3D-CRT相比,Rapidarc技术可进行同步加量,使患者外照射放疗时间缩短,最大程度上避免了放疗时间延长,也可以提高医疗资源的利用率。研究表明放疗时间延长对宫颈癌的预后有不良影响,放疗时间超过6~8周可能导致盆腔局部控制率降低[11],本研究中Rapidarc组的外照射放疗时间明显比3D-CRT短,但是两组患者的1年PFS无明显差异,Rapidarc放疗时间的优势没有转换为PFS的优势。可能的原因是:(1)两组患者均从外照射开始后第4~5周开始后装放疗,两组患者的总治疗时间无差异(P=0.458),因此单纯外照射时间缩短可能不能改善预后。(2)影响宫颈癌治疗结果的因素是多方面的,如肿瘤分期、病理类型等,甚至患者白细胞、血红蛋白都可能影响预后[12-13],单纯放疗时间的优势并不足以转换为PFS的优势。(3)RapidArc等精确放疗技术虽然有更高的适形性,但宫颈癌在放疗过程中靶区体积及位置均有变化[14],国内外不少研究也表明与三维适形放疗相比,调强放疗并不能明显改善患者的生存时间[4, 15]。(4)本研究病例数较少,随访时间短,也需进一步随访评估两组患者远期生存是否有差异。
目前的研究表明IMRT较3D-CRT能更有效地降低危及器官的剂量,减少放疗反应、提高患者生活质量[3-4]。RapidArc作为IMRT放疗技术的一种,与常规IMRT相比,RapidArc能减少直肠膀胱等危及器官的照射剂量[16-17],因而能更好地保护正常组织[18]。然而本研究中RapidArc组治疗期间的3~4级贫血发生率高于3D-CRT组,其他急性毒性不良反应并无差异。这可能是因为本研究中RapidArc组患者治疗前的血红蛋白水平明显低于3D-CRT组(P=0.025),因此Rapidarc组放疗期间的贫血反应更严重;同时贫血也可能降低宫颈癌患者的治疗耐受性[19],使Rapidarc技术在降低不良反应方面的优势被抵消。本研究中观察到的≥3级消化道及泌尿系反应均很低(<5%),因此两组间不能体现出差异,需继续随访评估两组间晚期不良反应是否有差异。然而,关于血液学毒性,也有研究与我们的结论相一致[15,20]。在Isohashi等[15]的研究中,与3D-CRT相比,IMRT组≥3级的血液学毒性更重 (63%vs38%,P<0.05);该研究中调强放疗组的骨盆V40比3D-CRT组明显增加,但是骨盆DVH(剂量体积直方图)值与急性血液学毒性无相关性。在Erpolat等[20]的研究中,虽然IMRT较3D-CRT降低了骨髓照射的体积,但是两者的急性及慢性血液学毒性均没有区别。目前并未见Rapidarc与3D-CRT在宫颈癌根治性放化疗中直接比较的数据。尚需更多的临床研究去探索宫颈癌根治性放疗中骨髓照射剂量及体积与骨髓抑制方面的关系。
本研究虽为对比性研究,但是非随机对照研究,两组患者的基线资料不均衡,Rapidarc组贫血患者更多,导致对治疗结果的比较困难。其次,随访时间较短,不能评估两组患者的长期生存及晚期毒性不良反应。另外,本研究只进行了临床资料方面的比较,我们将会在后续的研究中进行详细的物理剂量学方面的探讨。
根据目前本研究的观察结果,RapidArc与3D-CRT外照射根治性治疗宫颈癌疗效相当,毒性不良反应均可耐受,患者接受的同期顺铂剂量强度没有差别;RapidArc外照射治疗时间缩短,但治疗计划更复杂,各治疗中心可根据自身的条件设施及技术优势合理选择宫颈癌根治性外照射治疗技术。此外,需要前瞻性的随机对照研究进一步比较不同的外照射技术在宫颈癌根治性放疗中的应用。

