农杆菌介导花生胚小叶遗传转化体系的优化研究

摘 要:花生是我国重要的油料作物和经济作物,但较低的遗传转化效率阻碍了花生基因工程的发展。因此,建立高效的花生转化体系是目前的研究热点之一。基于教育部华北作物种质资源研究与利用重点实验室建立的花生胚小叶高效再生体系,本研究对农杆菌介导的遗传转化过程中菌液浓度、侵染时间及共培养时间对抗性丛生芽效率的影响进行探讨,旨在优化遗传转化条件,提高花生转基因的遗传转化效率。结果表明,3个因素均对抗丛生芽诱导率有显著影响,其诱导效应是共培养时间>侵染时间>菌液OD值。根据研究得到农杆菌介导花生胚小叶转化的最佳条件是菌液OD值0.5、侵染时间25 min、共培养时间3 d。
关键词:花生胚小叶;农杆菌介导;遗传转化
花生(Arachishypogaea L.)又称落花生,是世界上重要的经济作物及油料作物[1]。我国花生的总产量居世界首位,在国内油料作物中,花生价格高,单位面积收益好,对农民的增收作用大。近年来,花生生产极易受到生物和非生物逆境的影响,使得花生产量和品种质量极其不稳定[2]。栽培种花生缺少逆境抗源以及栽培种与野生种杂交不亲和,使花生常规抗性育种受到了限制[3]。随着植物转基因技术的应用和分子生物学的发展,人为地将有益目的基因定向转移到农作物中以提高其抗性、改良其品质成为可能,也为花生的品种改良提供了有效手段[4]。因此,开展花生转基因育种具有重要的现实意义。
农杆菌介导法是现在作物改良中最常用的方法。影响农杆菌介导花生遗传转化率的主要因素有菌液浓度、侵染时间、共培养时间、基因型等。首先,适宜的菌液浓度在花生的遗传转化中的作用是很关键的,转化时菌液浓度过高会造成死菌数目较多,褐化现象严重,并且还会给后期的杀菌工作带来很大麻烦,影响转化效率,但浓度过低也会影响转化效率[4]。刘风珍[5]以花生胚小叶为外植体用于组织培养离体再生和农杆菌介导的基因转化,结果表明菌液浓度以OD600为0.65时转化效率最高。其次,侵染时间对农杆菌转化效率有直接影响。单世华等[6]分别以5、10、15、30 min和60 min对花生丛生芽进行侵染,结果表明侵染时间以5~15 min
较好,侵染时间过长不利于提高转化效率。李春娟等[7]研究发现外植体不同,适宜的侵染时间也不同,以花生胚小叶为侵染对象,侵染时间为20 min较为有利。基因型不同,最佳侵染时间也不同。最后,共培养时间也是影响农杆菌介导的重要因素。共培养时间过短,转化率较低,随着共培养时间的延长,转化率会升高,但共培养时间过长时,农杆菌会过度繁殖,造成细胞遭受毒害而死亡,从而降低转化率。孙显明等[8]研究共培养时间为1、2、3、4 d的转化效果,结果表明,幼叶外植体与农杆菌共培养3 d转化效率较高。因此,有必要进一步探索和完善高频率植株再生体系,并能广泛应用于不同基因型的研究[9]。
本研究利用3个花生栽培品种为材料,以花生胚小叶为受体外植体,以抗性丛生芽为转化指标,采用正交设计筛选农杆菌介导转化的最佳条件,探究不同转化影响因素,以期建立高效、稳定的转化体系。
一、材料与方法
(一)材料及培养基
供试材料为花生品种麻油1-1、弗落蔓生和濮花23,以上品种在教育部华北作物种质资源研究与利用重点实验室种质资源库中均有保存。试验所用培养基有基本培养基、丛生芽诱导培养基,参考马彩霞等[10]的研究。
(二)试验方法
1.种子处理
将成熟荚果去果皮,先后浸于75%酒精中1 min、0.1%HgCl2溶液中10 min,进行表面消毒,再用无菌水漂洗四五次,剥去种皮,浸泡于无菌水中7 h,备用。
2.无菌胚小叶外植体的培养制备
用处理好的花生剥取胚小叶外植体,将其接种于萌发培养基上培养。选取培养8 d的胚小叶外植体备用。
3.正交试验转化条件和试验设计
转化条件选用菌液OD值(0.3、0.5、0.7、0.9)、侵染时间(15、20、25、
30 min)和共培养时间(2、3、4、5 d)3个因素进行试验,每个因素4个水平,选用L9(43)正交表设计试验,每个处理100个外植体,进行2次重复。
4.农杆菌侵染和共培养
测定、调节农杆菌菌液至所需OD值,处理侵染生长一致的胚小叶不同时间。丢弃菌液,将侵染的外植体放在灭菌过的滤纸上,将其表面菌液吸干。然后将胚小叶转接在不含抗生素的铺有滤纸的共培养基上。将共培养后的胚小叶外植体用灭菌水冲洗一两次后用灭菌滤纸吸去其表面水分,然后将干燥的胚小叶分别培养于含有抗生素Kan 0 、50、100、150 mg/L和200 mg/L的丛生芽组织诱导培养基中[11]。培养30 d,15 d继代一次调查转化率。
5.转基因花生的PCR检测
采用CTAB法提取花生总基因组DNA[12],根据Bar基因序列进行PCR,琼脂糖凝胶电泳检测是否转入目的基因。
6.试验数据统计
抗性转化率/%=(抗性丛生芽数/接种总外植体数)×100
二、结果与分析
(一)正交试验结果分析
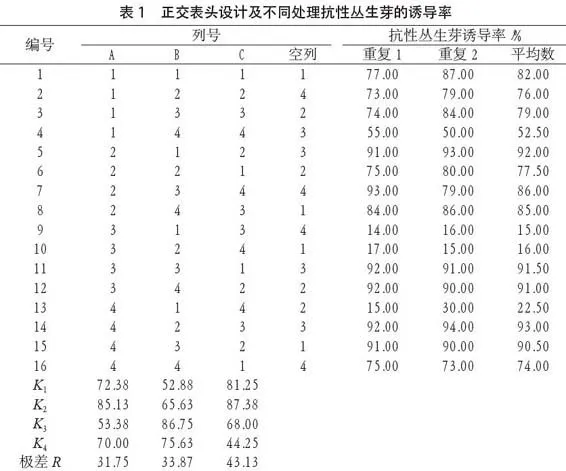
表1试验结果表明,不同的处理条件都会对丛生芽率产生影响,随着各因素的水平不同发生变动。菌液OD值为0.5时,抗性丛生芽的诱导率最高,达到85.13%。菌液浸染时间由15 min延长至25 min,抗性丛生芽的诱导率明显提高,进一步延长侵染时间,则会降低抗性丛生芽的诱导率。共培养时间为3 d
时,抗性丛生芽的诱导率最高,达到87.38%,然而随着共培养时间的延长,抗性丛生芽的诱导率逐渐降低。试验结果表明,3个因素在抗性丛生芽的诱导效果为共培养时间>侵染时间>菌液OD值,其中因素A以A2为最佳,因素B以B3为最佳,因素C以C2为最佳。总结起来,A2B3C2为诱导抗性丛生芽的最佳组合,即共培养时间为3 d,侵染时间为25 min,菌液OD值为0.5。
(二)农杆菌侵染正交试验结果方差分析
由于极差分析无法分析试验的精度,为了准确判断各因素对试验的影响是否显著,笔者进一步对试验结果进行方差分析,结果见表2。
方差分析结果表明,3个因素对抗性丛生芽的诱导率有显著影响。在不同OD值的菌液处理中,A2(0.5)、A4(0.9)和A1(0.3)之间无极显著差异,但A2(0.5)与A3(0.7)之间具有极显著差异,表明菌液OD值为0.5时,抗性组织转化率高。不同侵染时间的处理中,B1(15 min)和
B2(20 min)、B3(25 min)和B4(30 min)
之间均无极显著差异,而B1(15 min)与B3(25 min)之间有极显著差异,表明侵染时间为25 min时,转化效率最高。不同共培养时间处理中,C1(2 d)、
C2(3 d)和C3(4 d)之间无显著差异,C3(4 d)和C4(5 d)之间有显著差异,C1(2 d)和C2(3 d)均与C4(5 d)之间存在极显著差异,表明农杆菌生长的最适共培养时间3 d是转化的最佳共培养时间。
方差分析多重比较结果说明,3个因素的最佳水平组合为A2B3C2,即菌液OD值0.5、侵染时间25 min和共培养时间3 d。
注:大写和小写字母分别代表不同水平均值在1%和5%水平差异显著。
三、讨论
花生遗传转化过程中影响其转化效率的因素有很多,如外植体预培养时间、菌液浓度、侵染时间、共培养时间等,合理调整因素之间的相互联系是花生遗传转化成功的关键。
贾宇臣等[13]研究利用农杆菌介导法,以子叶节为外植体对转化的诸多因素进行了优化,结果表明,侵染菌液中添加100 μmol AS结合菌液,浸染时间为
10 min,共培养时间3 d,延后选择2 w,为最佳的转化条件。邱金梅等[14]利用农杆菌EHA105菌株侵染花生胚轴外植体,结果表明,以侵染菌液浓度OD600=0.7效果最好,外植体在真空中侵染10 min较好,共培养3 d后进行2次侵染最好。
以上试验研究均为单因素试验,本试验应用正交设计进行农杆菌介导的花生转化因素研究,设置菌液浓度、侵染时间和共培养时间3因素4水平,对转化条件进行系统性研究,通过对数据的直观分析和方差分析,确立了主要影响因子,并对试验因素影响效果进行了综合评价,从而确立了侵染的最佳组合,克服了农杆菌转化浸染过程中的盲目性,提高了工作效率和试验的准确性。研究结果表明,侵染的菌液浓度太高,侵染时间过长,会造成农杆菌难以抑制,增大组织细胞的受损程度,但是如果菌液浓度太低和侵染时间较短,农杆菌与受体的融合不足,会造成转化效率降低。试验结果中发现共培养时间是3个因素中影响效果最大的因子,但对于不同作物,不同研究者所得到的共培养时间不同。本试验综合考虑几个因素,最终得到的组合为菌液浓度为OD值0.5,侵染时间为25 min,共培养时间为3 d。(基金项目:国家自然科学基金,项目编号:31471523;大学生创新创业训练计划项目,项目编号:20180409;农林创新试验园建设及双创教育实践,项目编号:2017cxcy034;国家自然科学基金面上项目,项目编号:31771833)
参考文献:
[1]魏丽奇,邵凤霞,单雷.花生转基因研究进展[J].中国生物工程杂志,2008(10):24-129.
[2]杨克相,唐容,吕建伟,等.花生组织培养研究进展[J].农技服务,2018(1):69-70.
[3]张铙丹,何龙飞.花生组织培养及遗传转化研究进展[J].安徽农业科学,2015(11):27-29.
[4]苗利娟,黄冰艳,张新友,等.花生组培再生及农杆菌介导遗传转化研究进展[J].中国农学通报,2017(32):15-20.
[5]刘风珍.Rs-afp1基因和γ-tmt基因转化花生及高效遗传转化体系的研究[D].济南:山东农业大学,2004.
[6]单世华,李春娟,刘思衡,等.以农杆菌为介导花生遗传转化研究[J].中国油料作物学报,2003(1):11-15.
[7]李春娟,万书波,许婷婷,等.花生遗传转化影响因素研究[J].花生学报,2004(4):20-25.
[8]孙显明,王强,于立芝,等.影响农杆菌介导的花生遗传转化条件的研究[J].中国农学通报,2008(7):218-220.
[9]隋炯明,乔利仙,赵明霞,等.不同基因型对花生胚小叶植株再生的影响[J].中国农学通报,2012(27):45-48.
[10]马彩霞,穆国俊,侯名语,等.一种快速、高效花生植株再生植株的建立[J].植物生理学报,2013(12):1333-1338.
[11]王凤欢,何美敬,杨鑫雷,等.花生胚小叶对卡那霉素的敏感性研究[J].花生学报,2016(2):15-20.
[12]崔顺立.河北省花生(Arachishypogaea L.)地方品种遗传多样性研究[D].保定:河北农业大学,2010.
[13]贾宇臣,王利,陈琦,等.花生子叶节外植体遗传转化体系的建立[J].科学技术与工程, 2011(14):3142-3146.
[14]邱金梅,温世杰,刘海燕,等.根癌农杆菌介导花生高效遗传转化体系的优化[J].中国油料作物学报,2010(2):208-211.

