两种邻苯二胺类席夫碱缓蚀剂缓蚀性能研究
任正博,卢 爽,刘 琳
(渤海大学化学化工学院,功能化合物的合成及应用辽宁省重点实验室,辽宁锦州121013)
海水是一种含有多种盐类的电解质溶液,以质量分数3.0%~3.5%的NaCl为主盐,p H在8左右,并溶有一定量的氧气,大部分金属材料在海水中都存在氧去极化腐蚀[1],又由于海水中含有大量的氯离子,使金属在海水中的腐蚀速率大大增加。金属结构部件腐蚀使材料变薄,强度降低,甚至发生局部穿孔或断裂,使结构破坏,造成事故。铜及铜合金具有良好的机械加工性能及抗海洋生物附着的能力,使其在海洋工程中得到了广泛的应用[2⁃4]。为了提高铜在恶劣环境下使用的抗腐蚀性,降低腐蚀的危害性,科研人员在铜的防腐方面进行了大量的研究。传统缓蚀剂如铬酸盐、磷酸盐类钝化膜型缓蚀剂毒性高,对环境污染严重,而有机金属缓蚀剂因其用量少、毒性低、环保等优点已成为当今热门的金属防腐手段之一[5⁃9]。席夫碱中含有亚胺特性基团(—RC=N—),可提供孤对电子,同时也可以引入杂原子基团,极易与金属配合,形成结构稳定的配合物[10⁃14],且形成的配合物具有良好的抑菌杀菌性能,大大提高了应用前景。本研究以邻苯二胺、水杨醛和邻香兰素为原料,合成了两种席夫碱类化合物(A和B),并在铜电极表面自组装成膜。以质量分数3.5%的NaCl溶液为电解液模拟海水介质,通过电化学测试研究了两种自组装单分子膜在NaCl溶液中对铜的缓蚀性能。
1 实验部分
1.1 实验仪器
电化学工作站(PGSTAT 302N,瑞士万通中国有限公司);傅里叶变换红外光谱仪(Scimitar 2000,美国安捷伦公司);液相色谱⁃质谱联用仪(1100SeriseLC/MSD,美国安捷伦公司);视频光学接触角测量仪(OCA 15EC,德国dataphysics仪器股份公司);金相显微镜(4XC,上海光学仪器五厂有限公司)。
1.2 实验试剂
邻苯二胺、水杨醛、邻香兰素、无水乙醇、NaCl均为市售分析纯试剂。
1.3 电化学测量
电化学测量采用三电极体系,工作电极为直径4 mm用聚醚醚酮封装的铜电极,参比电极为饱和甘汞电极,辅助电极为铂电极。电化学测试在25℃下,电解液在质量分数3.5%的中性NaCl水溶液中进行。先将席夫碱⁃乙醇溶液处理后的铜电极在NaCl溶液中浸泡,待开路电位稳定后,进行后续电化学测试。其中,电化学交流阻抗测试的频率为100 kHz~0.01 Hz,正弦信号振幅为10 mV;极化曲线扫描速率为0.5 mV/s,阴阳极分别极化150 mV,并从低电位向高电位方向扫描。
1.4 铜表面自组装膜的制备
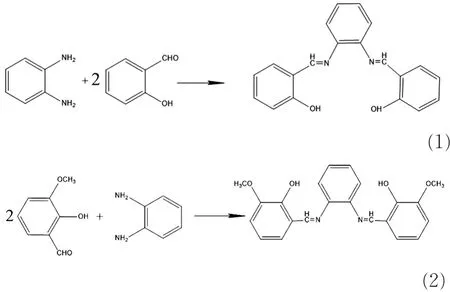
1.4.1 目标化合物的合成与表征 席夫碱A(双水杨醛缩邻苯二胺)的合成。称取定量的邻苯二胺,用无水乙醇溶解,加入水杨醛的乙醇溶液,升温搅拌回流反应4 h,冷却结晶得到粗产品。将粗产品用无水乙醇重结晶,得到产品(席夫碱A)。席夫碱B的合成方法同上。合成化合物A、B反应方程式见式(1)、(2)。两种化合物的红外光谱和质谱分析数据如下:1 620 cm-1处均出现较强的νC=N伸缩振动吸收峰;3 440 cm-1附近为宽而弱的酚羟基νOH的伸缩振动吸收带;1 276.9 cm-1为 νPh—O的伸缩振动吸收峰;1 253.7 cm-1为苯环上甲氧基强的 νC—O伸缩振动吸收峰。质谱中,席夫碱A的M+1值为317,席夫碱B的M+1值为377。
1.4.2 铜电极表面自组装膜的制备 将铜电极打磨清洗,除去表面的氧化层及污物,将处理好的铜电极放入不同浓度的席夫碱⁃乙醇溶液中,静置一段时间后取出,洗去多余的席夫碱溶液,备用。
2 结果与讨论
2.1 不同组装条件对缓蚀性能的影响
2.1.1 组装时间的影响 图1为铜电极在10 mmol/L组装液中组装不同时间后在质量分数3.5%NaCl溶液中的电化学阻抗复平面图。
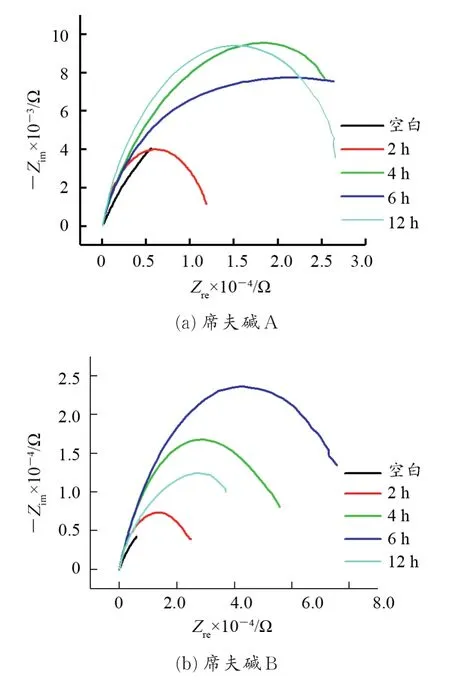
图1 铜电极在NaCl溶液中的电化学阻抗复平面图Fig.1 Nyquist plots obtained in NaCl solution for the bare copper and the modified copper electrodes
从图1(a)可以看出,未成膜的铜电极有两个时间常数,分别为高频区的容抗弧和中低频段War⁃burg阻抗直线,而中低频的Warburg阻抗直线对应着电极表面的扩散过程,成膜2 h的铜电极在低频时在复平面图中没有Warburg阻抗直线代表的扩散过程,且阻抗值明显高于同频率下的裸铜电极,说明铜电极表面在组装液中2 h时已经初步形成致密且稳定的膜;因为电化学阻抗谱出现“退化”现象[15],故成膜4、6、12 h的铜电极在复平面图上只有一个简单的容抗弧。容抗弧直径越大,传荷电阻越大,传荷过程越困难,腐蚀速率越小,缓蚀效率越高[16⁃17]。
图2为铜电极在质量分数3.5%的NaCl溶液中的等效电路图。通过图2所示的等效电路图对裸铜电极和组装有席夫碱膜的复平面图进行拟合,拟合参数列于表1。其中,Rs代表溶液电阻;Rct代表电子通过单层膜的电荷转移电阻;CPE代表描述双电层性质的常相位元件,其中N称为弥散系数,Y’0为描述Warburg阻抗特征的参数。
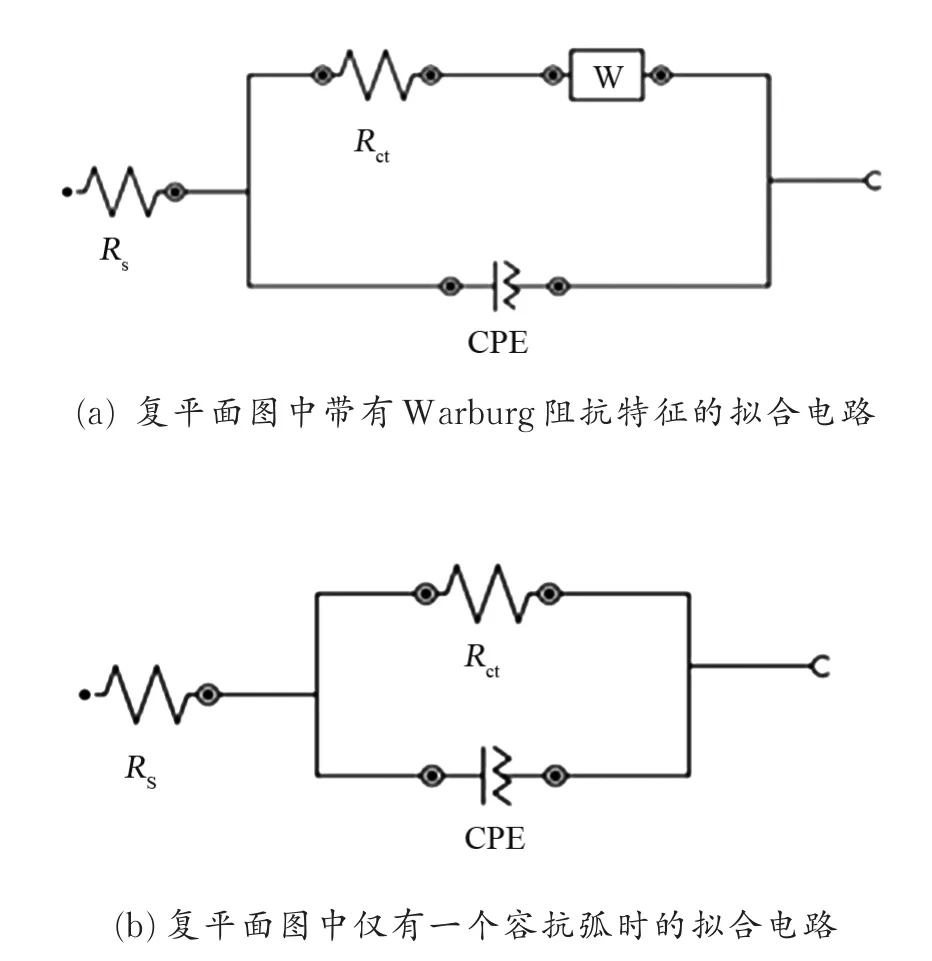
图2 铜电极在NaCl溶液中的等效电路图Fig.2 Equivalent circuits of copper electrodes in NaCl solution
从表1可以看出,随着成膜时间的增加,Rct逐渐增大,表明电荷传递电阻增大,抑制铜腐蚀的程度增加。对于席夫碱A,当组装时间为4 h时,Rct数值最大,表明此时的缓蚀效果最佳,因此,席夫碱A的最佳组装时间为4 h;对于席夫碱B,随着组装时间的增加,Rct的值也随之增加,当组装时间为6 h时,Rct值最大,表明此时的缓蚀效果最佳,因此,席夫碱B的最佳组装时间为6 h。
图3为25℃下,裸铜电极和不同时间下组装席夫碱膜的铜电极在质量分数3.5%NaCl溶液中的电化学极化曲线。
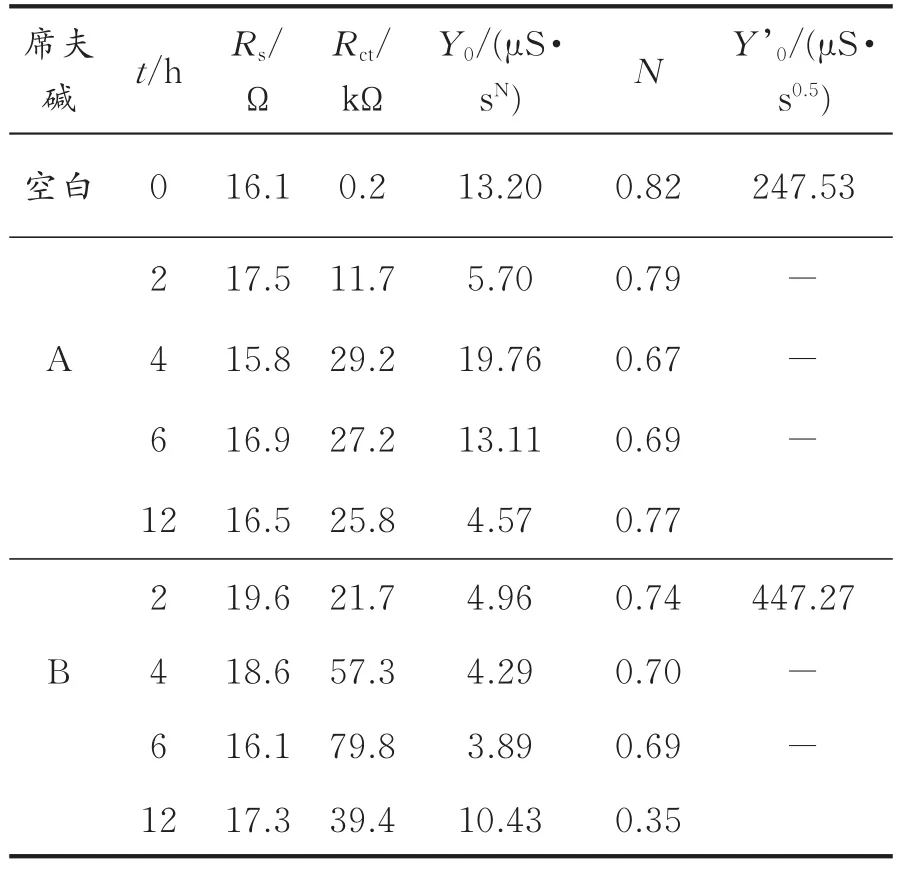
表1 铜电极在NaCl溶液中不同组装时间的电化学阻抗谱拟合参数Table 1 Fitted par ameters of EIS spectra obtained in NaCl solution for the bare copper and the modified copper electrodes covered with doped film after differ ent assembly times

图3 铜电极在组装不同时间后的极化曲线Fig.3 Potentiodynamic polarization curves of the bare copper and the modified copper electrodes covered after different assembly times
从图3可以看出,在席夫碱A(B)溶液中经不同时间组装后的铜电极在NaCl溶液中的自腐蚀电位Ecorr均升高,自腐蚀电流均下降,说明席夫碱对铜在NaCl溶液中具有缓蚀作用。
电化学极化曲线分析拟合参数及缓蚀效率见表2。从表2中可以看出,最初随着时间的增加,经A、B修饰后的铜电极在盐水中缓蚀效率均增大。对于席夫碱A,当组装时间为4 h时,缓蚀效果最佳。再延长组装时间,缓蚀效率反而降低,表明4 h时自组装基本完成,继续增加组装时间,由于空间位阻效应或缓蚀剂自身团聚使膜质量下降,缓蚀效率降低,这可能是因组装完毕,缓蚀剂在铜电极表面吸附饱和,发生扰动吸附,造成局部脱附;对于席夫碱B,当组装时间为6 h时,缓蚀效果最佳,继续增加成膜时间,缓蚀效率亦降低。电化学极化曲线得出的结论与电化学阻抗得出的结论一致。极化曲线缓蚀效率η通过式(3)计算:
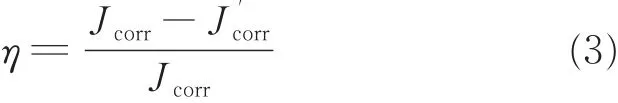
式中,Jcorr和J′corr分别为金属未经缓蚀剂处理和经缓蚀剂处理后在质量分数3.5%NaCl溶液中的腐蚀电流密度。
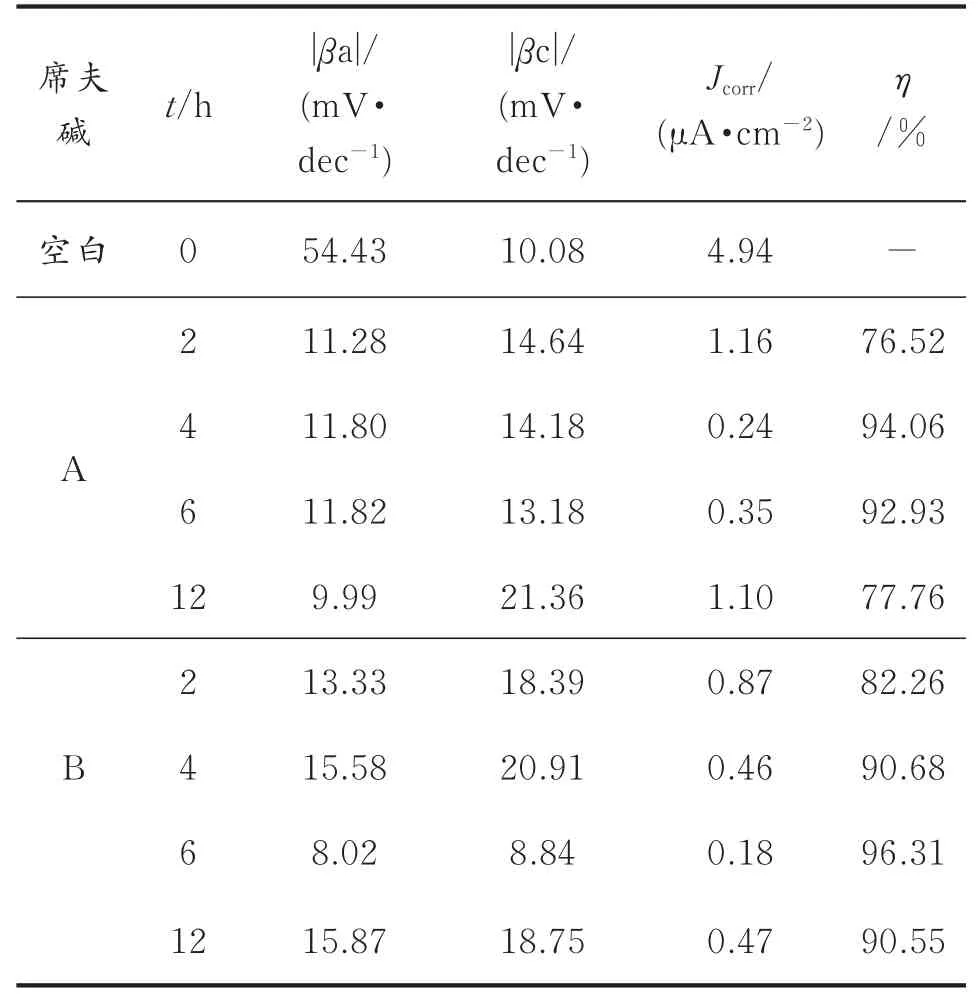
表2 不同铜电极的电化学极化曲线参数Table 2 Polarization cur ves r esults for the bare copper and the modified copper electrodes
2.1.2 组装浓度的影响 图4为25℃下,铜电极在不同浓度组装液中组装6 h的复平面图。表3为不同浓度席夫碱的交流阻抗谱拟合参数。
从图4中可以看出,经不同浓度组装后的铜电极的容抗弧直径随浓度的增加而增大;相同条件下席夫碱A处理后的铜电极较席夫碱B处理后的铜电极更容易出现具有扩散控制特征的Warburg阻抗直线,表明席夫碱A在铜表面吸附较席夫碱B困难,且致密度、稳定性较席夫碱B差。
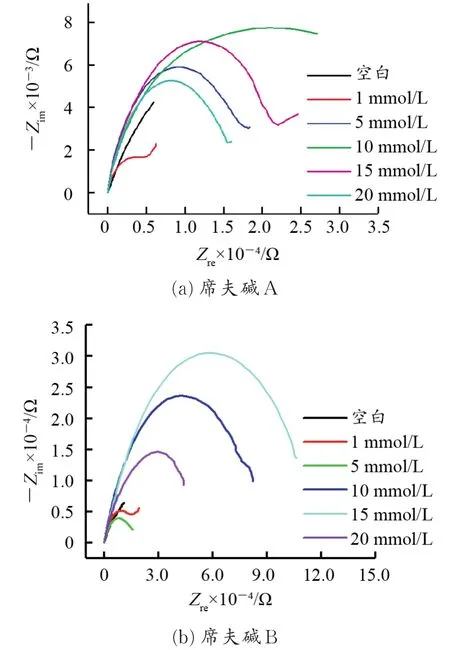
图4 铜电极在不同浓度席夫碱溶液中组装6 h的复平面图Fig.4 Nyquist plots for the bare copper and the modi⁃fied copper electrodes after 6 h of assembly in different concentrations Schiff bases solution
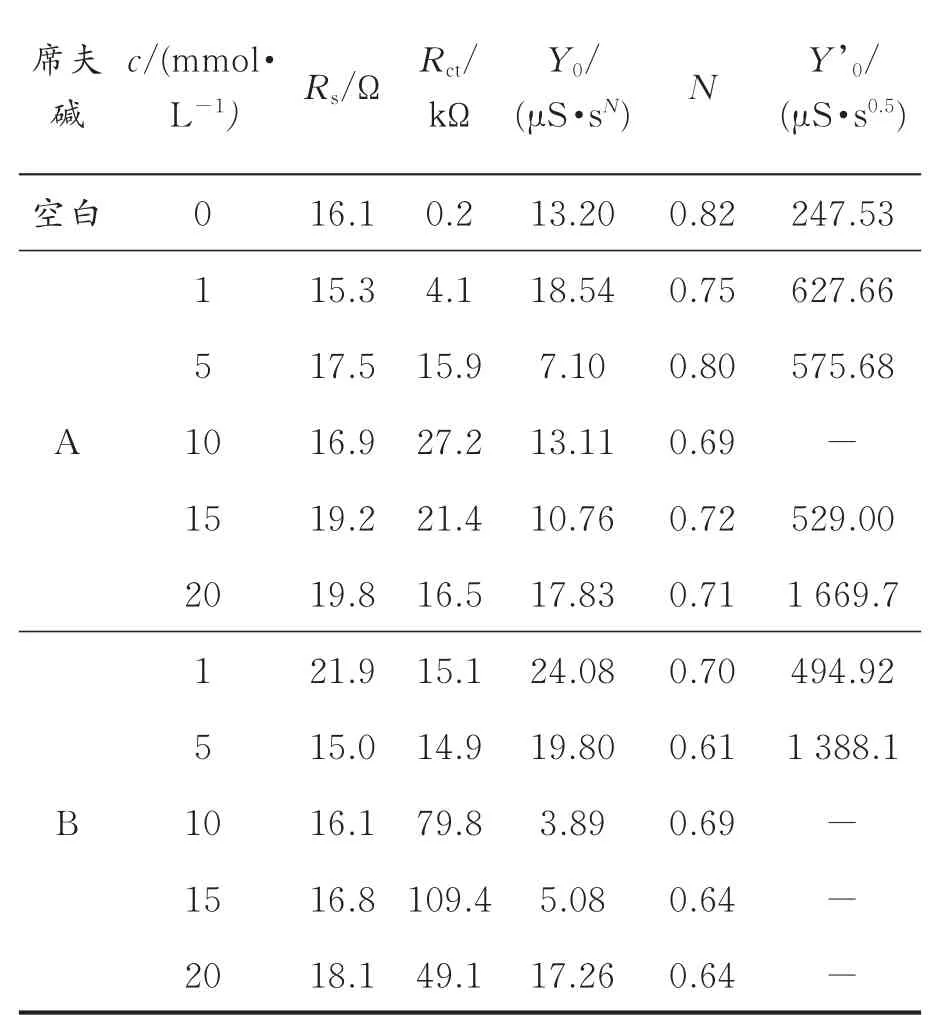
表3 不同浓度席夫碱的交流阻抗谱拟合参数Table 3 Fitted parameters of EISspectra for the bare copper and the modified copper electrodes covered with doped film in different concentr ations of Schiff bases
由表3可以看出,对于席夫碱A,随着席夫碱溶液的浓度增加,Rct逐渐增大,表明抑制铜腐蚀的程度增加,当浓度为10 mmol/L时,Rct数值最大,缓蚀效果最佳,再增加组装液溶液浓度,Rct数值下降。这可能是由于扰动作用及分子间作用力影响,导致膜局部脱附,降低了缓蚀性能;对于席夫碱B,随着B浓度增加,Rct逐渐增大,当浓度为15 mmol/L时,Rct数值最大,缓蚀效果最佳,继续增加组装液浓度,Rct数值下降。因此,对于席夫碱A最佳组装浓度为10 mmol/L;对于席夫碱B,最佳组装浓度为15 mmol/L。
图5为裸铜电极和不同浓度席夫碱处理过的铜电极在质量分数3.5%NaCl溶液中的电化学极化曲线。组装液浓度为 1、5、10、15、20 mmol/L,组装时间均为6 h。从图5中可以看出,不同浓度席夫碱A(B)处理后的铜电极在NaCl溶液中的自腐蚀电位Ecorr均升高;自腐蚀电流均下降,说明席夫碱对铜在NaCl溶液中具有缓蚀作用。
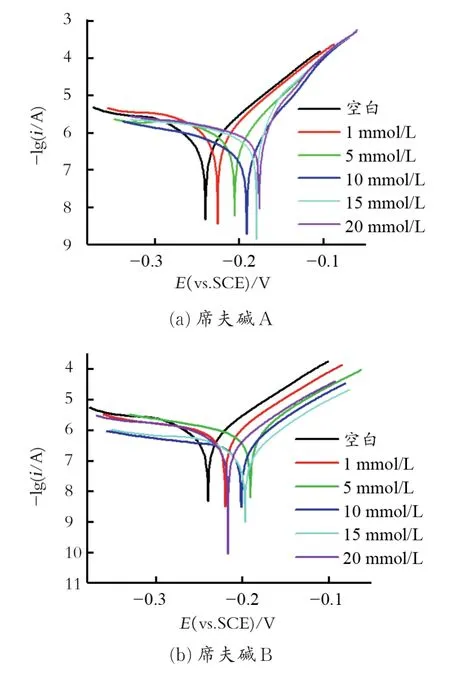
图5 铜电极在不同浓度席夫碱溶液中组装6 h的极化曲线Fig.5 Potentiodynamic polar ization curves for the bare copper and the modified copper electr odes after 6 h of assembly in different concentr ations Schiff bases solution
电化学极化曲线分析拟合参数及缓蚀效率见表4。从表4中可以看出,最初随着时间的增加,经A、B修饰后的铜电极在盐水中缓蚀效率均增大。对于A当缓蚀剂浓度为10 mmol/L时缓蚀效果最佳,缓蚀效率达92.93%,再增加浓度缓蚀效率反而下降,因而浓度过大而加剧了空间位阻效应和分子之间作用力,使得成膜质量下降,故最佳组装浓度为10 mmol/L。对于B浓度为15 mmol/L时,缓蚀效率最高,达到96.62%。这与电化学阻抗得出的结论相同。
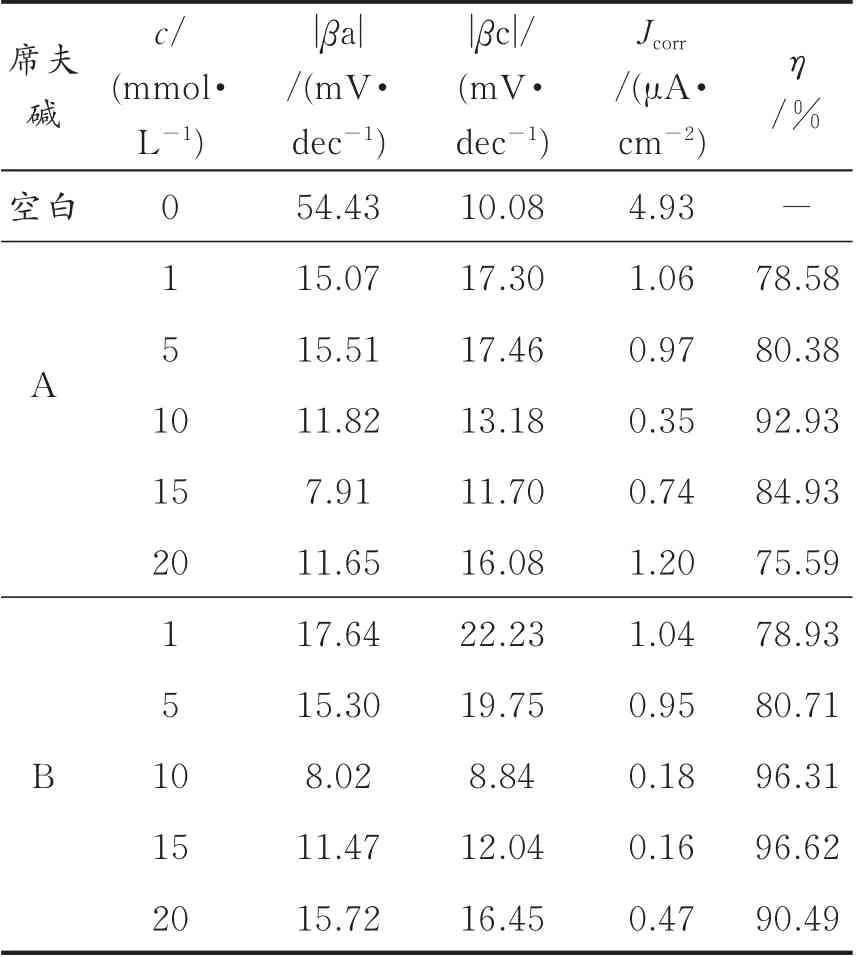
表4 铜电极在不同浓度席夫碱溶液中组装6 h的电化学参数Table 4 Polarization curves results for the bare copper and the modified copper electr odes after 6 h of assembly indifferent concentrations Schiff bases solution
2.2 表面分析
图6为裸铜以及按最优组装条件自组装成膜的铜试片对质量分数3.5%NaCl溶液的接触角。
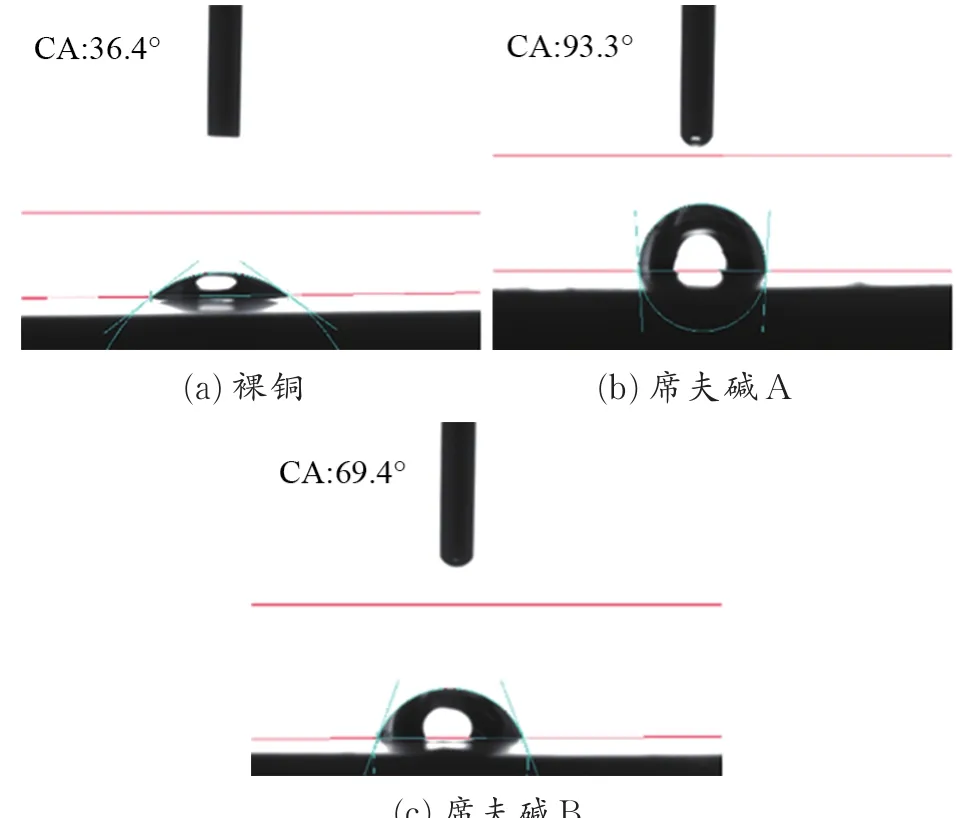
图6 铜试片对NaCl溶液的接触角Fig.6 Contact angle images to NaCl solution of copper specimen
图 6(a)、(b)和(c)分别为裸铜、席夫碱 A处理后和席夫碱B处理后的铜试片对NaCl溶液的接触角。测试结果表明,裸铜的接触角为36.4°,席夫碱A处理后的铜试片接触角为93.3°,席夫碱B处理后的铜试片接触角为69.4°,可以看出,经席夫碱自组装后,接触角相对于裸铜明显提高,疏水性增强。
图7为裸铜以及按最优组装条件自组装成膜的铜试片在质量分数3.5%NaCl溶液中浸泡12 h的金相显微镜图像。从图7可以看出,打磨后的裸铜在NaCl溶液中浸泡后腐蚀严重,可以明显地观察到大量腐蚀产物及腐蚀坑,而经席夫碱处理后的铜试片腐蚀程度明显小于裸铜片,几乎没有腐蚀坑,经席夫碱B处理后的铜试片没有腐蚀产物,说明席夫碱化合物有明显的缓蚀作用,且席夫碱B的缓蚀性优于席夫碱A,这与电化学测试分析结果相一致。这可能是由于共轭效应,甲氧基向苯环供电,苯环电子云密度增加,而席夫碱中的亚氨基团与苯环生成离域π键体系,使得亚氨基中氮原子上电子云密度增加,更容易与铜配位,形成的配合物结构也更稳定。

图7 铜试片经NaCl溶液浸泡后的金相照片Fig.7 Metallograph of copper specimens dipped in NaCl solution
3 结 论
席夫碱A、B自组装膜对铜具有良好的缓蚀作用,电化学阻测试结果表明,席夫碱A自组装膜最佳组装条件为:25℃下,10 mmol/L组装液中组装4 h;席夫碱B自组装膜最佳组装条件为:25℃下,15 mmol/L组装液中组装6 h。A、B在各自最佳组装条件下的缓蚀效率分别为94.06%和96.62%。
对比两种席夫碱膜的电化学阻抗谱及电化学极化曲线,相同条件下,席夫碱B在铜电极成膜的稳定性要高于席夫碱A;席夫碱B处理的铜电极的自腐蚀电流密度也小于席夫碱A处理的铜电极。故席夫碱B比席夫碱A具有更高的稳定性和缓蚀性能。
比较铜试片成膜前后对质量分数3.5%NaCl溶液的接触角,成膜后的铜试片对盐水的接触角明显高于裸铜试片,说明成膜后铜表面疏水性增强,抗海水侵蚀的能力增强;通过观察铜试片成膜前后在质量分数3.5%NaCl溶液浸泡后的金相照片,可以看出席夫碱膜可以有效抑制铜在海水中的腐蚀,且席夫碱B的缓蚀效果明显好于席夫碱A。
综上所述,A和B席夫碱类化合物可以作为金属铜在盐水环境中的缓蚀剂,但在非常温环境下,多种腐蚀介质(如二氧化碳、硫化氢等)共存以及高流速盐水中的缓蚀性能还需进一步研究。

