大白猪FUT1和PRLR基因多态性与产仔性状的关联分析
谢 苏,孙晓梅,孙义姗,黄 涛
(石河子大学动物科技学院,新疆 石河子 832000)
对于生猪养殖行业来说,母猪产仔数是一个非常重要的繁殖性状,也是一个非常重要的经济性状,可以说产仔数直接影响到猪场经济效益的高低[1]。因此,提高母猪的产活仔数一直是动物科学研究和养猪生产的主要工作之一。而随着分子生物学技术的飞速发展,分子繁育理论已经成为了现代育种的主流方法。
FUT1基因定位于6号染色体[2],然而在这个染色体区域附近已经发现与猪产仔性状相关[3]。一直以来,FUT1基因作为F18大肠杆菌的一个抗性候选基因,与仔猪水肿病、腹泻等疾病相关,对繁殖性能造成很大的影响,故将其视为猪产仔数的一个候选基因[4]。
PRLR(催乳素受体基因)也是母猪繁殖性状上的一个候选基因,在动物生长发育过程中发挥着重要作用[5]。储明星[6]研究发现,当催乳素受体基因发生突变时会引起动物的生殖受阻以及繁殖功能障碍。Terman等[7]研究表明, PRLR不同的基因型对初产母猪的产仔数有显著差异。
试验对本地大白猪进行了研究,检测了大白猪FUT1和PRLR的基因多态性,并分析了其单个基因的基因型和合并基因型与猪繁殖性状之间的关系,目的是为母猪高产仔性状的分子标记辅助选择提供理论支撑,最终达到在实践生产中选育出繁殖性状更加优秀的猪群。
1 材料与方法
1.1 试验材料
试验所选用的909头大白母猪均来自新疆正大种猪场。采集耳组织样本,放入含有1 ml 75%酒精的Eppendoff管内,迅速装入冰盒带回实验室,并于-20℃保存,以备后续进行样本组织DNA的提取。此外还搜集整理了样本群体第二胎的总产仔数、总活仔数、窝重、健仔数、木乃伊胎、死胎等与繁殖性状相关的数据资料备用。
1.2 主要仪器和试剂
试验中使用的主要仪器与试剂如表1所示。
1.3 试验方法
1.3.1 DNA的提取
用DNA抽提试剂盒提取母猪耳组织样的基因组DNA,检测其浓度,保存于-20℃备用。
1.3.2 引物
利用NCBI和Primer 5.0选择FUT1与PRLR基因PCR扩增引物的引物序列,通过生工生物工程(上海)股份有限公司合成,引物序列信息见表2。

表1 主要仪器和试剂
1.3.3 PCR扩增
PCR 反应体系 25μL :2×Es Taq Master Mix 12.5μL,上、下游引物各0.5μL,模板 DNA 1 μL,去离子水10.5μL。
PCR反应条件:94℃变性4 min,35次循环(94℃,30 s;60℃/57℃,30 s;72℃,30 s),72℃延伸5 min。
1.3.4 RFLP酶切分型
PCR反应结束后进行酶切,酶切以后每个样取10μL进行电泳检测,若出现片段大小符合的明亮目的条带,方可进入下一步。
PRLR基因酶切反应:13μL PCR产物、0.5μL AluⅠ及1.5μL Buffer,37 ℃水浴 4 h,酶切反应后取酶切产物8μL用2.0 %的琼脂糖凝胶电泳检测分型。
FUT1基因酶切反应:8.5μL PCR 产物、0.5μL HhaⅠ和1μL Buffer,37℃水浴3 h,然后取酶切产物8μL用2.0%的琼脂糖电泳检测分型。
1.4 统计分析方法
图1 FUT1基因PCR产物检验
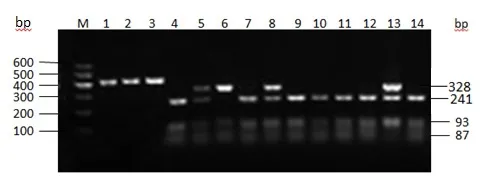
图2 FUT1基因PCR-RFLP电泳分型

图3 PRLR基因PCR产物检验
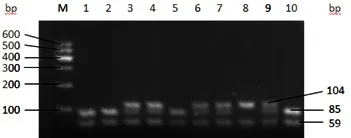
图4 PCR-PRLR基因电泳分型
用Excel表格计算基因频率等,并对基因型分布进行哈代温伯格平衡检验,用SPSS 19.0分析总活仔数、健仔数等繁殖性状在不同基因型之间的差异。
2 结果与分析
2.1 PCR-RFLP结果
FUT1:用限制性内切酶HhaⅠ将FUT1的PCR产物酶切,通过 2% 的琼脂糖凝胶电泳分型(见图1、图2)。
PRLR:用限制性内切酶 Alu Ⅰ将 PRLR 的 PCR 产物 酶 切, 通过 2% 的琼脂糖凝胶电泳分型(见图3、图 4)。
2.2 各基因频率、基因型频率及群体遗传特性
2.2.1 各基因型频率、基因频率
各基因型频率、基因频率如表3所示。
2.2.2 基因遗传特性
基因遗传特性结果如表4所示。
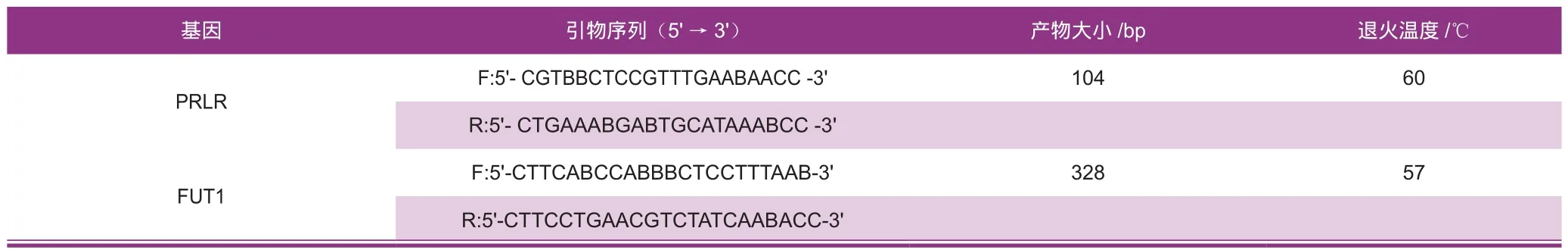
表2 引物设计
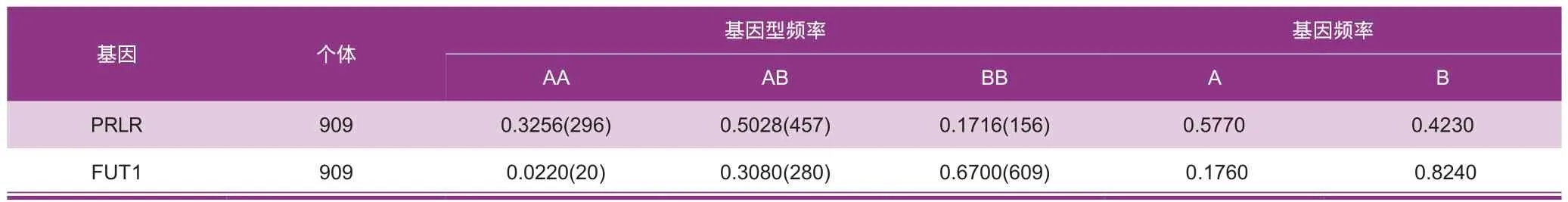
表3 PRLR和FUT1基因的基因型频率及等位基因频率

表4 基因多态信息含量(PIC)、杂合度(H)、有效等位基因数(Ne)及卡方检验(χ2)
2.3 基因多态性与猪繁殖性状的关联分析
2.3.1 单个基因多态性与猪繁殖性状的关联分析
对于PRLR基因,AA型个体窝重比BB型个体显著高出0.84 kg/胎(P<0.05),各基因型间其他繁殖性状上均无显著差异(表5)。对于FUT1基因,AA型个体死胎显著比BB型少0.31头/胎(P<0.05),AA型个体总活仔数比AB型个体高1.30头/胎(P<0.05),其他繁殖性状上各基因型间均无显著差异(表 5)。
2.3.2 合并基因型与猪繁殖性状的关联分析
在所检测的大白猪群PRLR与FUT1合并基因型中,在总活仔数性状上,BBAA型个体分别比BBAB型和BBBB型高出3.09头/胎(P<0.05)和3.04头/胎(P<0.05),BBAB与BBBB差异不显著;在木乃伊胎性状上,其他各基因型均少于BBAB型个体,并呈现这样的关系:其他基因型>ABAA>BBAA(P<0.01)(表6)。因此,在大白猪中PRLR-FUT1最优分子标记组合为BBAA。
3 讨论与结论
3.1 结果讨论
研究表明,FUT1基因有两个位点是仔猪抗F18大肠杆菌的重要变异位点[8]。大量研究发现,该基因与仔猪腹泻显著相关[9-11],而近年来发现,FUT1基因与猪的产仔性状相关[12]。鞠慧萍等[13]研究发现FUT1 的AB基因型个体繁殖性能均高于BB基因型个体,在第1胎中,AB与BB个体的断奶仔猪数差异显著(P<0.05),在经产胎次中,AB与BB个体的总产仔数差异显著。根据张引红等[14]的研究表明,FUT1基因AA与BB型产仔数差异显著,AA与AB、AB与BB产仔数差异不显著,且其多态性对猪的活产仔数的影响不显著。张新银等[15]研究发现FUT1不同基因型对猪总产仔数和总产活仔数没有显著影响(P>0.05)。在本研究大白猪群体中,FUT1基因型频率关系在大白猪为BB>AB>AA,优势基因是B基因,优势基因型为BB,AA型个体死胎显著比BB型少,AA型个体总活仔数显著高于AB型个体,这说明AA基因型可能与大白猪死胎性状呈负相关,与总活仔数呈正相关,对其AA基因型个体进行合理选留,或许会降低大白猪的死胎率,增加活仔数量,提高猪场经济效益。
PRLR也是母猪繁殖性状的主效基因之一[2],Rothschild等[16]最先于猪的16号染色体PRLR基因第10外显子上检测到了1个AluⅠ多态位点。PRLR基因型多态性位点与猪的总产仔数和产活仔数显著相关[17]。李娜等[18]表明不同基因型均显著影响大汉梅猪的产仔性能 (P< 0.05)。 RCLinvile等[19]研究发现,有利等位基因A提高了猪群的排卵数、总产仔数以及降低了木乃伊胎率。Vincent[20]研究结果表明PRLR中A基因是促进母猪高产的基因。但也有一些研究结果未发现其多态性与繁殖性状的关联关系。如张淑君等[21]研究表明 PRLR基因不同基因型对母猪产仔性状无显著影响。还有研究表明,PRLR上A等位基因对产仔数有利,但对猪的初情期年龄和窝平均乳头数不利[22]。本研究大白猪群体中,PRLR基因型频率关系为AB>AA>BB,优势基因是A基因,优势基因型为AB,AA型个体的窝重显著高于BB型个体,这可以理解为纯合A基因与大白猪窝重性状呈正相关,若对其A基因进行科学的选育,可能会更加有效的增加大白仔猪的窝重,从而提高母猪的繁殖生产性能。
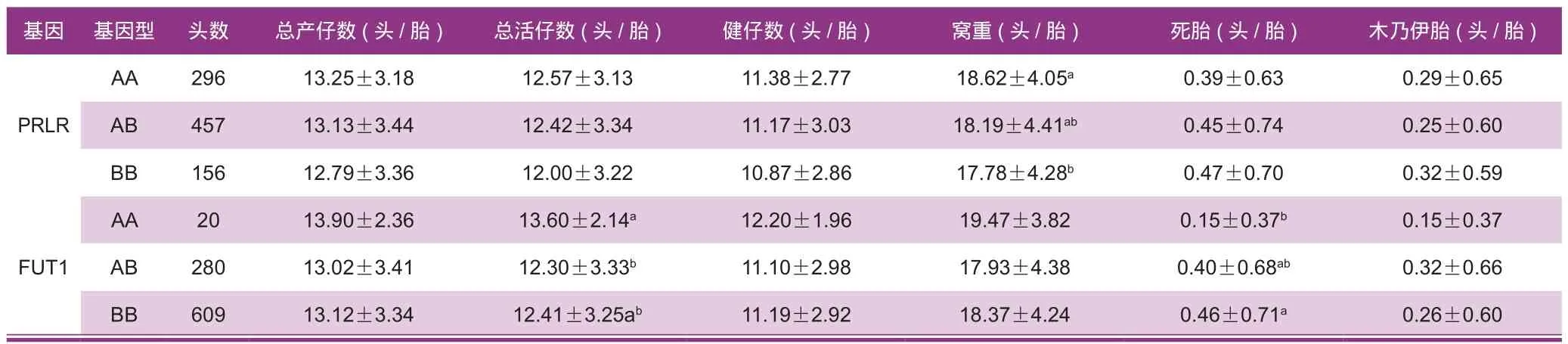
表5 PRLR 和FUT1基因多态性与母猪繁殖性状的关联分析
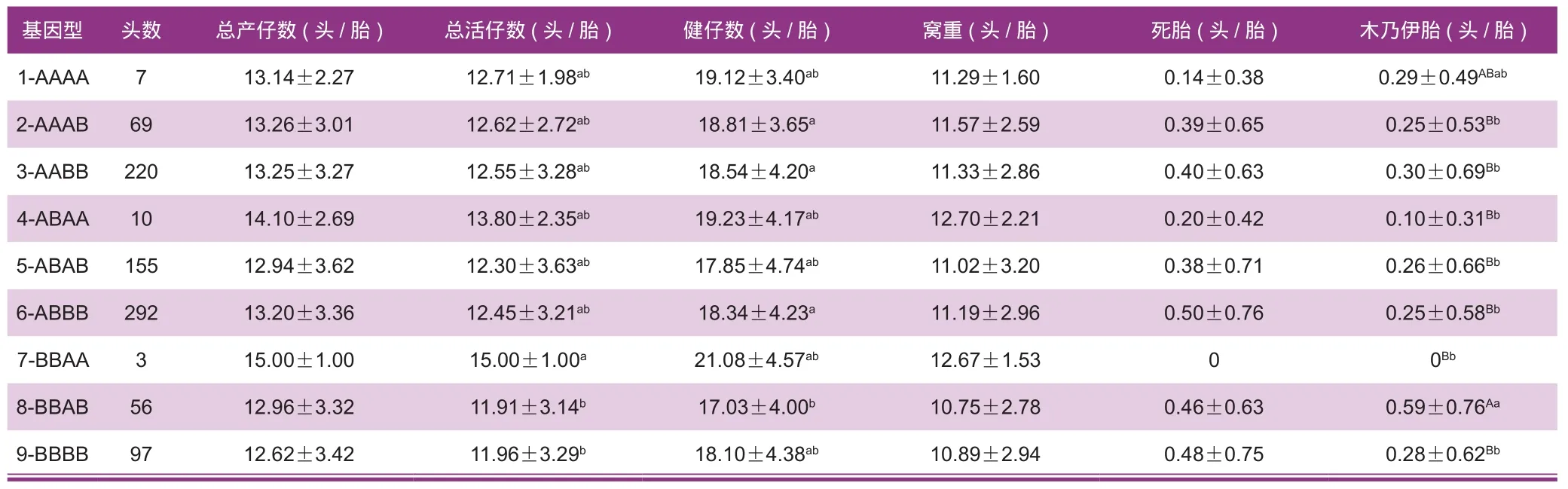
表6 PRLR和FUT1合并基因型与大白猪繁殖性状的关联分析
王立辛等[23]研究表明,单个基因型的遗传效应要低于合并基因型的遗传效应。在本研究大白猪群中,PRLR-FUT1不同的合并基因型在总活仔数、窝重、木乃伊性状上皆有显著性差异。PRLR-FUT1在总活仔数性状上BBAA型个体显著比BBAB型和BBBB型要高;在窝重性状上,BBAB型个体显著高于AAAB型、AABB型和ABBB型;在木乃伊胎性状上,BBAB型个体极显著高于其他各基因型。
3.2 结论
通过实验结果比较分析,在大白猪中PRLR-FUT1最优分子标记组合为BBAA,其次是基因组合ABAA,虽然其样本量分别只有3个和10个,但其综合生产性能均显著高于PRLR-FUT1中其他组合基因型。这提示我们,优势基因并不一定就是高产基因,超高产基因往往可能只占群体的极少数,并且在不同的遗传背景下很容易被低产优势基因覆盖掉,甚至可能会被我们忽略掉,所以这种高产劣势基因可以作为我们在今后的选种选育工作中的一个方向。同时要尽量维持选育群体外部影响因素的一致性,以保障分子标记辅助选择的精确性,以期在实际生产中选育出繁殖力更高的猪群。

