不同剂量卵蛋白诱发BALB/c小鼠支气管哮喘模型的比较
高琴琴,丁子桐,李友林,史 琦,苗 丰,石 璐,楚慧伦,孔德明,孙文燕*
(1.北京中医药大学中药学院中药药理系,北京 102488;2. 中日友好医院中医肺病二部,国家中医药管理局重点研究室(肺病慢性咳喘),中医药防治过敏性疾病北京市重点实验室(BZ0321),中日友好医院呼吸中心;国家呼吸疾病临床研究中心,北京 100029)
支气管哮喘是由多种炎性细胞及细胞组分参与的气道慢性炎症性疾病,是常见的慢性呼吸道疾病之一。该病严重威胁人们健康,且目前尚缺乏根治药物。动物模型是药物评价的重要工具,卵蛋白(ovalbumin, OVA)致敏激发法是最常用的建立模型方法,但造模剂量不尽一致。许多哮喘模型OVA致敏剂量多在10~100 μg不等,其中以20、50、100 μg最为常见,但国内外对不同致敏剂量的造模小鼠进行对比的研究很少,且关于最佳OVA致敏剂量并无明确的报道。本研究基于文献[1-3],采用常用的三种剂量(20、50、100 μg)OVA复制BALB/c小鼠哮喘模型,通过观察血清IgE、IL-4、IFN-γ的含量、支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)嗜酸性粒细胞(eosinophils,EOS)数量及肺组织病理变化情况,以探索较为合适的OVA剂量。
1 材料和方法
1.1 实验动物
SPF级6~8周齡BALB/c小鼠50只,体重18~20 g,雌雄各半,由斯贝福(北京)生物技术有限公司提供[SCXK(京)2016-0002]。动物饲养于中日友好医院屏障环境中[SYXK(京)2016-0043],温度22℃~24℃,湿度44%~50%。本实验方案经过中日友好医院实验动物福利伦理委员会审查,符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理相关规定,审查编号: 180105。本实验实施过程中严格遵守动物使用的 3R 原则。
1.2 主要试剂与仪器
卵蛋白,北京博奥森生物技术有限公司,批号AH06C17666;4%氢氧化铝凝胶,Thermo公司,批号:SH255260;醋酸地塞米松,天津力生制药股份有限公司,批号:1705021;小鼠IgE、IL-4、IFN-γ酶联免疫试剂盒,联科生物。
402B型超声雾化器,江苏鱼跃医疗设备股份有限公司;Multiskan MK3全自动多功能酶标仪,Thermo公司,USA;DH4000 A电热恒温培养箱,天津泰斯特。
1.3 实验方法
1.3.1 动物分组
随机将动物分为5组,即正常组,模型1组(OVA 20 μg),模型2组(OVA 50 μg),模型3组(OVA 100 μg),醋酸地塞米松组(OVA 100 μg),每组10只,雌雄各半。
1.3.2 哮喘模型的复制
BALB/c小鼠适应性饲养一周,采用OVA和氢氧化铝凝胶腹腔注射及OVA雾化激发方法建立支气管哮喘模型。具体方法及时间节点见表1。
在第22~28天,各模型组与醋酸地塞米松组每天雾化吸入1% OVA 30 min,正常组每天雾化吸入生理盐水30 min。醋酸地塞米松组在雾化前1 h灌胃给药醋酸地塞米松(0.5 mg/kg),其余各组灌胃生理盐水。

表1 BALB/c小鼠支气管哮喘模型建立方法(n=10)
1.3.3 血清IgE、IL-4、IFN-γ的含量测定
第29天,各组小鼠眼球取血,3000 r/min 离心 10 min,取血清,采用ELISA法检测血清中IgE、IL-4、IFN-γ的含量。实验步骤严格按照说明书进行操作。
1.3.4 支气管肺泡灌洗液(BALF)EOS计数
钝性分离颈部组织,暴露气管,在气管上剪一个T型小口,插入静脉留置针软管,用注射器注入0.8 mL生理盐水,重复3次。将收集到的BALF 2500 r/min离心5 min,将沉淀涂片,进行瑞氏染色,高倍镜下计数EOS。
1.3.5 肺组织病理学观察
取小鼠右肺,福尔马林固定24 h,脱水后石蜡包埋、切片、HE染色。每组随机选取6只,在光学显微镜下(200倍)观察小鼠肺组织的病理变化。
1.4 统计学方法
对模型3组、醋酸地塞米松组进行两组间差异性比较:若服从正态分布且方差齐采用t检验;数据不服从正态分布或方差不齐采用非参数检验。以P<0.05或P<0.01为差异有统计学意义。
2 结果
2.1 一般情况观察
BALB/c 小鼠在致敏时无显著特征,经卵蛋白激发后出现呼吸急促、弓背直立、躁动挠鼻、二便失禁等典型表现。
2.2 各组小鼠血清中IgE、IL-4、IFN-γ含量比较
与正常组比较,模型1、2、3组小鼠血清IgE、IL-4、IFN-γ含量均明显升高(P<0.05或P<0.01),IL-4/IFN-γ比值显著降低(P<0.05或P<0.01);与模型3组比较,醋酸地塞米松组血清IgE、IFN-γ含量明显下降(P<0.05),IL-4/IFN-γ比值显著升高(P<0.05)。见表2。
2.3 各组小鼠肺泡灌洗液中嗜酸性粒细胞计数
与正常组比较,模型1、2、3组小鼠BALF中EOS数明显升高(P<0.05);与模型3组相比,醋酸泼尼松组BALF中EOS数有下降趋势(P>0.05)。见表3。
2.4 肺组织病理学观察
三种不同剂量的卵蛋白均可造成小鼠肺组织炎细胞浸润、淋巴滤泡形成、支气管上皮细胞变性、支气管平滑肌增生等病理损害。模型2组(OVA 50 μg)较模型1组(OVA 20 μg)、3组(OVA 100 μg)支气管平滑肌增生及黏膜皱襞损伤更为严重。醋酸地塞米松组较模型3组上述病理损害明显减轻。见表4,图1。
表2 各组小鼠血清中IgE、IL-4、IFN-γ含量及IL-4/IFN-γ比值比较
注:与正常组比较,△P<0.05,△△P<0.01;与模型3组比较,*P<0.05,**P<0.01。
Note. Compared with the normal group,△P<0.05,△△P<0.01. Compared with the model 3 group,*P<0.05,**P<0.01.

表3 各组小鼠BALF中EOS数量比较
注:与正常组比较,△P<0.05.
Note. Compared with the normal group,△P<0.05.
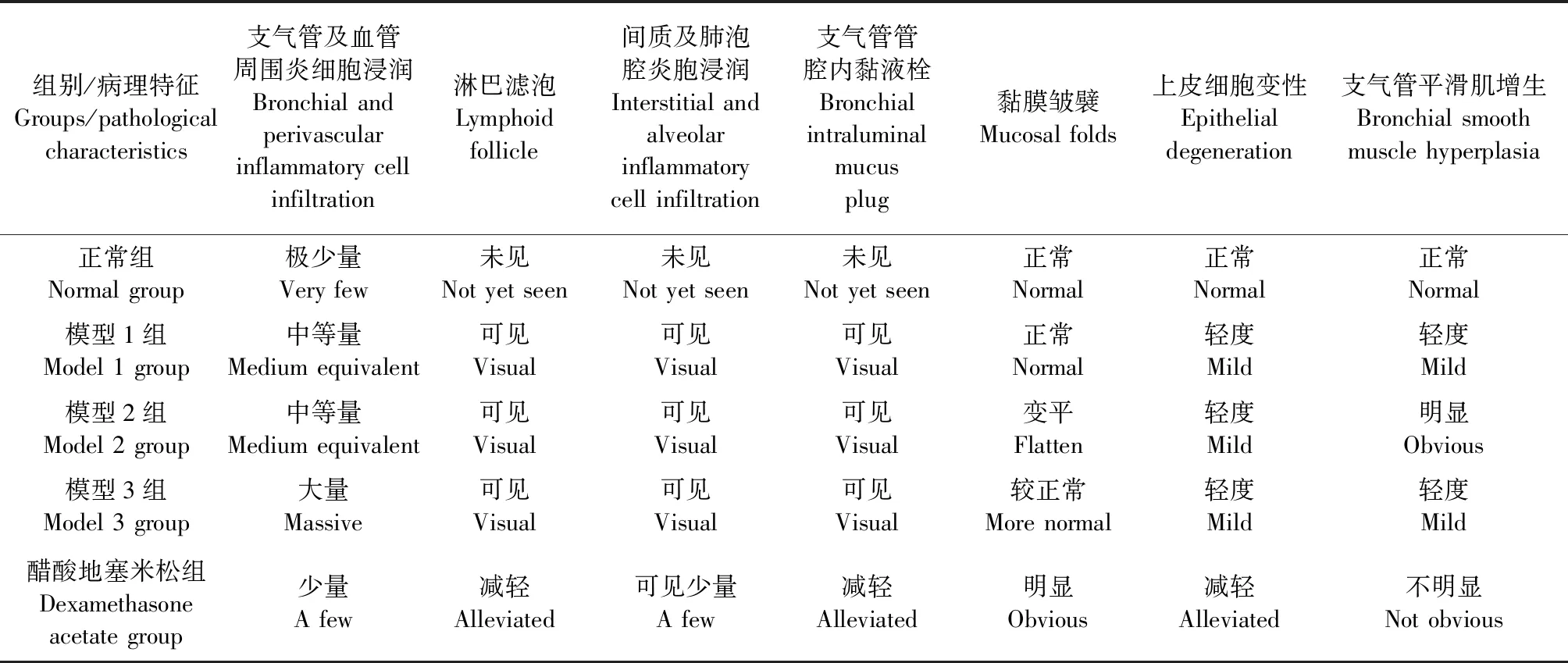
表4 各组小鼠肺组织病理变化比较
3 讨论
哮喘的发病机制复杂,动物模型的不断研究及优化为进一步研究其发病机制提供客观有效的手段。目前用于制作哮喘模型的动物多采用BALB/c小鼠[3],常用的模型制备方法是采用OVA和氢氧化铝致敏及OVA雾化吸入激发,但采用OVA制作哮喘模型的方法存在很大的差异,致敏剂量多在10~100 μg不等,国内外关于最佳OVA致敏剂量并无明确的报道,综合近五年的文献,多使用20、50、100 μg的OVA进行致敏。如房祥峰[4],刘家齐等[5]采用20 μg OVA辅以氢氧化铝致敏小鼠;张明强[2],刘瑞等[6]采用50 μg OVA辅以氢氧化铝致敏小鼠;程胜[3],谢林艳等[7]采用100 μg OVA辅以氢氧化铝致敏小鼠。
本研究基于上述等近年来的文献分析,选用三种剂量的OVA进行致敏激发。随着IgE和嗜酸性粒细胞数的升高,导致气道管腔狭窄,支气管平滑肌增生,气道上皮细胞变性,支气管及血管周围炎症细胞浸润,杯状细胞增生并分泌大量黏液,使得平滑肌的敏感性增高,导致气道高反应性,从而引起肺组织病理改变以及呼吸急促、躁动挠鼻、二便失禁等症状。因此,哮喘模型的成功主要从小鼠的症状、嗜酸性粒细胞数、气道病理改变以及血清IgE、IL-4、IFN-γ含量变化等几个方面来评价,以此来评估哮喘发病过程中的气道炎症、气道重塑和气道高反应性,从而探索较为合适的OVA剂量。
IgE可介导Ⅰ型超敏反应,使嗜碱性粒细胞和肥大细胞脱颗粒,释放多种炎症介质加重哮喘炎症反应[5]。本研究结果显示三组哮喘模型小鼠血清中IgE均明显升高;而阳性药醋酸地塞米松组与模型3组相比,IgE水平降低,表明其可降低IgE介导的变态反应。
炎症反应在哮喘发生和进展中发挥着重要作用,EOS作为哮喘中气道炎症、超敏反应及组织损伤等病理过程的主要效应细胞,参与哮喘的炎症过程[8]。本研究收集BALF并检测其中EOS,发现模型1、2、3组哮喘模型小鼠EOS较正常组升高。
辅助性T细胞亚群Th2的免疫增强在哮喘的发生、发展起着主导作用[9]。Th2主要分泌IL-4、IL-5等细胞因子,而Th1主要分泌IL-2、INF-γ等细胞因子。本研究中3个模型组较正常组IL-4均显著升高。经典理论认为Th1/Th2失衡是哮喘发病的关键机制,但近年来较多研究发现哮喘的发病机制已不能单纯用Th1/Th2平衡理论来解释。研究者用特异性抗原在体外分离哮喘患儿外周血单个核细胞,检测发现上清液中IFN-γ和IL-4水平均增高,提示哮喘患儿体内Th1和Th2细胞功能均增强;而且在哮喘缓解期患者外周血中淋巴细胞产生的IFN-γ较特应症患者及正常人明显增多[10]。本研究中以IFN-γ为代表的Th1细胞因子显著升高,与上述结果一致。因此,不能只考虑用Th1/Th2平衡理论来解释哮喘的发病机制,需要进行更多的探索完善,近年来研究较多的有Th17/Treg平衡、TGF-/TrSmads[11]及VEGF/MMP[12]信号通路等。
组织形态学是评价哮喘模型是否成功的重要指标[13]。本研究发现,3个模型组的肺组织病理切片可见大量的炎性细胞浸润,支气管管腔内可见黏液栓,上皮细胞变性,黏膜皱襞改变及支气管平滑肌增生等表现,与哮喘患者的病理特征相似;模型2组(50 μg)BALB/c小鼠较模型1组(20 μg)、模型3组(100 μg)在支气管平滑肌增生及黏膜皱襞变化方面更为显著。
综上所述,本研究采用三种剂量OVA诱导的BALB/c小鼠哮喘模型均获成功,但综合而言50 μg OVA所诱发的哮喘模型血清IgE、IL-4、IFN-γ含量以及肺组织病理改变更为明显,可用于哮喘相关的实验研究。醋酸地塞米松可减少IgE分泌、降低血清炎性细胞因子含量,减轻肺组织病理变化,可作为阳性药使用。

