腹腔镜下贲门周围血管离断术对门静脉系统和肝动脉血流动力学的影响
孙艺波,阴继凯,董瑞,李智,王栋,黄博,杨媛,鲁建国
(空军军医大学第二附属医院普通外科,陕西 西安 710038)
肝内型门静脉高压作为最常见的临床类型,其病理过程常始于肝内门静脉血流阻力增加,随着高动力循环改变而导致脾肿大,继而引起更加严重的并发症,包括食管胃底静脉曲张和出血、大量腹水、肝性脑病、肝肾综合征等[1-3]。以断分流术为主的手术治疗仍然在门静脉高压症治疗中发挥着重要作用[4]。其中,贲门周围血管离断术能够改善脾功能亢进的同时减少上消化道出血的发生率,已成为肝硬化门静脉高压症病人的主要手术方式[5-6]。近年来,腹腔镜下贲门周围血管离断术(laparoscopic splenectomy plus pericardial devascularization,LSD)越来越多地被应用于肝硬化门静脉高压症[7-9]。门静脉高压症是肝硬化门静脉系统血流动力学异常的综合征,病程中门静脉、脾静脉、肠系膜上静脉会发生代偿性变化,肝脏灌注也会发生明显改变,因此了解门静脉系统及肝动脉血流动力学变化对于手术方案制定和评价手术疗效尤为重要[10-11]。本研究通过回顾性分析肝硬化门静脉高压症病人临床资料、手术前后门静脉系统及肝动脉血流动力学数据,探讨LSD对门静脉系统和肝动脉血流动力学变化的影响。
资料与方法
一、 一般资料
选择2011年1月至2017年12月在我科行LSD的肝硬化门静脉高压症270例病人作为研究对象。纳入标准:①术前明确诊断为肝硬化门静脉高压症;②术前有上消化道出血史和(或)经胃镜证实存在重度食管胃底静脉曲张(直径>5 mm)或伴有红征且肝静脉压力梯度(HVPG)>12 mmHg等提示病人有较高出血风险;③所有病人均进行LSD治疗;④临床资料相对完整。排除标准:①年龄>70岁;②临床资料严重缺失者。本研究通过我院伦理委员会审批。
二、手术方法
1.病人体位及Trocar位置 全身麻醉成功后,病人取仰卧分腿位,左腰部垫高,充分暴露术野,常规消毒铺单。Trocar位置采用五孔法:脐右侧腹直肌旁切口置入10 mm Trocar(A孔),脐下1 cm处切口置入10 mm Trocar(B孔),左腋前线脾脏下缘切口置入12 mm Trocar(C孔),剑突下切口置入5 mm Trocar(D孔),剑突与肚脐连线中点切口置入5 mm Trocar(E孔),其中A孔为观察孔,B、C孔为主操作孔,D、E孔为辅助操作孔(图1)。
2.手术步骤 ①脾动脉结扎:分离胃结肠韧带,打开胃网膜囊,紧贴脾脏游离并切断脾胃韧带、脾结肠韧带,于胰腺上缘寻找并游离脾动脉后用线结扎或用生物夹夹闭(图2),观察脾脏血供,待脾脏质软缩小变暗。此步骤是腹腔镜脾切除的关键步骤,脾动脉一般沿胰腺上缘解剖,游离和结扎位点应尽可能远离脾门,因为越靠近脾门,脾动静脉之间的关系越为密切,越容易发生脾静脉的损伤;②脾周间隙游离:脾动脉结扎后,脾脏体积缩小、质地变软使脾脏周围出现解剖间隙,沿解剖间隙游离脾脏,注意保留脾静脉分支与腹膜后潜在的有益分流血管;③脾蒂的处理:采用Endo-GIA一次性血管切割闭合器,使用血管切割闭合器之前应注意尽可能充分游离胰腺尾部并去除脾蒂周围的附属结缔组织,充分暴露脾门血管,仅将Endo-GIA用于离断脾脏血管(图3),从而减少因组织闭合不完全导致的血管残端出血;④贲门周围血管离断:游离胃大弯侧,翻起胃大弯向右上方,显露胃后壁,结扎切断胃后静脉,Endo-GIA一次性血管切割闭合器切断胃冠状静脉主干(图4),打开膈肌角,充分暴露食管两侧及后方,离断食管支及高位食管支(图5),充分游离食管下段6~8 cm,缝合胃大弯及胃小弯侧胃壁使其浆膜化;⑤引流管放置及标本取出:在脾窝放置1~2根腹腔引流管便于术后观察腹腔渗出情况并充分引流腹水以利于术后创面愈合。脾脏标本取出可以在腔镜下将其置入标本袋内再稍扩大腹壁戳卡切口将其粉碎后取出,术后伤口及引流管放置见图6。
3.术后管理 术后第1天根据病人状况指导其床上活动,第2~3天开始下床活动;根据胃管引流量尽早拔除胃管并逐渐恢复饮食;常规给予抗生素预防感染、保肝、抑酸,必要时输血浆或者白蛋白等处理;监测腹腔引流量、性状及引流液淀粉酶浓度,腹水引流<500 ml/d时可拔除腹腔引流管;确保腹腔无渗血后,根据D-二聚体、凝血功能及血小板计数适时给予抗凝治疗,院内应用低分子肝素,出院后给予阿司匹林或利伐沙班抗凝,以预防或治疗门静脉血栓。
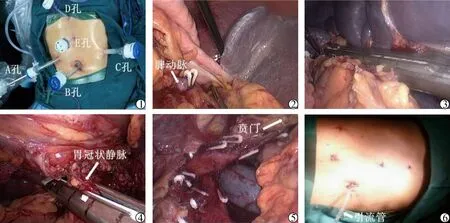
图1 切口及Trocar位置 图2 夹闭脾动脉 图3 离断脾蒂 图4 离断胃冠状静脉 图5 离断食管支及高位食管支 图6 引流管位置
三、观察指标
①手术前后门静脉和肠系膜上静脉的直径、血流速度、血流量;②手术前后肝动脉直径、最大血流速度、最小血流速度、平均血流速度、血流量。
四、统计学处理
结 果
一、病人一般临床资料
270例病人中,男性145例,女性125例;年龄(45.94±10.28)岁,年龄范围为17~69岁;乙型肝炎肝硬化185例,丙型肝炎肝硬化36例,乙、丙型肝炎病毒重叠感染肝硬化3例,自身免疫性肝硬化14例,胆汁淤积性肝硬化8例,酒精性肝硬化3例,其他类型肝硬化21例,术前评估肝功能Child-Pugh分级,A级196例,B级74例;终末期肝病评估模型(MELD)评分为9.73±2.31,范围为2~18;术前有上消化道出血史者175例,无出血史者95例;术前胃镜检查食管胃底静脉曲张>5 mm病人214例,<5 mm病人56例;红征阳性194例,阴性76例;术前HVPG为(16.46±7.02)mmHg(1~42 mmHg);吲哚菁绿15 min内滞留率(ICG R15)为(15.57±9.16)%(0.9%~45.8%);合并慢性疾病:高血压15例,糖尿病21例。
二、手术前后门静脉系统血流动力学变化(表1)
病人术后门静脉直径平均较术前减少0.17 cm,平均下降11.92%,差异有统计学意义(P<0.001);术后门静脉血流速度平均较术前减少3.62 cm/s,平均下降21.1%,差异有统计学意义(P<0.001);术后门静脉血流量平均较术前减少664.3 ml,平均下降40.3%,差异有统计学意义(P<0.001),见图7。
病人术后肠系膜上静脉直径平均较术前减少0.115 cm,平均下降11.88%,差异有统计学意义(P<0.001);肠系膜上静脉血流速度与术前比较差异无统计学意义(P=0.915);肠系膜上静脉血流量平均较术前减少95.3 ml,平均下降13.87%,但差异无统计学意义(P=0.065),见图8。
三、手术前后肝动脉血流动力学变化(表2)
病人术后肝动脉直径平均较术前增加0.038 cm,平均增加13.06%,差异有统计学意义(P=0.001);肝动脉最大血流速度平均较术前增加16.58 cm/s,平均增加28.48%,差异有统计学意义(P=0.002);肝动脉最小血流速度平均较术前增加7.63 cm/s,平均增加44.3%,差异有统计学意义(P<0.001);平均肝动脉血流速度平均较术前增加11.91 cm/s,平均增加38.7%,差异有统计学意义(P<0.001);肝动脉血流量平均较术前增加110.1 ml,平均增加70.63%,差异有统计学意义(P=0.02),见图9。
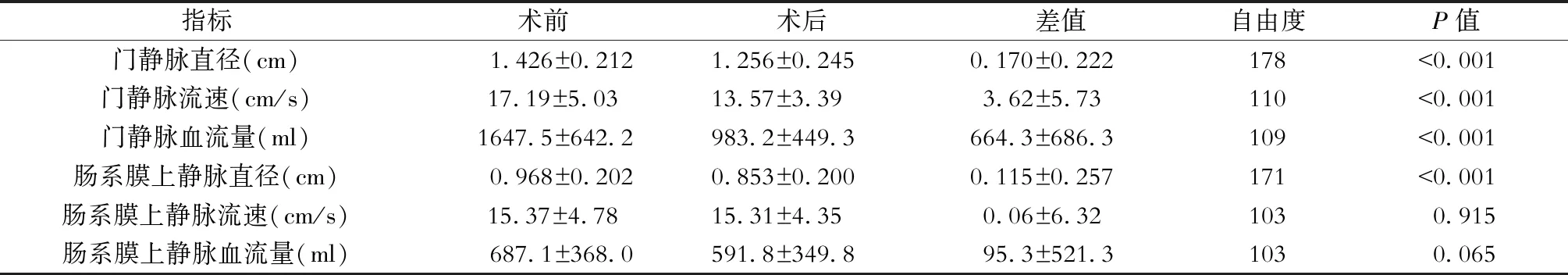
表1 LSD手术前后门静脉系统血流动力学变化
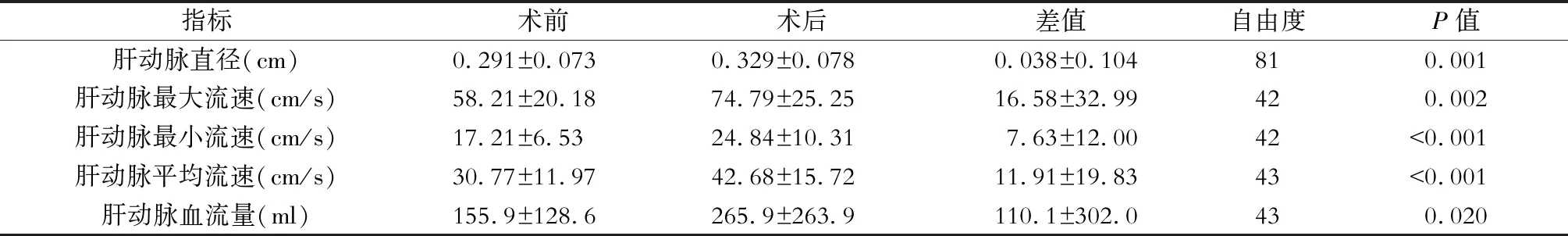
表2 LSD手术前后肝动脉血流动力学变化
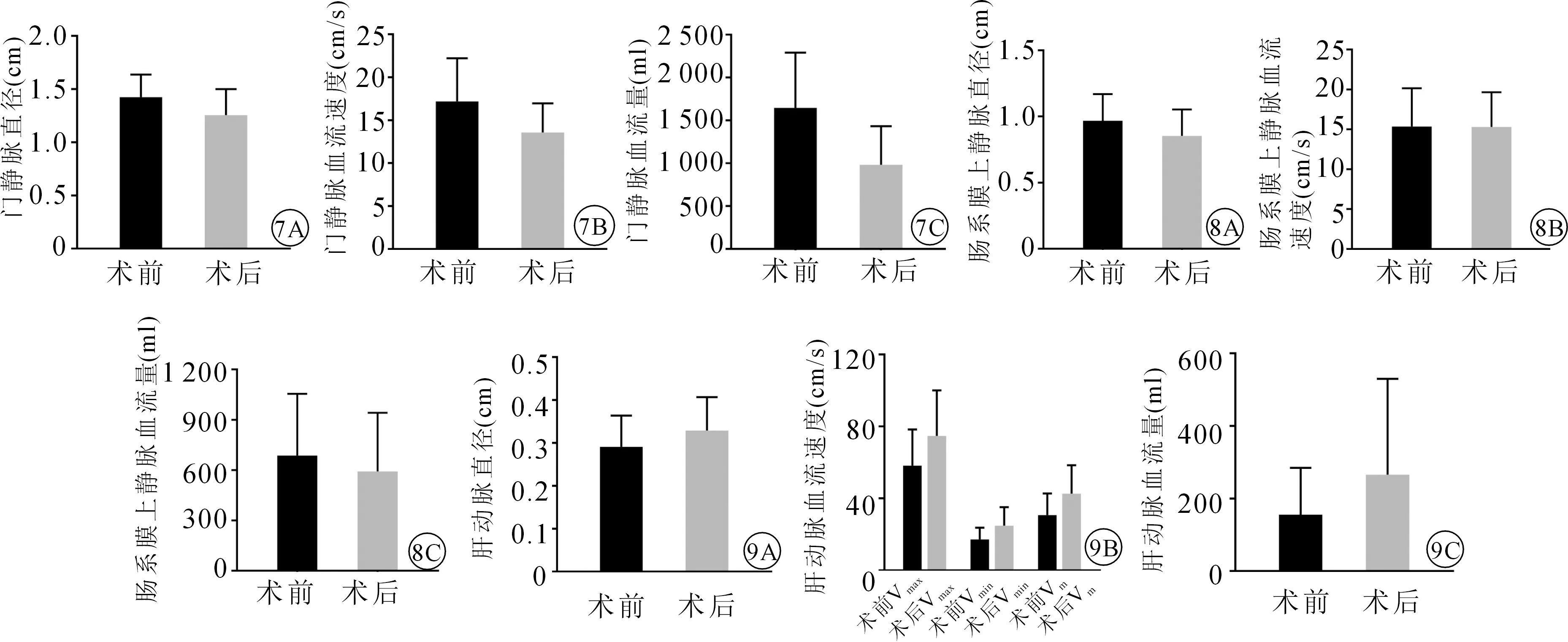
图7 LSD手术前后门静脉血流动力学变化(A.门静脉直径;B.门静脉血流速度;C.门静脉血流量) 图8 LSD手术前后肠系膜上静脉血流动力学变化(A.肠系膜上静脉直径;B.肠系膜上静脉血流速度;C.肠系膜上静脉血流量) 图9 LSD手术前后肝动脉血流动力学变化(A.肝动脉直径;B.肝动脉血流速度;C.肝动脉血流量)
讨 论
正常人肝脏每分钟血流量约1 500 ml,其中门静脉血流约占全肝血流量的60%~80%,每分钟约1 100 ml,当发生肝硬化时,肝内血管阻力增加,同时由于内脏高血流动力学状态导致经内脏流入门静脉的血流量增加,因此,门静脉血流实际增加,入肝血流实际减少,多余的血流量导致门静脉压力急剧增加,进而门静脉、脾静脉、肠系膜上静脉直径代偿性增加,迫使食管胃底静脉、肛管直肠下端静脉、前腹壁静脉等侧支循环形成来分流,一旦曲张的食管胃底静脉破裂,即导致上消化道出血[12-13]。有文献报道门静脉高压症病人中门静脉、脾静脉血流量相对于正常人的增加量分别为64%及156%,部分病人脾静脉占门静脉血流量比例可在80%以上,说明门静脉系统的高动力循环主要来自脾脏[14],因此,切除脾脏减少回流能够从根源上减少门静脉血流量,从而达到降低门静脉压力的目的。本研究中LSD术后平均门静脉血流量较术前降低40.3%,从侧面提示手术效果明显。肠系膜上静脉是门静脉的一条主要属支,收纳空肠、回肠、升结肠、横结肠等脏器静脉血流并最终汇入门静脉[15],一旦肠系膜上静脉回流明显减少,则容易导致肠道充血水肿,影响胃肠道消化功能,甚至严重可导致肠坏死。肝硬化门静脉高压症病人,门静脉压力增加,肠系膜上静脉代偿性增粗,当病人接受贲门周围血管离断手术治疗后,门静脉压力明显减小,肠系膜上静脉状态也随之变化。本研究同时测定了手术前后肠系膜上静脉血流动力学变化,结果显示LSD手术后肠系膜上静脉血流速度基本不变(P=0.915),血流量略有下降(13.87%),但影响有限(P=0.065),因此,目前来看,LSD手术并不会对肠道静脉回流造成太大影响。
肝硬化病程中脾脏与肝脏相互作用,一方面肝硬化导致门静脉高压,门静脉系统充血,引起脾肿大和脾功能亢进;另一方面,亢进的脾脏可以通过调节肝纤维化相关细胞和因子、肝脏免疫微环境、脾源性细胞趋化性排出、脾源性可溶性因子释放等途径促进肝硬化病程发展,因此许多研究提示切除脾脏具有改善肝硬化的效应[16-21]。从解剖上来看,肝脏供血来自门静脉和肝动脉,肝动脉和门静脉末梢分支最终共同汇入肝血窦,手术后门静脉血流量明显减少导致肝血窦压力降低,使肝动脉血流增加。因此门静脉血流减少越多,肝动脉血流增加越显著[22]。同时由于脾脏动脉和肝总动脉均为腹腔干分支,脾动脉向左,肝总动脉向右,脾动脉结扎后分支减少,而且脾动脉盲端可能会有动脉血返流,均有可能增加肝总动脉血流量,改善肝脏灌注,从而增加肝脏组织营养及氧气供应,改善肝脏功能并促进肝细胞再生[23-24]。
综上所述,从血流动力学变化来看,当病人接受LSD治疗后,门静脉直径缩小,流速及血流量明显减小,降压效果明显。尽管肠系膜上静脉直径由于门静脉压力降低而减小,但血流速度无明显变化,LSD手术对肠道静脉回流影响有限。手术后肝动脉直径、流速及血流量等各项指标均明显增加,提示术后肝动脉灌注的改善。

