下调claudin-1对胆囊癌细胞SGC996生物学行为的影响
复发和转移是胆囊癌不良预后的重要因素之一[1]。肿瘤的进展存在基因的参与[2]。紧密连接结构的破坏导致细胞增殖、分化异常在肿瘤的进展中起作用。紧密连接蛋白如Claudin的丢失与重排,被认为是恶性肿瘤进展及其触发机制重要的原因[3]。Claudin-1是紧密连接蛋白中的一个亚型,前期研究发现其蛋白在胆囊癌组织中升高且与病程分期具有一定的相关性[4]与有些研究[5]有偏差,本研究下调Claudin-1在胆囊癌细胞SGC996中的表达,检测其对胆囊癌细胞增殖、凋亡、侵袭等生物学行为的影响。
1 材料与方法
1.1 材料
胆囊癌细胞SGC996、GBC-SD、胆管癌细胞QBC939均购自上海吉凯基因公司;DMEM购自Corning、胎牛血清购自Ausbian;Trizol购自上海普飞公司;逆转录试剂盒M-MLV购自Promega公司;PCR引物由广州市锐博生物科技有限公司合成;慢病毒感染相关试剂:胰酶购自生工生物工程(上海)股份有限公司;嘌呤霉素购自Clontech公司;MTT购自Genview公司;PI购自Sigma公司;凋亡试剂盒购自eBioscience;protein-dye购自Bio-Rad公司;蛋白Marker购自Fermentas公司;兔抗人Bax蛋白单克隆抗体、兔抗人Bcl-2蛋白单克隆抗体和鼠抗人β-actin单克隆抗体均购自Bioworld公司;羊抗鼠和羊抗兔二抗均购自上海康成生物公司;构建质粒所用限制性内切酶及T4连接酶购自NEB公司Transwell(孔径8μm)购自Corning公司。
1.2 方法
1.2.1 qRT-PCR法 引物:GAPDH上游5'-TGACTTCAACAGCGA CACCC和 下 游5'-CACCCTGTTGCTGTAGCCAAA,claudin-1上 游5'-AAAGTGAA GAAGGCCCGTATA和下游5'-TAATGTTGGTAGGG ATCAAAGG。反应体系:SYBR 10.0 μL,上游引物(2.5 μM)2 μL,下游引物(2.5 μM)2 μL,cDNA2.0μL,RNase-FreeH2O 4.0 μL;反应条件:94℃预变性 10 min,94 ℃变性 15 s、60 ℃退火 20 s、72 ℃延伸15 s,45个循环。
1.2.2 LV-CLDN1-RNAi感染SGC996细胞 LV-CLDN1-RNAi沉默Claudin-1基因,阴性CON077。实验组为KD、对照组为NC和空白对照组为MOCK。感染后8~12 h,感染效率达到70%以上,继续实验。荧光标记的慢病毒感染。感染后72 h左右,荧光显微镜观察报告基因的表达情况,荧光率即为阳性感染率;抗性基因标记的慢病毒感染。一般于感染48~72 h后,换用含puromycin的培养基筛选细胞,感染效率合格用于下游检测。
1.2.3 MTT法检查细胞增殖 铺板细胞密度为2 000 cell/well,铺板数量(检测5天,铺5张96孔板)。观察细胞密度,细胞培养箱培养。终止前4 h加入20 μL 5 mg/mL的MTT于孔中,4 h后完全除去培养液,加100 μL DMSO溶3/3解甲瓒颗粒。振荡器振荡2~5 min,酶标仪490/570 nm检测OD值。
1.2.4 流式细胞仪检查细胞周期 细胞数目≥106/处理。悬浮细胞,收集。离心,4℃预冷的D-Hanks(pH=7.2~7.4)洗涤1次。4℃预冷的75%乙醇固定至少1 h。D-Hanks洗涤,细胞染色液配制:40×PI母液(2 mg/mL):100×RNase母液(10 mg/mL):1×D-Hanks=25:10∶1 000,加入细胞染色液(0.6-1mL)重悬,使上机时细胞通过率为300~800 Cell/s,上机检测。
1.2.5 AnnexinV-APC单染色法检查细胞凋亡 细胞数目≥5×105/处理。离心,弃上清,D-Hanks洗涤沉淀。1×binding buffer洗涤沉淀,离心,收集细胞。200μL 1×binding buffer重悬细胞沉淀。加入10 μL Annexin V-APC染色,补加400~800μL 1×binding buffer。
1.2.6 Transwell实验检查细胞侵袭 Matrigel胶4℃过夜,与1 640培养基以1∶8稀释以每孔50 μL包被Transwell小室底部膜的上室面风干。转染48 h的细胞并调整细胞密度至1×105个/mL,取200 μL接种于上层小室,小室加入600 μL培养基。37℃、5%CO2培养箱中培养48 h。取出Transwell小室吸除培养基,擦净Transwell小室滤膜上层的Matrigel胶及未穿过滤膜的细胞,95%酒精固定5 min,4 g/L结晶紫溶液染色1 h。
1.2.7 Western blotting检查凋亡相关基因Bax及Bcl-2蛋白表达水平 加入裂解液100 μL和酶抑制剂1 μL的冰上裂解30 min,10 000 g离心10 min,吸取清亮层,Bradford法蛋白定量。以12%SDS-PAGE 电泳分离,转膜,室温下摇床封闭1 h,加入用TBS稀释一抗,TBS洗膜后加入辣根过氧化物酶标记的羊抗兔或羊抗鼠二抗,室温下摇床作用1 h,TBS洗膜后化学发光法显色。
1.3 统计学方法
采用SPSS 21.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,两个样本均数比较采用t检验,多于两组样本均数的比较,采用方差分析(ANOVA),以P<0.05表示差异具有统计学意义。
2 结果
2.1 qRT-PCR法检测胆囊癌细胞SGC996、GBC-SD、胆管癌细胞QBC939中claudin-1mRNA表达
claudin-1mRNA在QBC939,SGC996中的表达丰度为高,在GBC-SD中的表达丰度为中。后续功能学研究选用claudin-1mRNA表达相对较高的SGC996为实验细胞(见表1及图1)。
2.2 LV-CLDN1-RNAi感染SGC996细胞后claudin-1mRNA
相比阴性对照组,感染了LV-CLDN1-RNAi后胆囊癌细胞SGC996中KD2组中claudin-1mRNA的表达水平显著降低,差异具有统计学意义 [(1.004±0.104)vs.(0.156±0.023),P=0.000 2]。敲除效率达到84.4%(见图2和图3)。
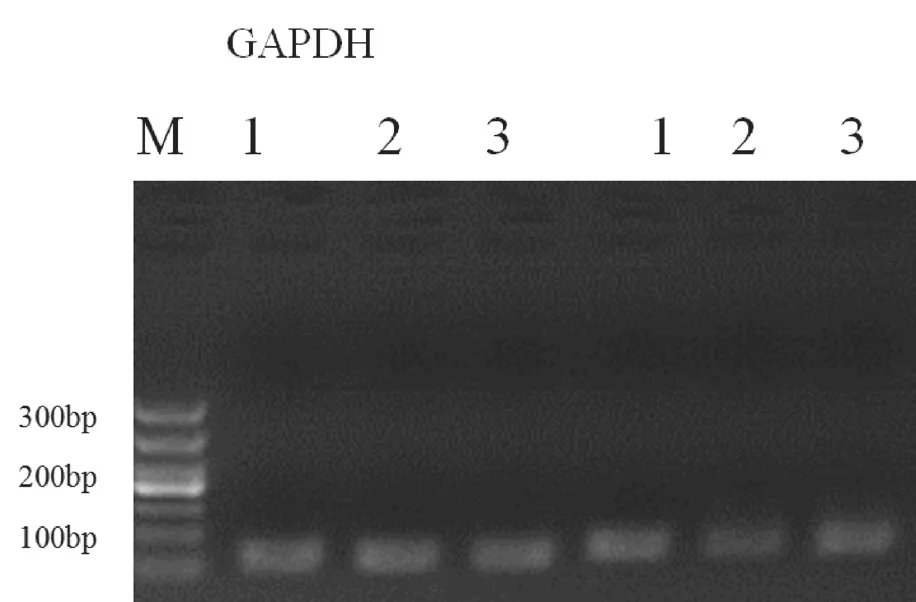
图1 SGC996、GBC-SD、QBC939中claudin-1mRNA表达
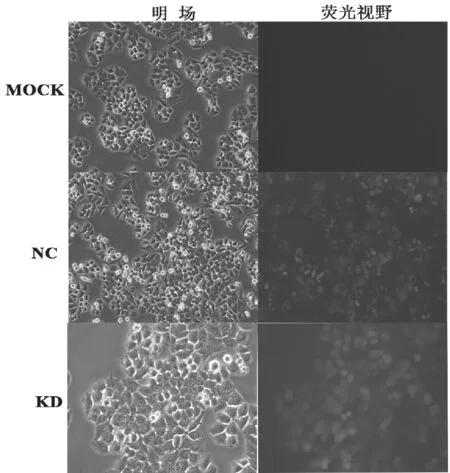
图2 感染前后细胞荧光图片
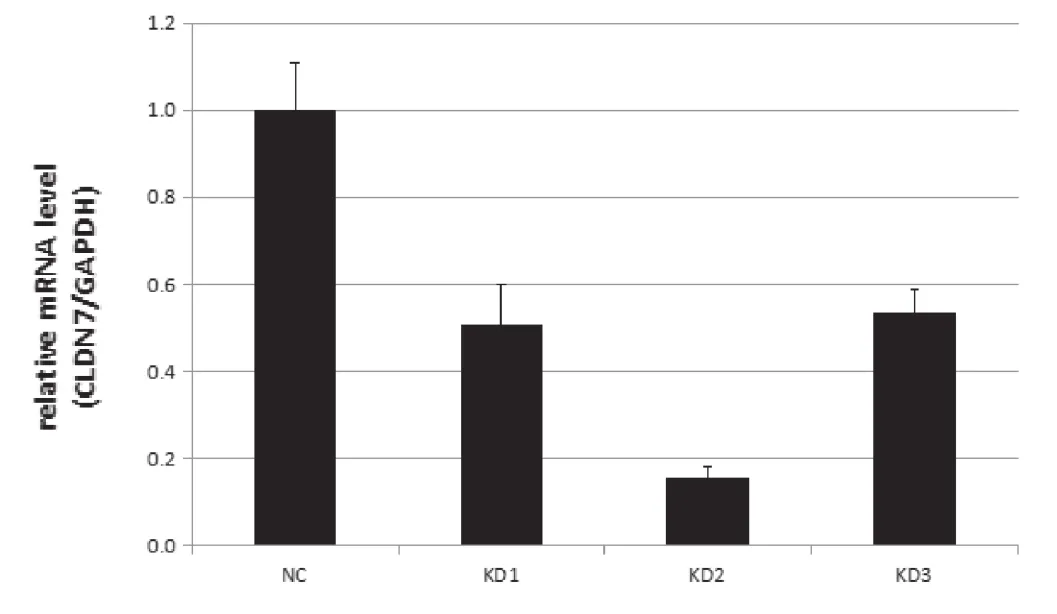
图3 SGC996细胞感染了LV-CLDN1-RNAi后claudin-1mRNA的表达
2.3 MTT法检查细胞增殖
MTT结果见图2所示。感染了LV-CLDN1-RNAi的胆囊癌细胞SGC996,在转染后1、2、3、4天生长速度比较,差异无统计学意义(P>0.05)。在5天生长速度有所增加,虽然T-test分析P<0.05,但差异倍数不足20%,仍判定为阴性。结果提示下调claudin-1对细胞增殖无明显影响(见图4)。
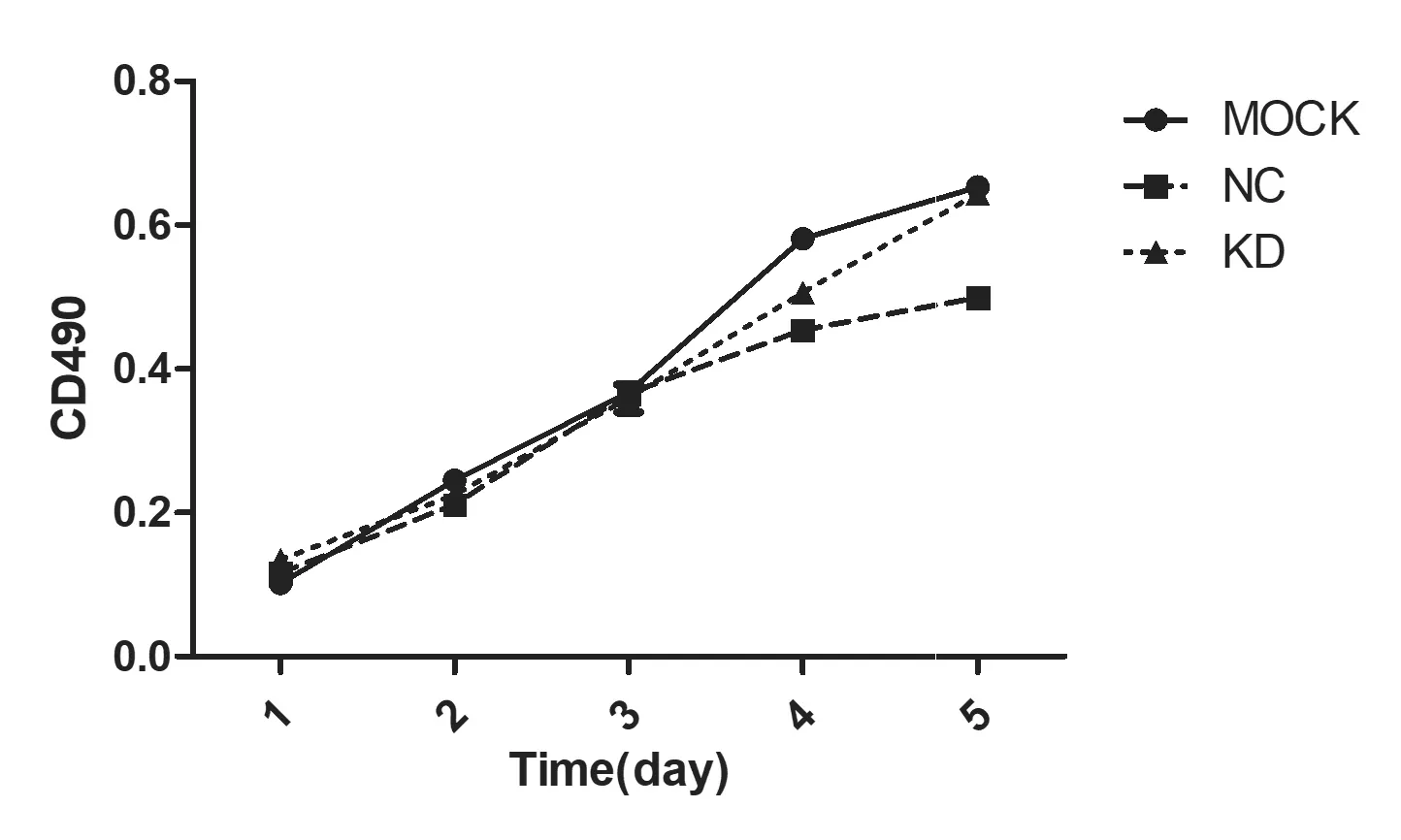
图4 细胞生长曲线
2.4 流式细胞仪检查细胞周期
流式细胞仪检测显示,KD组胆囊癌细胞SGC996,其G1期细胞明显增多 [(53.39±0.40)%vs.(43.00±0.56)%,P=0.000 013],S期细胞明显减少 [(30.05±0.66)%vs.(39.64±0.54)%,P=0.000 4],G2/M期细胞比例比较,差异无统计学意义[(16.55±0.34)%vs.(17.35±0.72)%,P> 0.05]。说明大量细胞阻滞在G0/G1期。结果表明下调claudin-1具有抑制胆囊癌细胞G1/S转化的作用(见图5)。
2.5 AnnexinV-APC单染色法检查细胞凋亡
KD组胆囊癌细胞凋亡比例明显增加,差异具有统计学意义(P<0.05)。结果表明下调claudin-1对胆囊癌细胞具有促进凋亡的作用(见图6)。
2.6 Transwell法检查细胞侵袭
细胞要突破Matrigel胶才能转移到多孔膜下表面。因Matrigel胶模拟体内细胞外基质,故通过transwell实验能检测细胞的侵袭能力。结果显示KD组细胞侵袭能力受到抑制(见图7)。
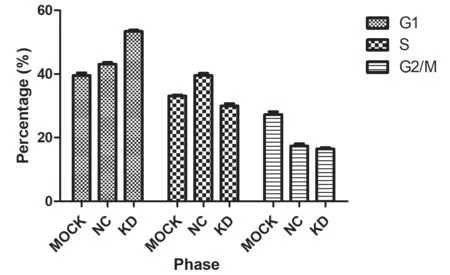
图5 细胞周期变化
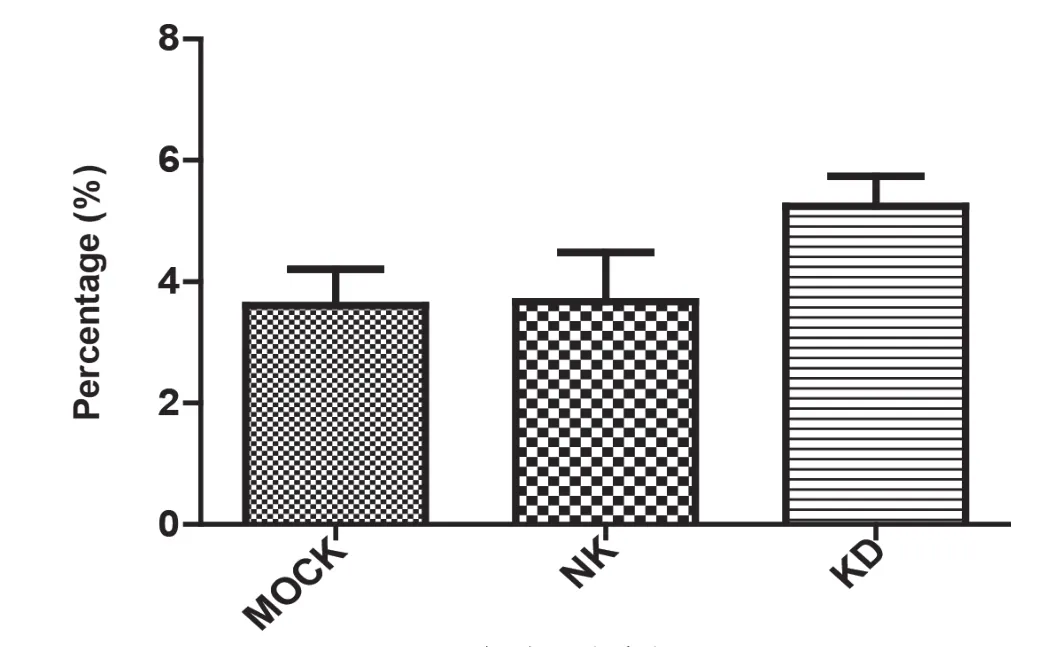
图6 细胞凋亡变化
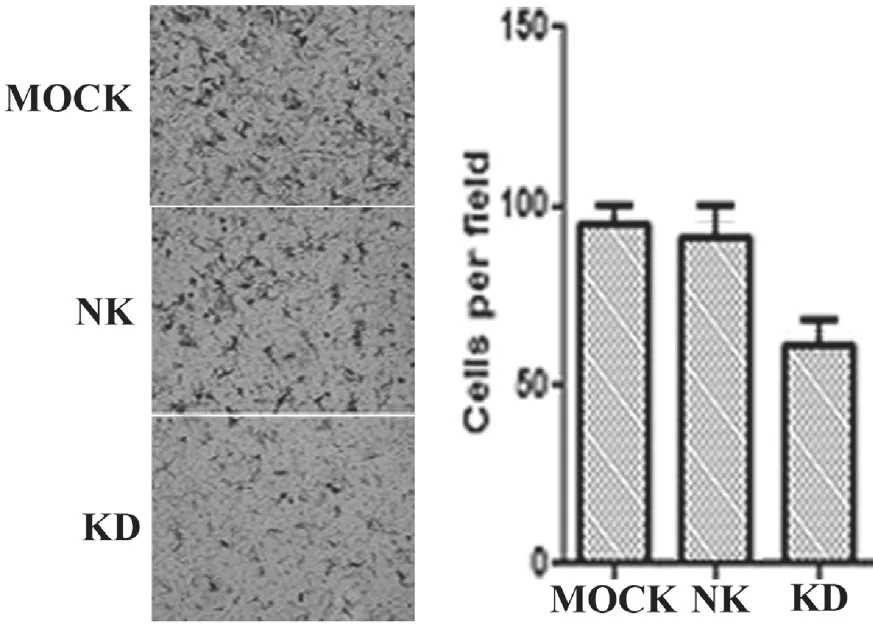
图7 细胞侵袭能力
2.7 Western blotting检查凋亡相关基因Bax及Bcl-2蛋白表达水平
Western blot结果显示KD组凋亡促进基因Bax的蛋白表达增加,凋亡抑制基因Bcl-2蛋白表达下降(见图8)。
3 讨论
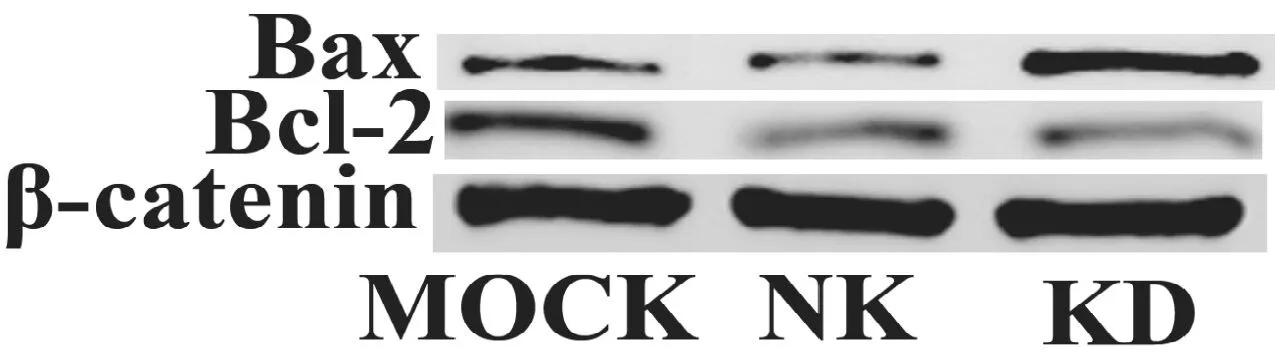
图8 凋亡相关基因的表达
Claudin蛋白有24种亚型被发现,Claudin-1为位于人染色体3q28-q29 的基因,编码 211 个氨基酸,参与细胞间的黏附调节。Claudin-1影响肿瘤的进展等生物学行为[6-7]。关于Claudin-1在肿瘤中作用,已有报道[8-10]。Suren D等[11]发现Claudin-1在鼻翼癌肿瘤组织和非肿瘤上皮中的表达无显著差异且与肿瘤预后无差异。在口腔鳞状细胞癌中Claudin-1被发现高表达,提示肿瘤不良预后[12]。Holczbauer Á等[13]应用免疫组化和Western blotting检测肝癌、癌旁肝硬化组织及正常肝脏组织中Claudin-1的表达,在肝癌和乙肝相关性肝硬化组织表达显著升高。Bouchagier KA等[14]同样研究肝癌发现,肝癌组织Claudin-1的高表达可能与生存率提高有关。Matsuoka T等[15]报道claudin-1的表达上调预示着肿瘤的侵袭和发展。在有淋巴结转移的结肠癌中claudin-1明显高表达。Süren D等[16]研究提示claudin-1的表达缺失与肿瘤浸润深度、淋巴结转移、血管侵犯及神经侵犯密切相关。郭兴军等[17]的研究表明claudin-1在胆管癌中高表达与胆管癌的侵袭转移能力密切相关。
前期研究发现claudin-1蛋白在胆囊癌组织中明显升高[4]与有些研究[5]有偏差,实验发现claudin-1mRNA在QBC939,SGC996中的表达丰度为高。后续对claudin-1mRNA表达相对较高的SGC996细胞进行功能实验。结果流式细胞仪检测细胞周期提示下调claudin-1具有抑制胆囊癌细胞增殖及 G1/S期转化的作用。AnnexinV-APC单染色法检查细胞凋亡发现下调claudin-1后凋亡细胞明显增多,且Western blot 法检测提示下调claudin-1基因后胆囊癌细胞中,促进基因Bax的蛋白表达增加,凋亡抑制基因Bcl-2蛋白表达下降,进一步说明下调claudin-1基因可以促进胆囊癌细胞凋亡。Transwell实验证明下调claudin-1后胆囊癌细胞侵袭能力受到抑制。研究结果与Atsushi Shiozaki等[18]在胃癌中研究结果相一致,他们报道下调claudin-1后抑制胃癌细胞增殖,侵袭及转移,促进其凋亡。Liu Y等在乳腺癌细胞中实验也提示下调claudin-1基因后促进凋亡其机制同样是通过TNF-α表达引起的。通常,claudin-1作为紧密连接蛋白参与细胞间粘附,其下调可能会促进细胞的迁徙,然而前述的研究结果并非如此,可能的机制为下调claudin-1基因诱导细胞浆内TNF-α表达进而激活一系列信号通路导致凋亡发生[19]。Jilian L Pope等[20]研究提示claudin-1过表达加快肿瘤的生长和进展,提示不良预后,其机制可能通过激活Wnt信号通路有关。
总之,研究发现claudin-1基因在胆囊癌细胞的增殖、凋亡和侵袭中起作用,其具体的分子机制如何将可作为后续研究的靶点,明确机制也可能使claudin-1基因成为新的胆囊癌基因靶向治疗的新希望。

