DD3mRNA联合生物学技术在前列腺癌诊治中的价值
前列腺癌(prostate cancer,PC)作为西方发达国家男性第二死亡率的恶性肿瘤,其发病率一直居高不下[1]。虽然我国前列腺癌的发病率低于欧美国家,但是随着中国的经济发展和社会水平的提高,人口老龄化和饮食结构的改变,其发病率呈上升趋势[2]。局限性PC可以治愈,但是后期却无法治愈,因此对PC的早期诊断能够提高该病的治愈率[3]。血清PSA(serum PSA,sPSA)检查是最为常用的指标之一,但是其特异性较低,而且在BPH、前列腺炎和其他非恶性前列腺疾病的患者红也会升高[4-5]。因此需要更加特异性的肿瘤标准无用于PC的诊断,而DD3(differential display code 3)基因在PC表达时显著增高。DD3mRNA可以在PC细胞中高度表达,与正常组织相比要增加了34倍之多[6]。DD3基因特异性地高度表达人类PC细胞中,而在正常的前列腺中表达极低或不表达。因此DD3基因可能是一种早期诊断前列腺癌、判断其预后的有前途的标志物。本研究主要是观察尿液DD3mRNA定量检测联合分子生物学技术在前列腺癌诊治中的价值及其临床应用。
1 资料与方法
1.1 一般资料
选取我院2016年1月—2017年12月前列腺癌及前列腺增生患者作为研究对象,研究组为45例PC患者,年龄59~78岁,平均年龄为(68.72±8.49)岁;按照Gleason分级,将PC患者分为三组;其中,高分化癌16例,年龄62~74岁,平均年龄为(68.36±6.35)岁;中分化14例,年龄60~78岁,平均年龄为(69.85±8.36)岁;低分化15例,年龄59~75岁,平均年龄为(72.68±5.76)岁。将前列腺增生患者44例及非前列腺疾病者44例作为对照研究,年龄49~75岁,平均年龄为(68.28±6.21)岁。研究组与对照组患者在一般资料比较,差异无统计学意义(P>0.05),具有可比性。为避免主观因素的影响对所有研究对象采用双盲设计手机标本和进行检验。所有研究对象均签署知情同意书,本次研究通过医院医学伦理委员会同意批准。
1.2 方法
1.2.1 尿液标本留取 取研究对象经前列腺按摩后的全部尿液20~30 mL并立刻放入冰箱中进行冷却。在4℃ 3 000 rpm下进行离心10 min后去上清液收集尿沉渣。使用预冷D-hanks也洗涤两次后转移至1.5 mL冻存管中液氮保存。
1.2.2 RNA提取 取尿沉渣加入0.8 mL RNAiso Reagent后匀浆后在室温下静置5 min,加入1/5 RNAiso Reagent体积量的氯仿并剧烈震荡混匀,室温静置5分钟,然后再12 000 rpm 4℃下离心15 min,将上层水相等体积的异丙醇颠倒混匀,室温静置10 min,12 000 rpm 4℃离心10 min,去上清液用1 mL 78%预冷乙醇洗涤沉淀,12 000 rpm 4 ℃离心5 min,彻底去除乙醇得到的RNA沉淀,干燥后用适量的DEPC处理水溶液沉淀。
1.2.3 cDNA的合成 将尿液标本中提取到的总RNA再紫外线分光光度仪上测定其280 nm和260 nm的吸光度,从而判断RNA样本的纯度并对其进行定量分析。去总RNA 2 μg用于cDNA的合成。CDNA的合成20 μL逆转录反应体系。
1.2.4 分子生物学反应 逆转录聚合酶反应,使用20 μL PCR反应体系,并配制PCR反应液。其反应条件94℃ 2 min,1 Cycles;94℃ 30 sec、60℃ 30 sec、72℃ 1 min,各 30 Cycles。
琼脂糖凝胶电泳鉴定,先先进行电泳缓冲液,琼脂糖溶液,6×Loading Buffer等试剂的配制和准备。去PCR反应液5 μL进行琼脂糖凝胶电泳,确认PCR产物,同时进行半定量测定。
1.2.5 观察指标 观察三类患者尿DD3mRNA浓度、β-actin浓度、DD3相对定量的情况以及前列腺癌患者各临床特性的DD3mRNA相对定量值的情况。
1.3 统计学分析
采用SPSS 19.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,两个样本均数比较采用t检验,多于两组样本均数的比较,采用方差分析(ANOVA),以P<0.05表示差异具有统计学意义。
2 结果
2.1 运用生物学检测对相对定量测定的结果
前列腺癌患者尿DD3 mRNA的浓度、β-actin浓度、DD3相对定量值均高于非前列腺疾病者以及前列腺增生者,差异具有统计学意义(P<0.05),详情见表1。
表1 三类患者DD3mRNA的相对定量值比较(±s)

表1 三类患者DD3mRNA的相对定量值比较(±s)
类型DD3mRNA浓度 β-actin浓度 DD3相对定量非前列腺疾病者(n=44) 0.016±0.003 0.368±0.010 0.043±0.012前列腺良性增生(n=44) 0.020±0.008 0.321±0.009 0.077±0.021前列腺癌(n=45) 1.152±0.185 1.918±0.283 1.101±0.138 F值 9.278 11.542 3.875 P值 0.000 0.000 0.003
2.2 DD3mRNA相对定量值与前列腺癌患者临床病例特征的关系
低分化前列腺癌患者尿DD3 mRNA的相对定量值高于中分化、高分化者,差异具有统计学意义(P<0.01);血清PSA水平不同患者DD3m RNA的表达不同,血清PAS 4~10 mg/L的患者DDmRNA相对定量值最高(P<0.05);而不同临床分期的DD3mRNA相对定量值比较,差异无统计学意义(P>0.05);不同前列腺体积的DD3mRNA相对定量值比较,差异无统计学意义(P>0.05),详情见表2。
表2 DD3相对定量值与相关临床病例特征表(±s)
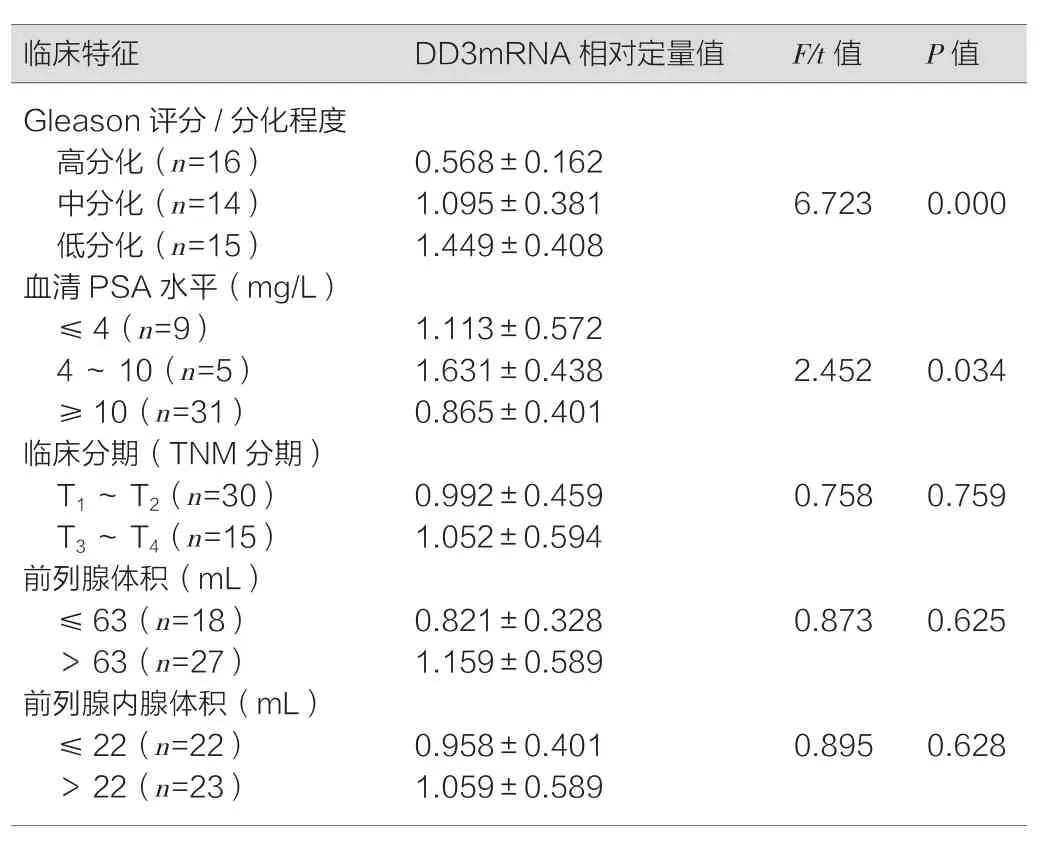
表2 DD3相对定量值与相关临床病例特征表(±s)
临床特征 DD3mRNA相对定量值 F/t值 P值Gleason评分/分化程度高分化(n=16) 0.568±0.162中分化(n=14) 1.095±0.381 6.723 0.000低分化(n=15) 1.449±0.408血清PSA水平(mg/L)≤4(n=9) 1.113±0.572 4~10(n=5) 1.631±0.438 2.452 0.034≥10(n=31) 0.865±0.401临床分期(TNM分期)T1~ T2(n=30) 0.992±0.459 0.758 0.759 T3~ T4(n=15) 1.052±0.594前列腺体积(mL)≤63(n=18) 0.821±0.328 0.873 0.625>63(n=27) 1.159±0.589前列腺内腺体积(mL)≤22(n=22) 0.958±0.401 0.895 0.628>22(n=23) 1.059±0.589
3 讨论
癌症患者生存率的提高有赖于疾病的早期诊断和治疗,但是由于前列腺癌在早期缺乏特异性临床表现[7]。患者就诊时多为失去根治机会的晚期病理或已经发生了骨肺转移[8],而前列腺癌是一种由治愈可能的恶性肿瘤,能够在早期诊断具有非常重要的意义。
国外研究PSA在0~4 ng/mL其假阳性率位25%,而假阳性率为38%~48%[9];同时当PSA正常时只有当直肠指诊怀疑前列腺癌,医院才会进行活检。通过多次临床试验显示,DRE能够发现15%左右的经PSA测定PSA<4.0 ng/mL的PC患者[10]。在血清PSA>4.0 ng/mL的人群中,经前列腺超声引导下活检诊断为前列腺癌患者只有27%,这就意味着有73%的前列腺穿刺活检着不能诊断为前列腺癌[11]。DD3基因是由Bussenmakers等人发现的一种PC特异基因。近年来人们分子生物学的研究方法发现了多种公认的PC标志物,在PC诊断中能够有较高的特异性,而DD3就是其中的一种,研究证实其在PC表达时显著增高[12]。研究发现尿液DD3mRNA定量检测联合分子生物学技术在前列腺癌诊治中具有重要的价值,通过逆转录聚合酶反应和琼脂糖凝胶电泳鉴定分子生物学技术,能够准确和快速的检测PC。在临床上PT-PCR技术在前列腺组织穿刺细胞学活检和体液(血液、尿液和前列腺按摩液)检测中应用,运用实时定量的RT-PCR技术,能够准确化的检查DD3[13]。其具有诊断前列腺癌和判断其预后的价值。国内陈占国等人研究发现,未治疗前列腺癌患者外周学DD3阳性率为100%,而前泪腺良性增生患者和正常人外周血DD3均为阴性。相比较而言尿液中DD3的检测标本更容易获得、更容易为患者接受。
本次研究发现,三类患者DD3mRNA的相对定量值有明显差异,前列腺患者是前列腺良性增生患者的25.6倍,而前列腺良性增生患者是非前列腺疾病患者的1.8倍。各个Gleason评分/分化程度中,DD3相对定量值有明显差异,分化程度越低(恶性程度越高),DD3相对定量值越高。在各个血清PSA水平级别之间,DD3相对定量值有差异。
因此,尿液DD3mRNA定量检测可以替代血清中tPSA检测成为前列腺癌筛查的检查指标。尿液DD3mRNA定量检测联合分子生物学技术在PC诊治中具有重要的价值。

