莱茵衣藻BBSome蛋白BBS2原核表达、纯化和多克隆抗体的制备及鉴定
董 彬 ,吴 松 ,程荣强 ,孟德梅 ,2,樊振川 *,2
(1.天津科技大学 食品工程与生物技术学院,教育部食品营养与安全重点实验室,天津300457;2.天津科技大学 新农村发展研究院,天津 300457)
巴-比二氏综合征 (Bardet-Biedl Syndrome,BBS)是一种由细胞纤毛功能障碍所引起的一类遗传病[1],其主要症状包括肥胖症[2],视网膜病变[3]及肾囊肿[4]等病症,因此是一类“纤毛病”。目前,在人体中鉴定出的与BBS有关的基因有12个(bbs1-12)[5],其中由bbs1/2/4/5/7/8/9编码的蛋白与BBIP10蛋白形成一个蛋白复合体称为BBSome[6]。研究表明BBSome在纤毛信号传导中起着重要作用,但与纤毛组装和维持并无关联。因此,阐明BBSome组装、纤毛运输和信号传导机理是攻克BBS的前提。由于纤毛在物种间高度保守,因此具纤毛单细胞微藻-莱茵衣藻很早以来就已被用作一种模式生物用于研究纤毛组装、维持和信号传导。多项研究表明,莱茵衣藻BBSome定位于细胞基体和纤毛内,是由7个 BBSome 蛋白亚体包括 BBS1,2,4,5,6,8 和 9 组成的蛋白复合物,其进入纤毛严格依赖于纤毛内运送体系统(Intra Flagellar Transport,IFT)的完整[7-8],在这一运输过程中,BBSome作为一个纤毛货物蛋白和IFT相偶联[9]。除此之外,由于缺少莱茵衣藻BBSome突变体及其相对应的抗体,使得对这些基因及其蛋白产物在BBSome组装和纤毛运输中的功能研究难以继续。
BBS2是BBSome众多蛋白亚体中非常保守的一个组分,其突变可导致视网膜病变,摄食增多型的肥胖及肾囊肿的形成[10]。目前,莱茵衣藻BBS1、BBS4和BBS7突变体已经被鉴定,缺少这些蛋白亚体均可导致BBSome解聚,使得纤毛信号传导蛋白在纤毛内过度聚集[6]。因此人们推测这就是导致BBS的原因。利用莱茵衣藻来研究bbs2在纤毛信号传导中的功能,将会对完全阐明人类bbs2的功能提供基础,对BBS病因的探索具有重要的理论意义。
由于国际上目前还没有针对莱茵衣藻BBS2蛋白的抗体可用,因此制备高特异性和灵敏性的莱茵衣藻BBS2抗体就成为了阐明BBS2在BBSome组装和纤毛信号传导中的功能的关键因素之一。本文作者采用了简单经济的原核表达方法第一次制备了高纯度的莱茵衣藻BBS2部分蛋白抗原,利用高浓度尿素溶解法对其进行了可融化处理,进而利用新西兰大白兔为免疫动物制备出了抗莱茵衣藻BBS2的多克隆抗体。利用Western blotting和免疫荧光染色等方法进行的检测鉴定表明该多克隆抗体能特异性识别莱茵衣藻BBS2蛋白,从而为全面鉴定BBS2在BBSome组装和纤毛信号传导中的功能和最终理解BBS致病分子机理提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒大肠杆菌 (Escherichia coli)XL1-blue和BL21(DE3)菌株以及重组质粒pMAL-c2x-bbs2和pET28a为本实验室保存。莱茵衣藻藻种CC-125购自美国莱茵衣藻中心(www.chlamy.org)。
1.1.2 主要试剂限制性内切酶HindIII和BamH I、pfuDNA聚合酶、T4 DNA连接酶和蛋白Marker等均购自美国Thermo公司;1 Kb DNA Marker购自北京全式金公司;质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒、DNA产物纯化试剂盒、卡那霉素、IPTG购自北京索莱宝生物科技有限公司;Ni SepharoseTM6 Fast Flow蛋白纯化介质和Protein A SepharoseTMCL-4B抗体纯化介质均购自美国GE Healthcare公司;NC膜购自美国PALL公司;弗式完全佐剂和不完全佐剂均购自美国Sigma公司;过氧根辣酶 (HRP)标记的羊抗兔抗体购自美国Jackson immunoresearch公司;ECL显色试剂购自美国Millipore公司,其他试剂均为国产分析纯试剂。
1.1.3 实验动物新西兰雄性大白兔2只,体重1.5~2.0 kg,由天津欧阳实验种兔场提供。
1.2 方法
1.2.1 pET28A-bbs2原核表达载体构建以pMAL-c2x-bbs2为模板和5'-AGGGATCCATGCT CGTGCCGGCCTTC-3'(5'-引入BamH I酶切位点)和5'-AGAAGCTTCTGTATTGAGCAGTTCCCG-3'(5'-端引入HindIII酶切位点)为引物扩增BBS2基因5'端399 bp的cDNA序列。所得DNA片段用DNA产物回收试剂盒回收后进行BamH I和HindIII双酶切。酶切产物用琼脂糖凝胶DNA回收试剂盒回收后与BamH I和HindIII双酶切的载体pET28a进行连接。将连接产物转入E.coliXL1-blue感受态细胞,将转化细胞涂布于LB平板 (含100 μg/mL卡那霉素)过夜培养以进行抗性菌落筛选,挑取抗性菌落于LB液体培养基中过夜培养,提取质粒并对其进行酶切和核酸测序进行验证,验证正确的重组质粒命名为pET28a-bbs2。PCR扩增反应条件为:95 ℃ 1 min;95 ℃ 30 s、57 ℃ 30 s、72 ℃40 s,30个循环。尔后取2 μL PCR产物在0.8%的琼脂糖凝胶中进行电泳分析。
1.2.2 6×His-BBS2融合蛋白的诱导表达及鉴定将pET28a-bbs2转化至大肠杆菌BL21(DE3)进行铺板培养,挑取新鲜单菌落于LB液体培养基中(含100 μg/mL 卡那霉素)过夜培养,再以 1∶20 的比例放大进行培养,直至其OD值位于0.6~0.8区间,尔后加入终浓度为0.2 mmol/L的IPTG在28℃温度条件下诱导6 h使重组蛋白6×His-BBS2大量表达,同时设置不加IPTG诱导的对照组。最后,离心收集菌体并用超声波对其进行裂解以获得全蛋白。对全蛋白经离心(12 000 r/min,15 min,4 ℃)收集上清和沉淀。最后分别取全蛋白、上清和沉淀与2×蛋白上样缓冲液进行混合,尔后在12%的SDS-PAGE中对其进行电泳检测。
1.2.3 6×His-BBS2融合蛋白的纯化将离心回收后的沉淀用2 mol/L尿素溶液漂洗3次,然后高速离心回收沉淀(12 000 r/min,15 min,4 ℃)并使之溶解于8 mol/L尿素溶液中。用0.45 μm滤膜过滤溶液后加入用含有8 mol/L尿素平衡液 (50 mmol/L Tris-HCl,500 mmol/L NaCl,pH 7.4) 预平衡好的 Ni Sepharose High Performance纯化柱,并于室温使其结合1 h。尔后使样品流经纯化柱,并用含有8 mol/L 尿素平衡液 (50 mmol/L Tris-HCl,500 mmol/L NaCl,pH 7.4)作为洗涤缓冲液漂洗五次以去除杂蛋白,最后用含有8 mol/L尿素的洗脱缓冲液(50 mmol/L Tris-HCl,500 mmol/L NaCl,500 mmol/L imidazole,pH 7.4)洗脱并收集目的蛋白并将洗脱出的目的蛋白进行SDS-PAGE蛋白电泳分析[12-13]。对于纯化得到的6×His-BBS2不进行溶液置换或透析,直接将其以含有8 mol/L尿素的变性蛋白形式进行免疫,利用微量蛋白测定仪测定蛋白浓度,并稀释其到终浓度为1 mg/mL准备免疫。
1.2.4 多克隆抗体的制备每个抗原免疫两只兔子,实验所用兔子为3月龄、体重在1.5~2 kg的雄性新西兰大白兔,在本实验室动物房适应1周后进行第1次免疫,采用皮下多点注射的方式免疫,每只兔子每次免疫1 mg抗原,初次免疫前耳部取血[14]作为后期实验阴性对照,取2 mL纯化后的6×His-BBS2融合蛋白(1mg/mL)与2 mL弗氏佐剂等体积混合后乳化完全,免疫新西兰大白兔,采用颈背部多点注射法。其后每10 d依照此剂量进行一次加强免疫,但乳化剂改为弗氏不完全佐剂,一共加强免疫4次,第5次免疫后抽取耳动脉血,测定抗血清的效价。效价合格后,采用心脏穿刺法收集全血,4℃静置过夜后在4 000 r/min的条件下离心30 min,去除沉淀血浆从而收集抗血清,按每毫升分装冻存于-80℃。
1.2.5 多克隆抗体效价的检测采用间接ELISA法测定抗血清的效价,以纯化后的6×His-BBS2融合蛋白作为包被抗原,用5%的脱脂牛奶37℃封闭1 h,随后,加入经PBS溶液(pH 7.5)梯度稀释的兔血清37℃孵育1 h;加入经PBS溶液(pH 7.5)稀释20 000倍的辣根过氧化物酶标记的羊抗兔二抗,37 ℃孵育 30 min;然后加入 TMB(3′,3′,5′,5′,-四甲基联苯胺)显色液,室温避光显色30 min,最后加入0.5 mol/L H2SO4终止液,终止反应。利用酶标仪测定OD450处的吸光值,并计算出抗血清的效价,实验组血清OD450阴性对照血清OD450≥2.0为阳性,其最高稀释度即为抗血清的效价[15-16]。
1.2.6 多克隆抗体的纯化使用Protein A SepharoseTMCL-4B亲和纯化专一性吸附抗血清中的IgG,去除IgG之外的其他抗体分子,纯化条件为:结合缓冲液 (12 mmol/L Na2HPO4,8 mmol/L NaH2PO4,pH 7.0),洗脱缓冲液(0.1 mol/L 甘氨酸,pH 2.7),流速0.5 mL/min。收集吸收峰对应的洗脱液,用 1 mol/L Tris-HCl(pH=9.0)将洗脱液 pH 值调至中性,经Western blotting检测多克隆抗体的特异性[17]。
1.2.7 免疫印迹法检测多克隆抗体的特异性取1 mL培养至对数期(2×106cell/mL)的CC-125细胞藻液,在2 500 r/min条件下于室温离心2 min,移除上清,加入 60 μL Buffer A(0.1 mol/L Na2CO3,0.1 mol/L DTT), 随后加入 40 μL Buffer B (5%SDS,30%Sucrose)。样品随后于4℃在恒温震荡仪中震荡45 min(2 000 r/min),以使细胞充分裂解。细胞裂解液随后于4℃和12 000 r/min离心条件下离心5 min,尔后移取上清至新的EP管待定量和上样。蛋白定量按照Amido black的传统方法[19]进行。取20 μg细胞全蛋白,加入 5×Loading Buffer,沸水浴 5 min,12 000 r/min离心5 min,上样,进行SDS-PAGE电泳(150 V,1.5 h),结束后进行湿法转膜(50 V,45 min),然后,用5%的脱脂奶粉封闭;多克隆抗体稀释度1∶5 000,二抗辣根过氧化物酶(HRP)标记的羊抗兔 IgG(Jackson,Cat.No.111-035-003),稀释度为1∶100 00,之后在暗室向膜上加入ECL显色液[18](Millipore,Cat.No.WBKLS0500),反应 3 min 后,使用暗盒压片(压片时间为1 min),显影,定影,晾干拍照。
1.2.8 免疫荧光法检测多克隆抗体的特异性取30~50 μL 培养至对数期 (2×106cell/mL) 的衣藻CC-125细胞藻液,对细胞进行计数,2 500 r/min离心丢弃上清,用新鲜培养基重悬。 取50 μL的细胞,加入等体积的4%PFA,室温固定5 min。2 500 r/min离心 1 min,离心丢弃上清,加入 100 μL PBS缓冲液重悬。取50 μL细胞滴在干净的载玻片中,室温放置5 min。吸干上层液体,将玻片放入-20℃的甲醇中固定1 min。取出玻片晾干,加入PBS缓冲液处理5 min,使细胞水化。吸走缓冲液,向玻片滴加 25 μL 5%BSA进行封闭,4℃封闭1 h。加入稀释的一抗 (1∶50),25 μL,4 ℃,2 h, 用 PBS (含有0.2%Tween-20)洗3次,每次5 min,加入稀释的荧光标记的羊抗兔二抗(1∶400,Invitrogen,Alexa Fluor 594 dye),4 ℃反应 2 h。 用 PBS(含有 0.2%Tween-20)洗3次,每次5 min,最后用超纯水洗一次去除盐分。在载玻片上滴加抗荧光淬灭封片剂(索来宝,抗荧光衰减封片剂),盖上洗干净的盖玻片,用指甲油把盖玻片四周固定,黑暗中干燥 2 h以上,使其凝固,用荧光显微镜拍照[20]。
2 结果与分析
2.1 pET28a-bbs2原核表达载体的构建
以pMAL-c2x-bbs2为模板,利用PCR扩增获得bbs2基因5′端大小为399 bp的cDNA片段 (编码 133个氨基酸)(见图 1(a))。将空表达载体pET28a用BamH I和HindIII双酶切,回收片段并进行电泳验证(见图1(b))。进行连接反应获得重组表达质粒pET28a-bbs2后对其进行双酶切鉴定(见图1(c)),可获得条带大小为399 bp的目的片段和5 kb的载体片段,该质粒经测序验证其插入序列完全正确,说明表达载体构建成功。
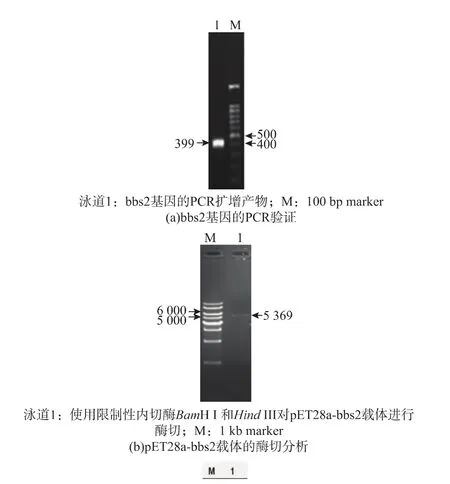
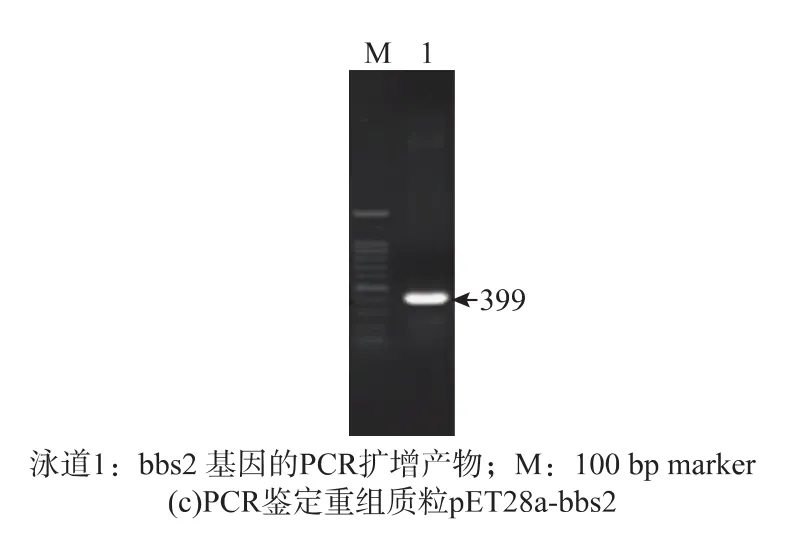
图1 bbs2的PCR扩增和重组表达质粒的验证Fig.1 PCR amplication of bbs2 and identification of recombinantexpression plasmid by restriction digestion
2.2 6×His-BBS2融合蛋白的诱导表达鉴定
在IPTG的诱导下,含有pET28a-bbs2质粒的大肠杆菌BL21(DE3)菌株会大量表达目的蛋白,菌体经超声破碎后获得全蛋白,所得全蛋白经低温高速离心分离上清和沉淀,然后经电泳、染色、脱色后分别在约15 kDa处可以看到目的蛋白大量表达,且蛋白的表达主要以包涵体的形式存在。其表达结果如图2所示。
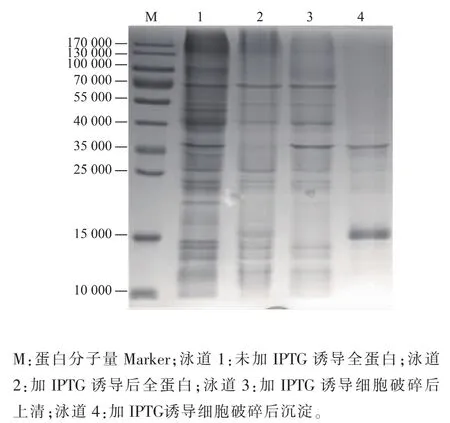
图 2 SDS-PAGE检测重组蛋白 6×His-BBS在 E.coli BL21(DE3)中的表达Fig.2 SDS-PAGE analysis of the expression of recombinant protein 6×His-BBS in E.coli BL21(DE3)
2.3 6×His-BBS2融合蛋白的纯化
由上述可知6×His-BBS2融合蛋白的表达主要在沉淀中,因此将诱导表达后的菌体经超声破碎以及高速离心后取沉淀,溶解于8 mol/L尿素于Ni Sepharose High Performance纯化柱中进行亲和纯化,由于融合蛋白所含有的6×His标签能够特异性与上述填料结合,因此经过洗涤、洗脱等步骤,即得到比较单一的的目的蛋白(如图3所示),可作为免疫动物所用抗原。
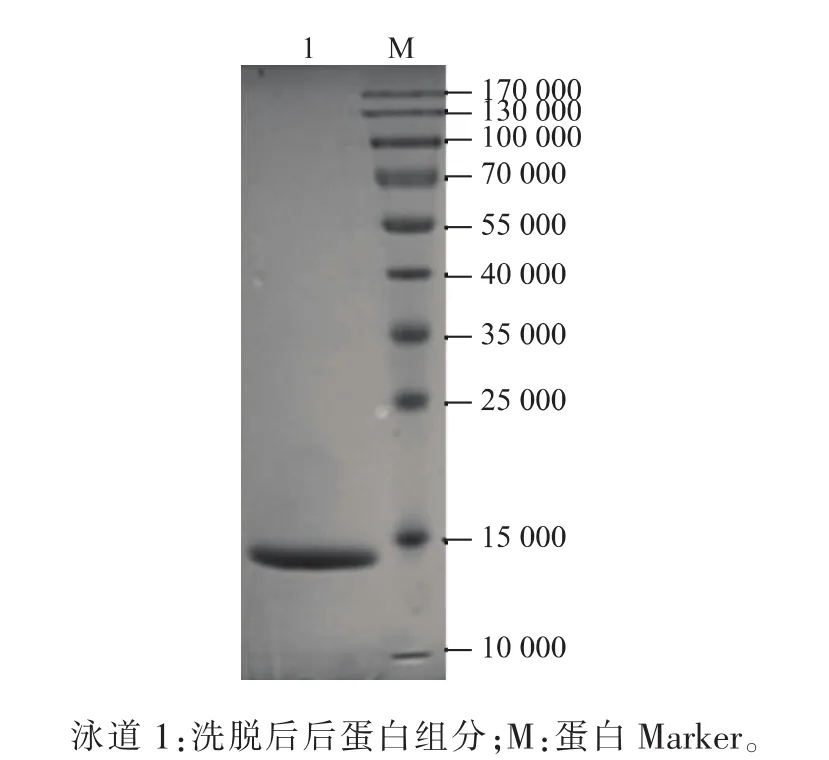
图3 SDS-PAGE检测亲和纯化后6×His-BBS2重组蛋白Fig.3 SDS-PAGE analysis of the purified 6×His-BBS2 recombinant protein by affinity adsorption purification
2.4 抗血清效价的检测
用纯化得到的6×His-BBS2融合蛋白免疫新西兰大白兔,经耳缘静脉少量采血,室温静置2 h或4℃过夜后获得析出血清,以间接ELISA法测定抗血清的效价,利用酶标仪测定OD450处的吸光值后计算出抗血清的效价,结果见图4。
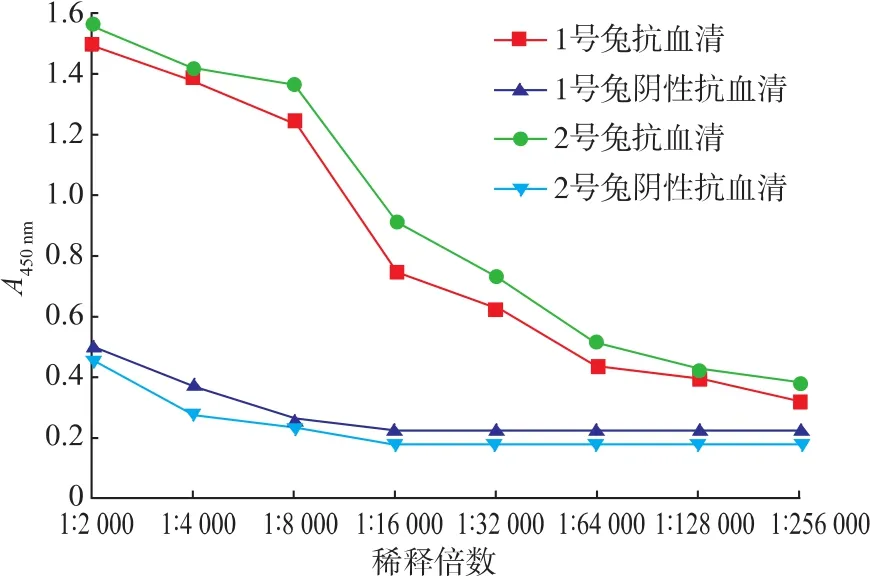
图4 间接ELISA法测定抗血清的效价Fig.4 Results of ELISA test of anti-BBS2 polyclonal antiserum
以实验组血清OD450与阴性对照血清OD450的比值大于2即为阳性,其最高稀释度即为抗血清的效价,如图4可知1号兔抗血清的效价大于128 000,2号兔抗血清效价大于256 000,满足实验要求。
2.5 抗血清纯度和特异性检测
所得的抗血清由于含有多种抗体分子因此需要进行纯化,本研究进行Protein A纯化,以得到抗血清中的IgG。对纯化得到的IgG进行电泳,在丙烯酰胺凝胶上25 kDa及55 kDa左右可见两条明显条带并且基本没有其它杂带,表明得到了纯度较高的IgG,结果如图5所示。ECL曝光法(图6)显示,抗血清能够正确的与56 kDa大小的BBS2蛋白特异结合,证明所制备的多克隆抗体具有很好的特异性,可与免疫原专一性结合。
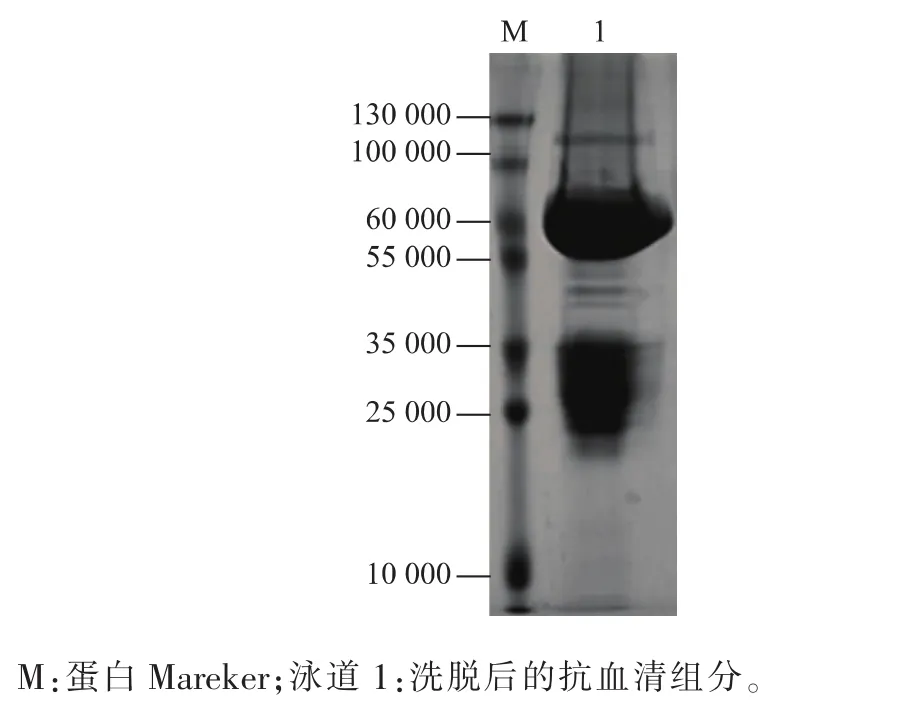
图5 BBS2的抗体经Protein A纯化Fig.5 Anti-BBS2 antiserum purified by Protein A
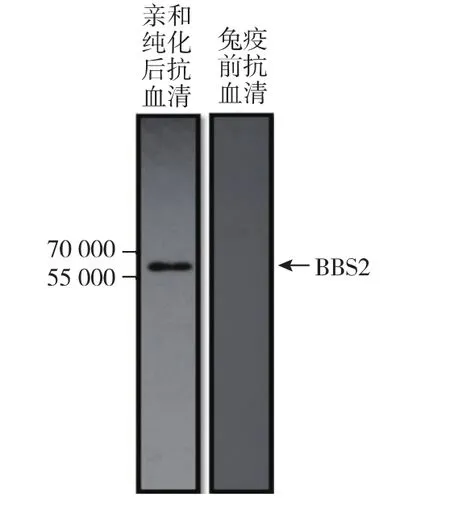
图6 Western blotting验证抗体特异性-ECL曝光法Fig.6 Antibody specificity detected by Western blotting through ECL method
2.6 免疫荧光法检测BBS2的定位及抗体的活性
免疫荧光实验检测的是细胞内没有发生变性的活性蛋白,对抗体特异性的要求更高,本实验抗体制备所用免疫抗原为8 mol/L尿素处理后的变性蛋白,为了进一步确定其产生的抗体是否具有生物活性,特对其进行免疫荧光实验。结果如图7所示,可以看到BBS2的抗体能够与莱茵衣藻BBS2蛋白特异性结合,且结合处主要位于纤毛的基体,表明BBS2蛋白主要定位在纤毛基体,少部分沿纤毛呈点状分布,与IFT复合物的定位结果相一致。
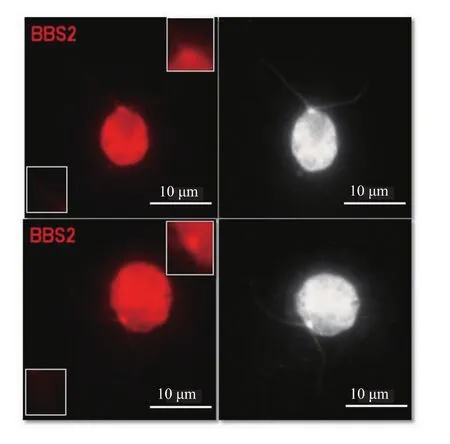
图7 免疫荧光检测BBS2蛋白在莱茵衣藻纤毛中的定位Fig.7 Immun of luorescence analysis the flagella localization of BBS2
3 讨论
为了研究BBsome在纤毛中的装配机制,本文制备了在莱茵衣藻中的高特异性和高灵敏度的BBS2抗体。首先在大肠杆菌中经IPTG诱导大量表达BBS2,然后用多步纯化获得高纯度的6×His-BBS2融合蛋白,并作为抗原免疫新西兰大白兔获得抗血清。虽然本研究使用的是bbs2基因的N端的133个氨基酸序列,且其在大肠杆菌中表达后主要以包涵体的形式存在,但使用尿素溶解进行纯化后能得到高纯度的蛋白,通过ECL曝光的方法检测了所制备多克隆抗体的特异性和灵敏度,获得的抗血清经过亲和纯化后所得抗体的特异性和灵敏度极高。在本实验中,使用6×His作为纯化标签是抗体特异性高的一个有利条件,由于其只有6个组氨酸构成,分子量较小,在动物机体中引起的免疫反应较一些分子量大的标签要小一些,产生的抗体特异性也会更高一些。其次,抗原的好坏与抗原决定簇有关,大部分抗原决定簇是亲水性的,且许多已知的抗原决定簇是在自由活动区域的,因此,一般来说蛋白质的N端及C端是很好的抗原决定簇区域。使用bbs2基因N端的133个氨基酸序列,虽然其表达后呈水不溶性,但经序列分析后发现其亲水性相比较其它位置序列仍然较高。同时,水不溶性的抗原在纯化过程中一直处于高浓度尿素中,使其充分变性溶解才能进行后续的亲和纯化,因而得到比较单一的纯化后蛋白作为免疫抗原进行后续实验,也是最终抗体制备成功的关键因素。此外,本实验所制备的BBS2抗体可以很好地用于免疫荧光实验,实验结果显示BBS2抗体能够专一性地与莱茵衣藻BBS2蛋白结合,且发现BBS2蛋白主要定位在纤毛基体,极少部分沿纤毛呈点状分布,与文献[6]结果一致。该部分结果表明BBS2与BBS4在纤毛中的分布一致是BBSome的一个组分。该抗体对进一步研究BBS2蛋白在纤毛的形成、与其他IFT蛋白的相互作用及BBS等纤毛病的发病机理都具有重要的意义。目前,不可溶蛋白作为抗原进行多克隆抗体制备仍然没有固定的规律遵循,其因蛋白性质的不同而千差万别。
4 结 语
本研究成功制备出莱茵衣藻BBS2蛋白多克隆抗体,并具有较高的效价和强特异性,将对BBS2及BBSome蛋白复合物在纤毛装配及组装的研究奠定基础。

