卵巢移位术后增敏化疗联合放疗对宫颈癌患者围绝经期症状、性激素及卵巢功能的影响
莫文杰 罗传文 黄金汉 徐 升 唐 浩 赖 琳
(湖北省恩施土家族苗族自治州中心医院肿瘤放疗中心,恩施州 445000,电子邮箱:zmhllhfl@sina.com)
近年来,宫颈癌已成为妇科最常见的恶性肿瘤,其发病率仅次于乳腺癌和结直肠癌,每年新发病例近50万,死亡病例近27万[1]。目前,宫颈癌发病呈年轻化趋势。对于早期宫颈癌患者,如何在治疗疾病的同时有效保留卵巢功能和生育能力是临床上极为关注的问题之一。卵巢作为机体重要的性激素分泌器官,盆腔的放射治疗会损害其功能,严重影响年轻患者的生活质量[2]。因此,为了使放疗不影响患者卵巢的功能,临床上常采用卵巢移位手术将卵巢移出放射野[3]。本文探讨卵巢移位术后增敏化疗联合放疗对宫颈癌患者围绝经期症状、血清卵泡刺激素(follicle-stimulating hormone,FSH)、雌二醇及黄体生成素(luteinizing hormone,LH)及卵巢功能的影响,现报告如下。
1 资料与方法
1.1 临床资料 回顾性分析我院2015年1月至2016年10月收治的105例行卵巢移位术后ⅠB1~ⅡA2期宫颈癌患者的临床资料。纳入标准:(1)经病理活检证实为宫颈鳞状细胞癌,根据2009年国际妇产科协会临床分期标准[3]诊断为早期宫颈癌;(2)行卵巢移位手术,移位卵巢距离髂总动脉分叉2 cm以上;(3)年龄<45岁。排除标准:(1)既往接受过盆腔放疗及化疗者;(2)发生癌转移者;(3)药物过敏者;(4)严重肾功能衰竭患者;(5)妊娠或哺乳期妇女;(6)资料不全或不配合者。所有患者术后均给予增敏化疗,其中59例患者(观察组)术后病理结果提示存在肿瘤浸润深肌层、宫旁或阴道切缘阳性、淋巴结转移、分化程度低、脉管癌栓阳性等高危因素,术后联合放疗,其余46例患者(对照组)术后未联合放疗。观察组年龄27~44(33.1±2.4)岁,疾病分期ⅠB1期24例,ⅠB2期14例,ⅡA1期13例,ⅡA2期8例。对照组25~44(32.7±2.8)岁,疾病分期ⅠB1期19例,ⅠB2期11例,ⅡA1期10例,ⅡA2期6例。两组患者的疾病分期、年龄等资料比较,差异均无统计学意义(均P>0.05),具有可比性。本研究通过本院医学伦理委员会批准,所有患者及家属知情同意。
1.2 治疗方法 (1)手术治疗:所有患者在评估卵巢状态后行腹腔镜下或开腹宫颈癌根治术及卵巢移位术。术中钳断卵巢固有韧带,游离一侧或双侧卵巢动静脉,游离长度为10~12 cm,采用0.9%氯化钠溶液纱布包裹输卵管切除侧卵巢,待卵巢移位准备完毕后行行子宫切除术+盆腔淋巴结清扫术;然后继续游离卵巢动静脉,游离长度为15 cm,将已包裹卵巢向右上方旋转,沿结肠侧沟腹膜外间隙上行后穿过后腹膜,刺穿腹膜后进入腹腔内,将其固定于脾下缘水平,骨盆漏斗韧带固定腹膜数针,尽量避免固定于放射治疗照射区内,确认无血管阻塞,避免卵巢动静脉扭转。(2)观察组术后进行同步放化疗:采用瓦里安直线加速器进行外照射治疗,总剂量为45~50 Gy,分25次完成,5次/周;采用铱源后装腔内治疗机进行腔内近距离照射,治疗总剂量为20 Gy,分4次完成,2次/周;同时给予同步化疗,顺铂30 mg/m2静脉滴注,1次/周,共5次。(3)对照组术后单纯行放射治疗,放疗外照射方法及腔内近距离照射方法同观察组。
1.3 观察指标 (1)比较两组患者围绝经期症状:治疗后6个月对患者进行随访,根据Kupperman绝经指数(Kupperman menopause index,KMI)[4]判断患者术后围绝经期症状,KMI 评分表共包含13种症状,即潮热汗出、感觉障碍、失眠、易激动、抑郁疑心、眩晕、疲乏、骨关节痛、头痛、心悸、皮肤蚁走感、性生活下降和泌尿系感染,严重程度分4个等级,其中0分为无该项症状,1分、2分、3分分别视为轻、中、重度症状。计算总分时,潮热出汗症状加权分为4分,感觉异常、失眠、易激动、性生活异常及泌尿系统感染症状加权分为2分,其余的症状加权分为1分,KMI评分≥15分则诊断为出现围绝经期症状。(2)比较两组患者卵巢功能保留情况:治疗后6个月根据KMI评分和血清FSH值判断卵巢功能,FSH值<10 mIU/ml为卵巢功能正常,FSH值在10~40 mIU/ml且出现围绝经期症状为卵巢功能衰退,FSH值>40 mIU/ml为卵巢功能丧失。(3)于治疗前和治疗后6个月采用放射免疫法患者的FSH、雌二醇及LH水平。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。符合正态分布的计量资料以(x±s)表示,比较采用t检验;计数资料以例数和百分比表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 治疗后两组患者围绝经期症状发生情况比较 治疗后6个月,对照组和观察组分别有4例(8.70%)和30例(50.85%)患者出现围绝经期症状,对照组围绝经期症状发生率低于观察组(χ2=20.975,P<0.001)。
2.2 治疗前后两组患者FSH、雌二醇、LH水平比较 治疗前,两组患者FSH、雌二醇、LH水平比较,差异均无统计学意义(均P>0.05)。治疗后,观察组FSH和LH水平均高于治疗前及对照组水平,雌二醇水平低于治疗前及对照组水平(均P<0.05)。见表1。
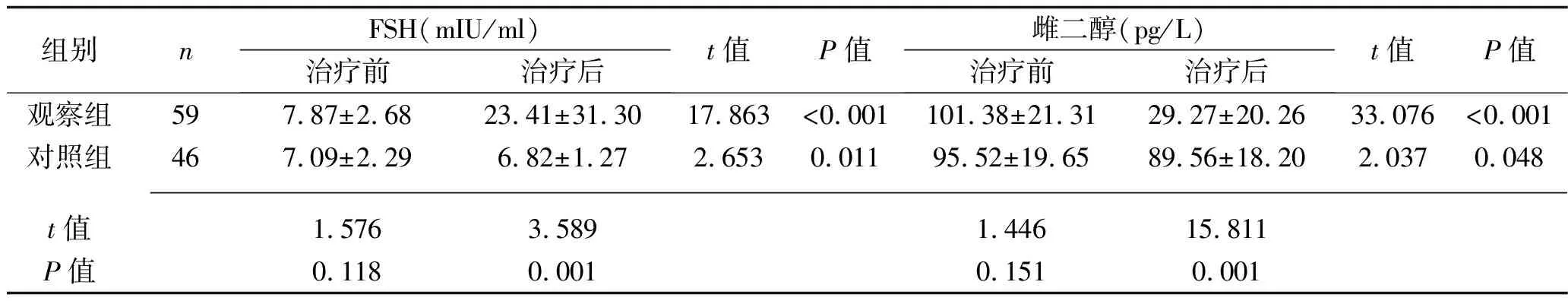
表1 治疗前后两组患者FSH、雌二醇、LH水平比较(x±s)
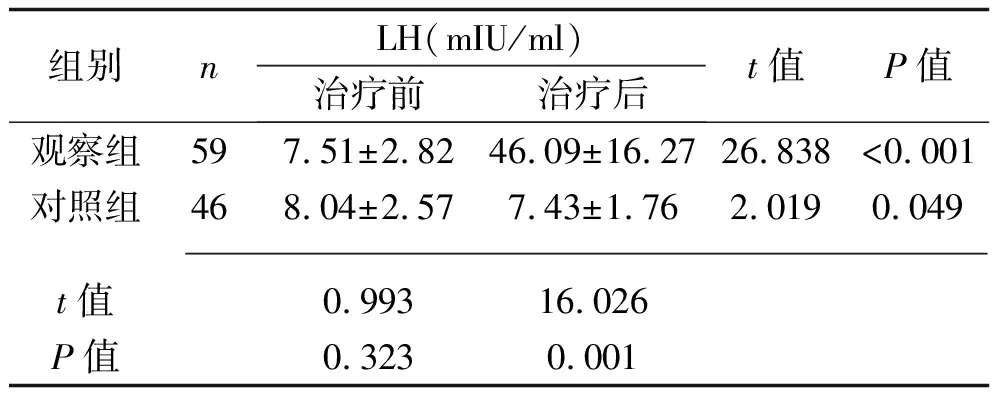
组别nLH(mIU/ml)治疗前治疗后t值P值观察组597.51±2.8246.09±16.2726.838<0.001对照组468.04±2.577.43±1.762.0190.049 t值0.99316.026P值0.3230.001
2.3 治疗后两组患者卵巢功能保留情况比较 观察组患者卵巢功能正常率低于对照组,卵巢功能衰退率及卵巢功能丧失率均高于对照组(均P<0.05)。见表2。
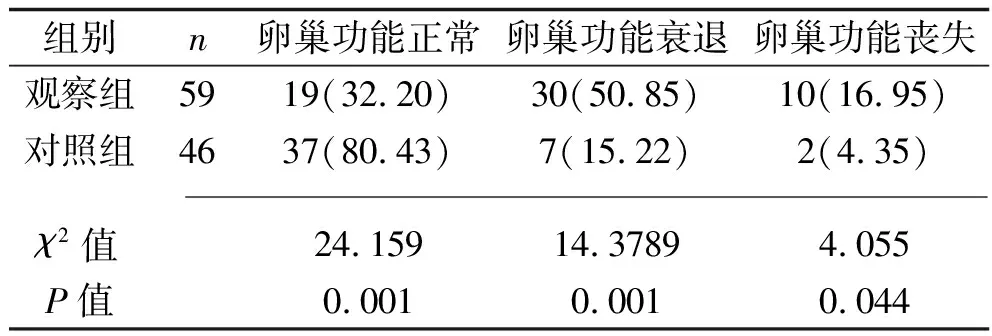
表2 两组患者卵巢功能保留情况比较[n(%)]
3 讨 论
宫颈癌作为妇科最常见的生殖系统恶性肿瘤,其发病率及死亡率较高,且发病呈年轻化趋势[5]。目前宫颈癌的发病机制尚不清楚,可能是多因素作用的结果,与分娩次数、病毒感染、性行为及其他行为和生物学因素等均有关[6]。
治疗宫颈癌的主要手段是放射治疗和手术切除。而近年来,增敏化疗联合放疗的临床效果得到了肯定,其作用机制之一是化疗药物对放疗有增敏作用,能够显著缩小肿瘤体积,降低宫颈癌远处转移率,从而提高放疗疗效[7]。目前,放射治疗几乎应用于三分之二癌症患者的治疗中,但术后辅助放射治疗对卵巢功能影响较大。经常辐照可导致年轻宫颈癌患者出现卵巢衰竭等远期不良后果。放射剂量达到250~300 cGy时患者卵巢功能可永久丧失,甚至可能导致终生不孕。治疗肿瘤的同时需改善患者的生活质量是目前宫颈癌的治疗原则,既要尽量彻底地切除肿瘤以减少复发和转移,同时还要考虑患者的生理和心理是否受到影响。因此,对于年轻的早期宫颈癌患者应该尽可能地保留卵巢,以维持其体内的正常内分泌功能,减少由激素水平下降所带来的神经系统、内分泌系统及心血管系统的并发症。对此,有学者提出对于早期年轻宫颈癌患者,可采取卵巢移位术后行放射治疗,以减小卵巢照射量,防止放射治疗导致卵巢功能损害,从而保护卵巢功能[8]。卵巢移位术是通过卵巢移位并固定于盆腔外的腹腔,从而降低术后放疗对卵巢功能的损害[9]。
FSH由垂体分泌,对促进卵子成熟和排卵具有重要影响,其水平的变化能直接反映卵巢功能状态变化[10]。LH是一种由腺垂体嗜碱粒细胞分泌的激素,与FSH合称为促性腺激素,两者可协同调节女性月经周期,并影响雌激素分泌[11]。雌二醇由卵巢黄体分泌,其主要作用为增进和调节性器官的正常发育及维持子宫内膜形态,而高强度放射治疗对卵巢功能的伤害会明显降低雌二醇的分泌[12]。本研究结果显示,治疗后,观察组FSH和LH水平均高于治疗前及对照组水平,雌二醇水平低于治疗前及对照组水平(均P<0.05),提示卵巢移位后行增敏化疗联合放疗可影响卵巢内分泌功能,使血清性激素水平异常。此外,两组均有患者出现卵巢功能衰退或丧失,而观察组患者卵巢功能正常率低于对照组,卵巢功能衰退率及卵巢功能丧失率均高于对照组(P<0.05),且围绝经期症状发生率高于对照组(P<0.05)。提示在卵巢移位手术后行联合放疗的患者卵巢功能均有一定程度下降,而术后行增敏化疗联合放疗对卵巢功能影响更大,患者卵巢功能衰退更为明显,说明盆腔放化疗可能是影响卵巢功能的主要原因。值得注意的是,卵巢移位手术本身即有可能导致卵巢功能衰退,因此应严格控制手术指征,谨慎选择行卵巢移位手术的对象。术中触及肿大淋巴结或前哨淋巴结阳性、肿瘤直径超过4 cm、宫颈活检发现脉管内癌栓等,均提示术后联合放疗可能性大,如有合并以上高危因素的年轻患者,应积极行卵巢移位手术。
综上所述,与术后单纯放疗比较,卵巢移位术后行增敏化疗联合放疗的患者围绝经期症状发生率更高,血清性激素水平紊乱及卵巢功能减退更为明显。

