不同新辅助化疗方案的选择对乳腺癌患者生存的影响
段海瑞
【摘要】 目的:探究两种不同新辅助化疗方案对乳腺癌患者近期疗效及生存率的影响。方法:选取2016年3月-2017年3月笔者所在医院诊治的乳腺癌患者74例,按新辅助化疗方案的不同分为TE组(37例)和TEC组(37例)。TE组患者采用多西他赛+表柔比星(TE方案)进行化疗,TEC组患者在TE组基础上加用环磷酰胺(TEC方案)进行治疗。比较两组患者近期疗效及2年生存率。结果:TE组治疗总有效率为78.38%,TEC治疗总有效率为81.08%,两组比较差异无统计学意义(P>0.05)。TEC组2年生存率为91.89%,高于TE组的72.97%,差异有统计学意义(P<0.05)。结论:TE方案与TEC方案治疗乳腺癌的临床疗效相当,但TEC方案治疗乳腺癌的2年生存率更高。
【关键词】 新辅助化疗 乳腺癌 生存 TE TEC
[Abstract] Objective: To investigate the effect of two different neoadjuvant chemotherapy regimens on the short-term efficacy and survival rate of breast cancer patients. Method: A total of 74 patients with breast cancer diagnosed and treated in our hospital from March 2016 to March 2017 were selected. They were divided into the TE group (n=37) and the TEC group (n=37) according to different neoadjuvant chemotherapy regimens. The TE group received Docetaxel and Epirubicin (TE regimen) for chemotherapy, while the TEC group received Cyclophosphamide (TEC regimen) for treatment on the basis of TE group. The short-term efficacy and 2-year survival rate were compared between the two groups. Result: The total effective rate of TE group was 78.38%, and 81.08% of TEC group. There was no significant difference between the two groups (P>0.05). The 2-year survival rate in TEC group was 91.89%, which was higher than 72.97% in TE group, the difference was statistically significant (P<0.05). Conclusion: The clinical efficacy of TE regimen is similar to that of TEC regimen for breast cancer, but the 2-year survival rate of TEC regimen for breast cancer is higher.
乳腺癌是常见的恶性肿瘤之一,其发病率较高,但病因至今尚未明确。目前,新辅助化疗已经成为治疗乳腺癌局部进展期的首选[1]。对于晚期恶性肿瘤患者,在无法进行手术治疗时,新辅助化疗可缩小患者肿瘤体积,是临床治疗晚期乳腺癌的首选方法[2]。新辅助化疗方案在目前临床上对于治疗乳腺癌的认知尚未达成统一,紫杉类、蒽环类药物是组成新辅助化疗治疗的常见药物[3-4]。基于此,笔者对此进行了相关研究,探究新辅助化疗不同方案的选择对患者生存的影响,旨在为临床中该病患者治疗时选择何种治疗方案提供依据与支持,现将研究结果报道如下。
1 资料与方法
1.1 一般资料
选取2016年3月-2017年3月于笔者所在醫院诊治的乳腺癌患者74例,患者入院后均经病理学检验确诊为乳腺癌,且均为女性。根据2010年AJCC乳腺癌第7版TNM分期分为:Ⅰ期22例,Ⅱ期34例,Ⅲ期18例。纳入标准:(1)经临床诊断确诊为乳腺癌;(2)可测量肿块大小;(3)诊断肿瘤无转移。排除标准:病灶转移或脏器官功能严重受损者。将其随机分为TE组(37例)及TEC组(37例),其中TE组患者年龄25~66岁,平均(46.14±12.36)岁;TNM分期:Ⅰ期12例,Ⅱ期15例,Ⅲ期10例;类型:浸润性导管癌27例,浸润性小叶癌7例,髓样癌3例;肿瘤≤5 cm 32例,>5 cm 5例。TEC组患者年龄27~65岁,平均(45.68±11.61)岁;TNM分期:Ⅰ期10例,Ⅱ期19例,Ⅲ期8例;类型:浸润性导管癌26例,浸润性小叶癌10例,髓样癌1例;肿瘤≤5 cm 28例,>5 cm 9例。两组患者年龄、患病状况等一般资料比较差异无统计学意义(P>0.05),有可比性。本研究经笔者所在医院医学伦理委员会批准,患者及家属均自愿参与并签署知情同意书。
1.2 方法
两组患者在治疗前6、12 h口服地塞米松(广西万德药业股份有限公司,国药准字H20113234)10 mg/次,治疗前0.5 h给予10 mg地塞米松磷酸钠注射液(天津金耀药业有限公司,国药准字H12020514)+20 mg苯海拉明注射剂(天津金耀药业有限公司,国药准字H12020617)进行肌内注射。TE组患者采用多西他赛(浙江海正药业股份有限公司,国药准字H20093092)与表柔比星(北京协和药厂,国药准字H20143165)进行化疗,药物剂量:多西他赛75 mg/m2,表柔比星60 mg/m2,1次/d。TEC组在TE组基础上加用环磷酰胺(山西普德药业有限公司,国药准字H20084513)治疗,环磷酰胺药物剂量600 mg/m2,1次/d。两组均连续干预3周。
1.3 观察指标及评价标准
比较两组临床疗效,疗效评价标准参照实体瘤疗效评价新标准RECIST进行评价[5]。完全缓解(CR):肿瘤完全消失4周以上;部分缓解(PR):肿瘤体积缩小≥30%,时间≥4周;相对稳定或无变化(SD):肿瘤体积缩小<30%或增大≤20%,时间>4周,且无新病灶出现;进展(PD):肿瘤体积增大>20%,或者出现新病灶。总有效率=(CR+PR)/总例数×100%。通过对患者进行为期2年的随访,了解两组患者2年后的生存情况,比较两组患者2年的生存率。
1.4 统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,计量资料以(x±s)表示,采用t检验,临床疗效、生存率等计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
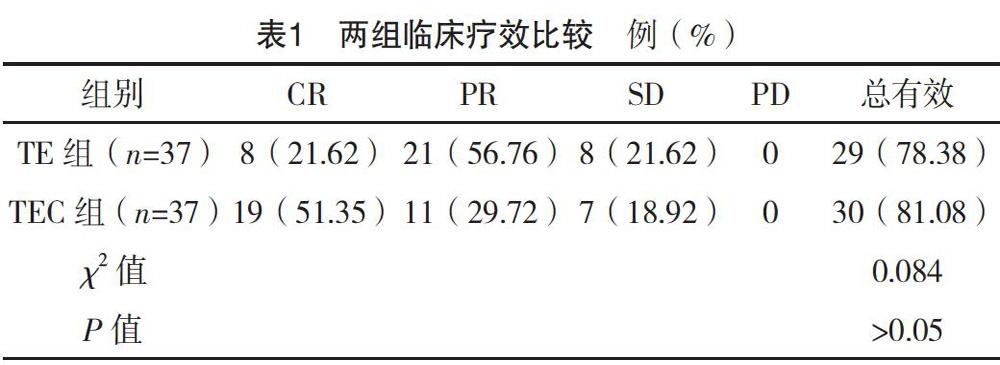
2.1 两组临床疗效比较
TE组治疗总有效率为78.38%,TEC治疗总有效率为81.08%,两组比较差异无统计学意义(P>0.05),见表1。
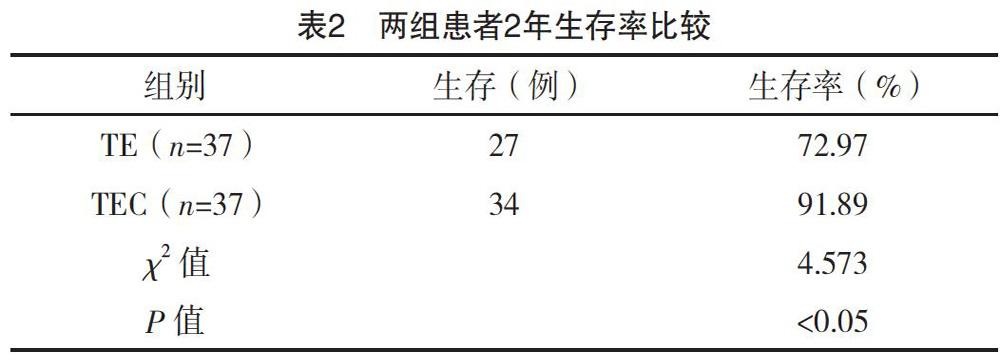
2.2 两组患者2年生存率比较
TE组2年生存率为72.97%,TEC组2年生存率为91.89%,两组比较差异有统计学意义(P<0.05),见表2。
3 讨论
新辅助化疗对于晚期乳腺癌患者具有显著效果,可帮助缩小肿瘤体积为患者手术提供机会,现已成为治疗晚期乳腺癌的重要方式。临床中亦有研究报道,新辅助化疗有助于乳腺癌患者进行手术时提高手术切除率[6-7]。但临床中对于新辅助化疗方案的选择存在一定争议,而对不同新辅助化疗方案对乳腺癌患者生存率的影响进行研究,可为临床治疗方案的选择提供依据与帮助。
本研究结果显示,两组治疗总有效率比较差异无统计学意义(P>0.05);治疗后2年,TE组患者生存率为72.97%,TEC组患者生存率为91.89%,TEC组2年生存率明显高于TE组(P<0.05),说明TE组与TEC组的方案治疗乳腺癌的效果相当,但TEC组治疗方案2年生存率更高。蒽环类药物是临床使用多年的治疗乳腺癌的药物,是治疗乳腺癌的首选药物之一。蒽环类药物作用机制主要为抑制癌细胞DNA结合,该药物属于非特异性细胞周期药物[8]。王妍等[9]研究报道,在乳腺癌治疗上,蒽环类药物单药的有效率将近35%。多西他赛与紫杉醇药两者作用机制相近,均属于新型抗微管药物,主要作用于微管β点处,改变微管序列,抑制微管重组进而抵抗肿瘤生长。还有研究报道指出,紫杉醇在治疗乳腺癌时单药疗效为60%左右,但其与蒽环类药物联合治疗,疗效显著高于单药治疗[10]。同样属于非特异性细胞周期药物,表柔比星具有干扰细胞转录、合成,起到抑制肿瘤的效果。临床相关研究表明,新辅助化疗可缩小乳腺癌肿瘤体积,为患者后续手术提供机会,同时还具有抑制肿瘤细胞生成,抑制其生长,提高患者生存率的作用[11-12]。本文中TEC与TE治疗方案疗效相当,但TEC方案患者2年生存率更高。这与解继平等[13]研究结果一致。
综上所述,临床治疗乳腺癌患者时,由多西他赛、表柔比星和环磷酰胺组合的新辅助化疗方案与多西他赛联合表柔比星近期疗效相当,但采用多西他赛、表柔比星和环磷酰胺组合的新辅助化疗方案治疗乳腺癌,患者2年生存率更高。
参考文献
[1] Patel T,Gupta A,Shah M.Pathological predictive factors for tumor response in locally advanced breast carcinomas treated with anthracyclin-based neoadjuvant chemotherapy[J].Journal of Cancer Research and Therapeutics,2013,9(2):245-249.
[2]蔡良真,杨志雄.新辅助化疗治疗局部晚期乳腺癌的临床观察[J].齐齐哈尔医学院学报,2010,31(9):1351-1352.
[3]刘伟,李健斌,王涛,等.蒽环类联合紫杉类方案在乳腺癌新辅助化疗中的有效性及安全性评价[J].临床肿瘤学杂志,2016,21(3):228-232.
[4] Liu Y,Xu Z G,Zhang Z Y,et al.Efficacy and safety of TE/TEC/intensive paclitaxel neoadjuvant chemotherapy for the treatment of breast cancer[J].Oncology letters,2019,17(1):907-912.
[5]陳智伟,廖美琳.RECIST标准在肿瘤治疗疗效评价中的应用[J].中国肿瘤,2004,13(10):616-618.
[6]曾愈程,康颖,刘芳,等.乳腺癌新辅助化疗疗效与预后关系研究进展[J].实用医学杂志,2018,34(10):38-40,45.
[7]李永峰,陈杰,谢尚闹,等.两种新辅助化疗方案对乳腺癌患者近期疗效及生存率的影响[J].中国现代医生,2015,53(32):84-86.
[8]林力生.TE与TEC方案在乳腺癌新辅助化疗中的近期疗效及不良反应[J].实用癌症杂志,2015,30(3):445-447.
[9]王妍,贾羽峰,井明晰,等.新辅助化疗对乳腺癌的疗效及影响因素分析[J].中国医药导报,2013,10(11):45-47.
[10]徐冬梅.紫杉醇及蒽环类药物联合化疗治疗晚期乳腺癌的临床观察[J].实用癌症杂志,2017,32(1):137-139.
[11]袁晗.紫杉类联合蒽环类的新辅助化疗方案治疗三阴乳腺癌患者的疗效与预后效果[J].医疗装备,2016,29(10):136-137.
[12]董卫华,陈剑波,李宏军.乳腺癌新辅助化疗的应用与临床有效性评析[J].中外医学研究,2017,15(18):25-26.
[13]解继平,韩雪,方红,等.多西他赛表柔比星联合环磷酰胺方案在乳腺癌新辅助化疗中的应用[J].中国肿瘤临床与康复,2016,23(1):72-74.
(收稿日期:2019-07-23) (本文编辑:桑茹南)

