低氮胁迫对杉木幼苗生长及生理的影响
叶宇波,马贵芳,潘瑶瑶,卢泳全
低氮胁迫对杉木幼苗生长及生理的影响
叶宇波,马贵芳,潘瑶瑶,卢泳全
(浙江农林大学 林业与生物技术学院,亚热带森林培育国家重点实验室,浙江 杭州 311300)
氮是植物生长发育过程中必不可少的营养元素。以FK,S39,S3和新6四个杉木无性系的萌芽条扦插苗为材料,采用营养液气雾栽培法,分析低氮(low nitrogen,LN)胁迫对杉木不同无性系幼苗生长和生理的影响。结果表明,LN抑制杉木幼苗生长,促进根系的生长,降低叶片长宽比,增加根冠比;LN胁迫使叶片中丙二醛的含量增加,叶绿素a和叶绿素b的含量降低,可溶性蛋白的含量增加,超氧化物歧化酶(SOD)和过氧化物歧化酶(POD)活性增加。
杉木;低氮胁迫;生长;生理;影响
氮素是核酸、氨基酸、蛋白质等物质的重要组分,是植物生长发育过程中必不可少的营养元素之一[1]。氮素参与一系列生理生化反应,涉及多种代谢途径,在植物生长发育过程中起重要作用[2-3]。缺氮对植物的产量和品质有很大的影响。植物对低氮胁迫响应分为两个步骤[4]:首先在氮胁迫初期,在不严重影响生长的状况下通过调节生理进程来适应短期的氮胁迫,包括三个方面:一是上调高亲和力转运系统,增加根的吸收速率[5];二是在不影响光合作用下降低叶片的生长速率,并将产生的碳源尽可能多的分配给根系,增加根系密度和长度,提高氮素吸收率[6];三是调控体内的氮储备机制维持正常的生长代谢[7]。其次,随着氮胁迫时间的延长,造成植物叶片不可逆的衰老,抑制植物生长。适当地增加氮肥施用量是植物获得高产的必要措施之一,然而过量施用氮肥不仅降低了植物对氮素的吸收和利用效率,而且造成种植效益降低,资源浪费和环境污染等一系列问题[8-10]。挖掘植物自身对氮利用的潜力,筛选氮高效基因型是农业可持续发展的重要研究领域。植物在不同氮水平下的生理应答是评价氮利用效率,筛选氮高效基因型的基础。
杉木为杉科Taxodiaceae杉木属裸子植物,是我国特有的速生优良用材树种,在南方各省广泛种植[11-12]。中国亚热带地区被认为是氮沉降严重地区,因此有研究认为该地区林分已经由氮限制转化为磷限制。然而郑璐嘉等[13]利用δ15N研究了不同林龄杉木人工林氮稳定同位素组成,利用细根δ15N值为指示,结果表明尽管中国亚热带地区氮沉降现象严重,但是氮素仍是处于速生期杉木人工林生长的限制因素,氮高效研究仍然是未来杉木育种的重要方向。
养分利用效率是品种高产的基础。研究表明,植物在低氮胁迫下表现出各种适应机制, 在不同植物之间,甚至同一植物不同品种之间对氮素的利用效率存在显著差异,这为人们筛选氮高效利用基因型进行遗传改良提供了可能。筛选氮高效基因型,可以利用常规育种方法选育出氮利用效率高的品种,这是氮高效分子育种的材料基础。目前, 氮高效杉木育种尚处于起始阶段,因此本文研究低氮胁迫下杉木不同无性系的生长及生理变化,为杉木氮利用效率研究奠定基础。
1 材料与方法
1.1 试验材料
2013年10月采集浙江省开化林场杉木(118°42′ E,29°13′ N)无性系采穂圃中轮伐期为20~25年的中大径材树种新6、S39和F开×那24(简称FK)以及轮伐期为15 ~ 20年的中小径材树种S3共4个杉木无性系的当年萌芽条,于浙江农林大学试验基(119°72′ E,30°23′ N)地扦插,第二年春天选取生长势均一、根系完整,结构相对一致的无病害苗作为研究基础材料,采用营养液气雾栽培法。设置低氮(low nitrogen,LN)和对照(CK)两个处理,每个处理5株,重复3次。由KNO3,Ca(NO3)2提供N源;用KCl和CaCl2来调节因NO3-浓度改变引起的其他离子浓度的改变,使之保持在恒定水平,除氮以外的营养以Hoagland营养液为基础配方,在此基础上根据前期预实验结果进行适当调整,用于杉木的幼苗培养(表1),试验从2015年5月20日开始到9月20日结束,各处理所用营养液每3周更新一次。

表1 杉木幼苗营养液配方
注:表中所有化学试剂均为实验室分析纯级。
1.2 试验方法
LN胁迫处理开始后,每月20日用尺子测量各处理的苗高,跟踪杉木幼苗生长变化趋势。LN胁迫处理4个月后于9月20日分别收获地上部分和地下部分,各处理随机选取30个叶片,用游标卡尺(世达90501)测量叶长和叶宽,并计算叶片长宽比;用测树钢卷尺(太平洋)测量最长根长,用电子天平(英衡JCS-W)称量地上部分和地下部分的鲜质量,并计算根冠比;用硫代巴比妥酸比色法[14]测定杉木叶片中丙二醛含量;用乙醇-丙酮提取法[15]测定杉木叶片中不同色素含量;用考马斯亮蓝法[16]测定杉木叶片中可溶性蛋白含量;根据邹琦[17]的方法测定杉木叶片中超氧化物歧化酶(SOD)活性和过氧化物歧化酶(POD)活性。试验结果用SPSS.17软件中的检验进行差异显著性分析。
2 结果与分析
2.1 LN胁迫对杉木无性系苗高生长的影响
由图1可知,经4个月LN胁迫后4个杉木无性系幼苗苗高生长均受到抑制。随着胁迫时间的增加4个无性系苗高生长均呈现先迅速增长,随后生长速度变缓,并逐渐变的平缓。由图1中可以发现,与CK相比,LN胁迫下各无性系生长随着胁迫时间的增加呈现下降趋势。
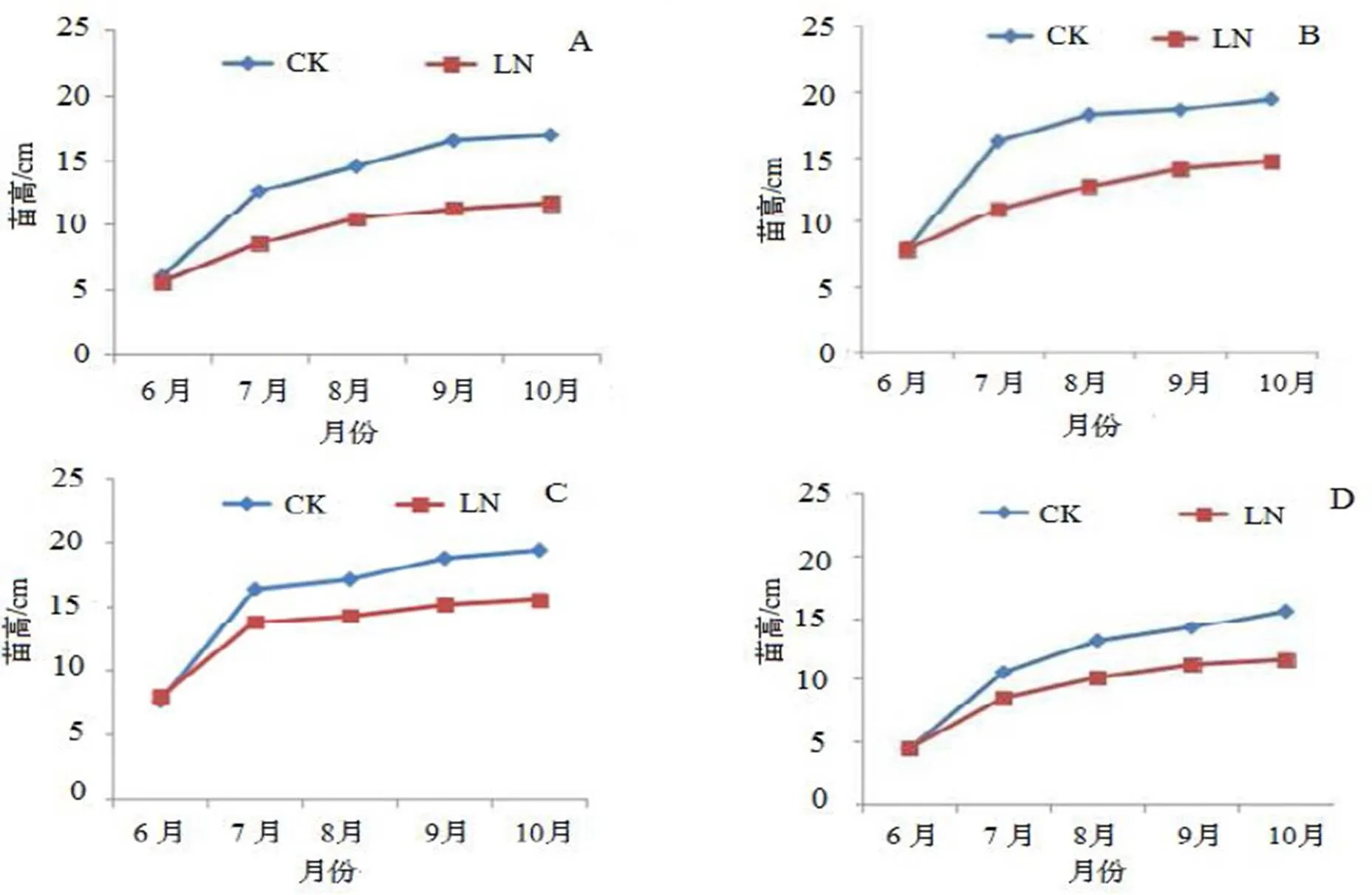
A-新6,B-S3,C-S39,D-FK。
Figure 1 Effect of low nitrogen treatment on growth of differentclones
2.2 LN胁迫对杉木无性系根生长的影响
由图2可知,与CK相比,LN处理能使4个无性系的最长根长增加,但不同无性系杉木的最长根长受LN诱导伸长的程度存在差异。其中S39和FK在LN处理下的最长根长显著高于CK(< 0.05),新6和S3的LN处理的根长极显著高于CK(< 0.01)。其中以FK增幅最大,LN和CK处理的最长根长分别为36.0 cm和12.7 cm,LN处理较CK增加了23.28 cm。表明氮供给不足导致较多的生物量向根系分配,促进根系的生长,提高其吸收养分的能力。

** 表示LN处理与CK间差异极显著(P < 0.01),*表示LN处理与CK间显著差异(P < 0.05),下同。
Figure 2 The longest root length of seedlings treated by LN and CK

图3 LN胁迫对杉木无性系叶片长宽比的影响
Figure 3 Comparison on leaf length breadth ratio
2.3 LN胁迫对杉木无性系叶片长宽比的影响
由图3可知,LN胁迫下各无性系叶片的长宽比均下降。其中无性系新6和CK间的叶片长宽比达到显著差异(< 0.05),S3与CK间的叶片长宽比达到极显著差异(< 0.01),而S39和FK的叶片长宽比在LN胁迫与CK之间差异不显著。
2.4 LN胁迫对杉木无性系根冠比的影响
由图4可知,各无性系根冠比的比值均受到LN胁迫的影响,CK处理下地下部分生长量小于地上部分生长,4个无性系的比值均小于1;而LN胁迫下该比值都大于1,其中新6根冠比值最大,为2.225,FK根冠比值最小,为1.723。表明氮胁迫能促进地下部分生长,抑制地上部分生长,进而增加植物根系与土壤接触面积,利于获取更多的氮元素。
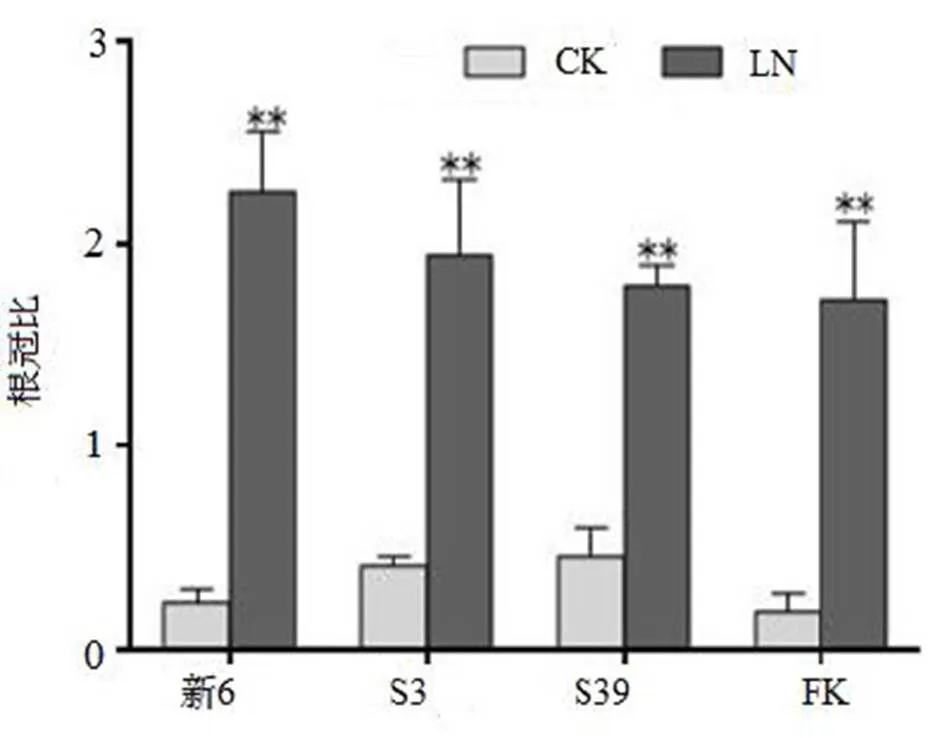
图4 LN胁迫对杉木无性系根冠比的影响
Figure 4 Comparison on root/shoot ratio of seedlings
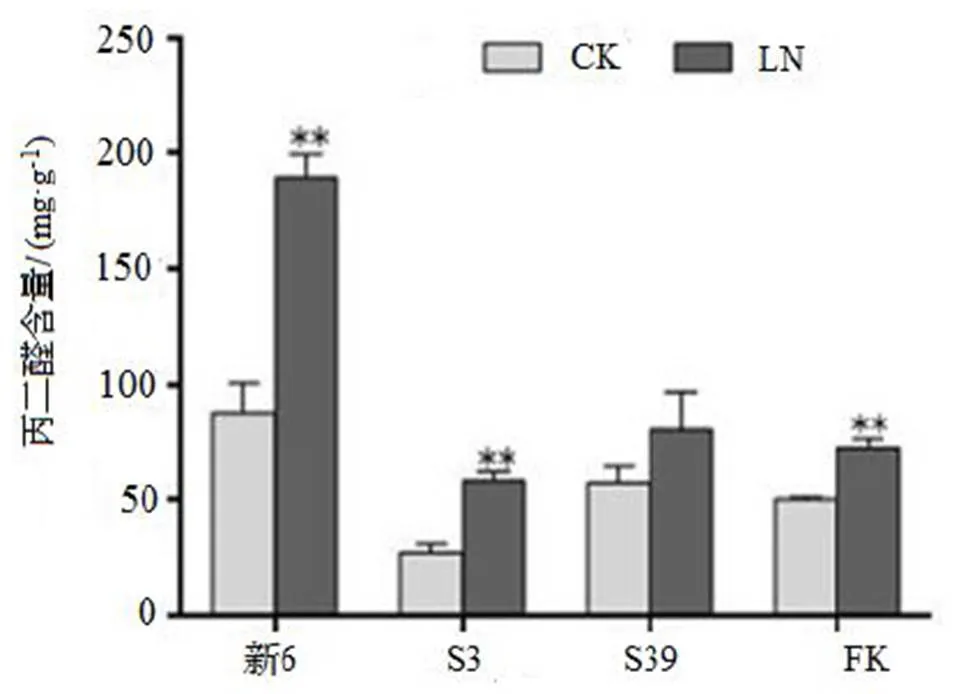
图5 LN胁迫对杉木无性系丙二醛含量的影响
Figure 5 Comparison on MDA content in seedlings
2.5 LN胁迫对杉木无性系丙二醛含量的影响
由图5可知,LN处理使4个杉木无性系丙二醛的含量均有所增加,但增加的幅度因无性系的不同而有差异,其中LN处理的新6,S3,FK中的丙二醛含量极显著高于相应的CK(< 0.01),表明LN胁迫对杉木无性系幼苗有一定的毒害作用。
2.6 LN胁迫对杉木无性系叶片光合色素含量的影响
LN处理使光合色素含量显著(< 0.05)或极显著(< 0.01)低于CK(图6),表明各无性系叶素a和叶绿素b合成均受到LN胁迫的抑制,但抑制程度不同。其中FK受到的抑制程度最大,其叶绿素a和叶绿素b均与CK间达极显著差异水平(< 0.01);S39的叶绿素b也与CK间达极显著差异水平(< 0.01),其他无性系LN处理的叶绿素a和叶绿素b与CK间则均为差异显著水平(< 0.05)。
2.7 LN胁迫对杉木无性系可溶性蛋白含量的影响
LN处理各杉木无性系可溶性蛋白的含量均有增加(图7),其中LN处理的FK极显著高于CK(< 0.01),新6和S39中可溶性蛋白含量显著高于CK(< 0.05),而S3中的可溶性蛋白含量与CK间差异不显著。

图6 LN胁迫对杉木无性系光合色素含量的影响
Figure 6 Comparison on photosynthetic pigment in seedlings
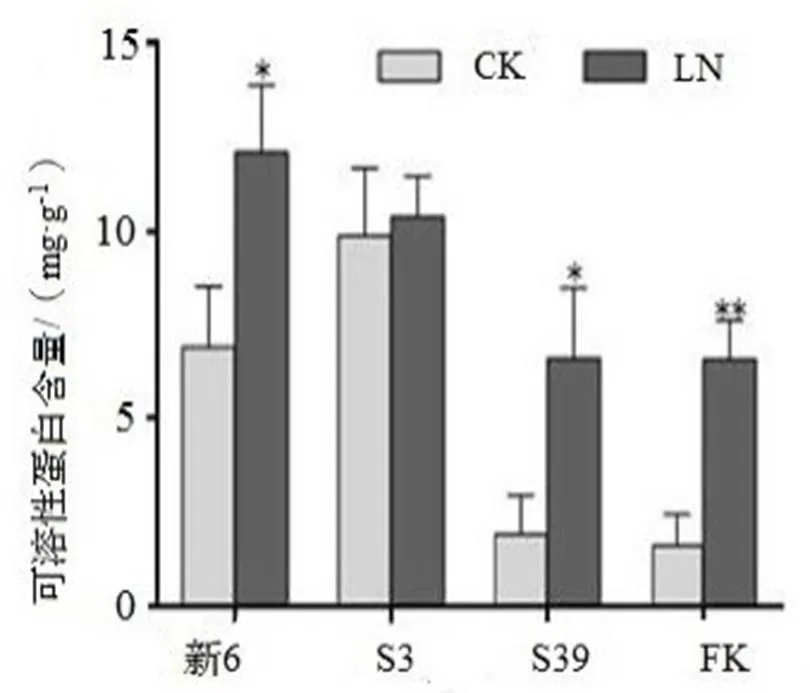
图7 LN胁迫对杉木无性系可溶性蛋白含量的影响
Figure 7 Comparison on soluble protein content in seedlings
2.8 LN胁迫对杉木无性系保护酶活性的影响
LN处理使各杉木无性系的SOD和POD活性均有所增加(图8),其中LN处理下新6的SOD和POD活性与CK间差异达到极显著水平(< 0.01),FK中的SOD和POD活性与CK间差异达到显著水平(< 0.05),而另外两个无性系的这两种酶与CK间差异都不显著。
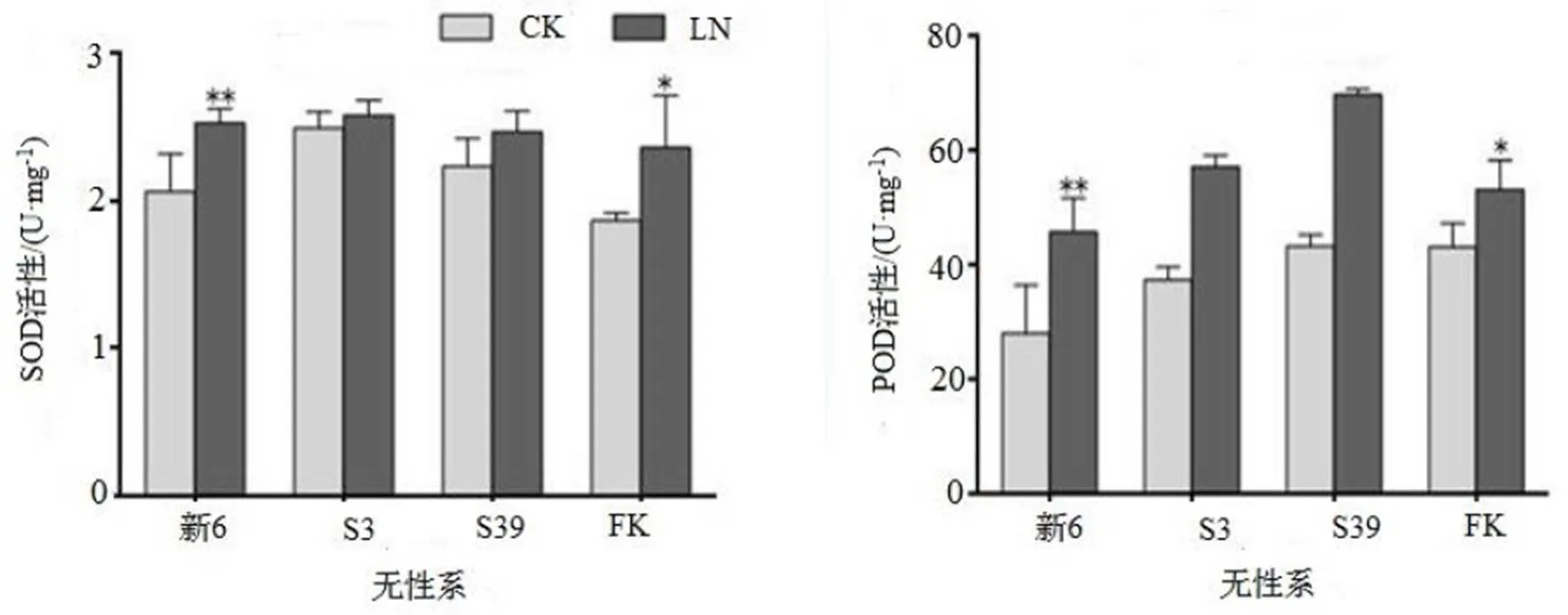
图8 LN胁迫对杉木无性系保护酶活性的影响
Figure 8 Comparison on SOD and POD activity in seedlings
3 结论与讨论
Zhao等研究氮胁迫对高粱生长和生理的影响时发现,缺氮条件下其叶面积减小,生物量下降[18]。Chun等发现在缺氮条件下玉蜀黍的总根数增加,根系结构发生改变,这与任永哲的研究结果相似,他发现在LN胁迫下普通小麦的最长根长增加[19-20]。张定一等在研究不同基因型普通小麦LN胁迫的生理响应时发现普通小麦的根冠比在LN胁迫时明显升高[21]。本研究发现LN胁迫对不同无性系杉木的苗高有不同程度的抑制作用。
叶绿体包含了植物光合作用的必需物质,是植物体进行光合作用的重要场所。在胁迫条件下,植物体叶片的结果和作用的完整性和稳定性遭到损害,导致植物的光合作用受到影响[22]。Huang等在研究氮胁迫对稻叶片光合作用的影响时发现在氮缺乏的条件下稻的叶绿素含量降低[23]。本试验中LN胁迫对杉木各无性系光合色素含量有不同程度的抑制作用。可溶性蛋白是植物体内普遍存在的一种渗透调节物质,叶片中可溶性蛋白50%左右是光合作用的关键酶RuBP羧化酶[25]。本研究表明LN胁迫对不同杉木无性系可溶性蛋白含量均有促进作用,各个无性系都有不同程度的增加。
SOD和POD是植物氧代谢过程中两个极为重要的保护酶类,在生物体内具有清除氧自由基的作用。潘琦等研究发现在LN胁迫条件下苦草和黑藻的SOD与POD活性增加,表明了植物对外界环境的适应性[26]。刘宇等研究氮胁迫对超高产玉米叶片保护酶活性的影响时发现无氮处理水平下POD活性最高,并随着施氮量的增加而逐渐降低;丙二醛含量随着氮胁迫时间的延长逐渐增加[27]。本试验研究发现LN胁迫条件下杉木无系性叶片的POD和SOD的活性均增强,表明杉木增强了对LN胁迫的防御机制。
植物衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛是膜脂过氧化作用的产物之一,对细胞有很强的毒性,对细胞和细胞中的许多生物功能分子,如蛋白质、核酸和酶等都有很强的破坏作用,并对生物膜的结构和功能有一定的影响,其含量可以反应植物遭受逆境伤害的程度。本研究表明LN胁迫后期丙二醛含量增加,其中无性系新6的含量最高,说明该无性系质膜受损伤程度最严重。
氮是植物生长发育需求量最大的营养元素,既是构成植物有机体的结构物质,也是植物生理代谢过程中起催化作用的物质。筛选和培育耐LN胁迫基因型的植株是减少氮肥投入、降低环境污染的有效途径之一。本试验以主要生长和生理指标为基础,分析了LN胁迫对杉木不同无性系幼苗生长的影响。从生长性状来看,LN胁迫抑制杉木幼苗生长、促进根系的生长、降低叶片长宽比、增加根冠比;从生理指标看,LN胁迫使丙二醛的含量增加、光合色素含量显著或极显著降低、可溶性蛋白的含量增加、SOD和POD活性都增加。本试验杉木各无性的综合应答表现表明,LN胁迫下新6的丙二醛含量增加幅度相对较低,而保护酶的含量增幅较高,同时叶片中的叶绿素a和叶绿素b的含量降幅较小,推测新6在氮匮乏的营养环境适应性高于其它几个无性系。
[1] 李梁,黄剑华,陈志伟,等. 作物耐低氮的相关生物学研究进展[J]. 上海农业学报,2012,28(02):117-122.
[2] 张子义,伊霞,胡博,等. 缺氮条件下燕麦根轴细胞的程序性死亡[J]. 中国农学通报,2010,26(08):175-178.
[3] 赵平,孙谷畴,彭少麟. 植物氮素营养的生理生态学研究[J]. 生态科学,1998,17(02):39-44.
[4] RICHARD-MOLARD C,KRAPP A,BRUN F,. Plant response to nitrate starvation is determined by N storage capacity matched by nitrate uptake capacity in two Arabidopsis genotypes[J]. J Exp Bot,2008,59(4):779-791.
[5] CRAWFORD N M,GLASS A D. Molecular and physiological aspects of nitrate uptake in plants[J]. Trend Plant Sci,1998,3(10):389-395.
[6] ZHANG H,FORDE B G. Regulation of Arabidopsis root development by nitrate availability[J]. J Exp Bot,2000,51(342):51-59.
[7] WALKER R L,BURNS I G,MOORBY J. Responses of plant growth rate to nitrogen supply: a comparison of relative addition and N interruption treatments[J]. J Exp Bot,2001,52(355):309-317.
[8] 林郑和,陈荣冰,陈常颂. 植物对氮胁迫的生理适应机制研究进展[J]. 湖北农业科学,2011,50(23):4761-4764.
[9] ZHAO L Z. Efficient Management of Nitrogen Fertilizers for Flooded Rice in Relation to Nitrogen Transformations in Flooded Soils[J]. Pedosphere,2014,2(2):97-114.
[10] ZHANG S,CAI G,WANG X,. Losses of urea-nitrogen applied to maize grown on a calcareous fluvo-aquic soil in North China Plain[J]. Pedosphere,1992,2(2):171-178.
[11] 郑仁华. 杉木遗传育种研究进展与对策[J]. 世界林业研究,2005,18(13):63-65.
[12] 孙长忠,沈国舫. 我国主要树种人工林生产力现状及潜力的调查研究Ⅰ.杉木、马尾松人工林生产力研究[J]. 林业科学研究,2000,13(6):613-621.
[13] 郑璐嘉,黄志群,何宗明,等. 不同林龄杉木人工林细根氮稳定同位素组成及其对氮循环的指示[J]. 生态学报,2016,36:2185-2191.
[14] 高峻凤. 植物生理学实验指导[M]. 高等教育出版社,2006:159-160.
[15] 张宪政. 植物叶绿素含量测定——丙酮乙醇混合液法[J]. 辽宁农业科学,1986,(3):26-28 .
[16] 中国科学院上海植物生理研究所. 现代植物生理学实验指南[M]. 科学出版,2004:214-215.
[17] 邹琦. 植物生理学试验指导[M]. 北京:中国农业出版社,2000.
[18] ZHAO D,REDDY K R,KAKANI V G,. Nitrogen deficiency effects on plant growth, leaf photosynthesis, and hyperspectral reflectance properties of sorghum[J]. Eu J Agron,2005,22(4):391-403.
[19] 任永哲. 低氮胁迫对不同小麦品种苗期性状的影响[J]. 种子,2012,31(05):91-94.
[20] CHUN L,MI G,LI J,. Genetic analysis of maize root characteristics in response to low nitrogen stress[J]. Plant Soil,2005,276(1-2):369-382.
[21] 张定一,张永清,杨武德,等. 不同基因型小麦对低氮胁迫的生物学响应[J]. 作物学报,2006,32(09):1349-1354.
[22] 卢从明,张其德,匡廷云,等. 水分胁迫抑制水稻光合作用的机理[J]. 作物学报,1994,40(05):601-606.
[23] HUANG Z A,JIANG D A,YANG Y,. Effects of nitrogen deficiency on gas exchange, chlorophyll fluorescence, and antioxidant enzymes in leaves of rice plants[J]. Photosynthetica,2004,42( 3):357-364.
[24] 杨晴,刘奇勇,白岩,等. 冬小麦不同叶层叶绿素和可溶性蛋白对氮磷肥的响应[J]. 麦类作物学报,2009,29(01):128-133.
[25] PATTERSON T,MOSS D,BRUN W. Enzymatic changes during the senescence of field-grown wheat[J]. Crop Sci,1980,20(1):15-18.
[26] 潘琦,邹国燕,宋祥甫. 硝氮胁迫对不同沉水植物生理生长的影响[J]. 上海环境科学,2010,29(01):16-20.
[27] 刘宇,韩林,王思远,等. 低氮胁迫对超高产玉米叶片保护酶活性的影响[J]. 吉林农业大学学报,2011,33(01):5-8,13.
Low Nitrogen Stress on Growth and Physiology ofSeedlings
YE Yu-bo,MA Gui-fang,PAN Yao-yao,LU Yong-quan
(State Key Laboratory of Subtropical Silviculture, College of Forest and Biotechnology, Zhejiang A & F University, Hangzhou 311300, China)
In October of 2013, stem cuttings of fourclones FK, S 39, S 3 and Xin 6 were harvested from Kaihua Forest Farm of Zhejiang province and were cultivated by aeroponic. Experiments were carried out on low nitrogen stress (LN) on growth and physiology of seedlings during the next May to September. The results showed that LN could inhibit the growth of seedlings, promote the growth of root system, decrease leaf length breadth ratio, and increase the root/shoot ratio. The content of MDA increased, chlorophyll a and b decreased in treated seedlings. The content of soluble protein, the activity of SOD and POD increased in seedlings treated by LN.
; low nitrogen stress; growth; physiology; response
S791.27
A
1001-3776(2019)06-0081-06
10.3969/j.issn.1001-3776.2019.06.013
2019-05-16;
2019-09-25
浙江农林大学大学生科研项目(102/202360000518)
叶宇波,本科生,从事林学方向研究;E-mail:1571109393@qq.com。
卢泳全,从事林木遗传育种研究;E-mail:luyongquan@126.com。

