miR-130b在胶质瘤对替莫唑胺耐药中的作用*
张 静, 周永刚, 舒俊斌, 李晓波, 吕晓俊, 叶汝勇, 李正在
(1永康市第一人民医院神经外科, 浙江 金华 321300; 2浙江省肿瘤医院脑外科, 浙江 杭州 310022)
目前国内外公认的胶质瘤有效的治疗方案是根治性手术治疗配合术后放化疗,但即便接受正规的内外科联合治疗,其中位生存期也不超过12个月[1-2]。替莫唑胺(temozolomide,TMZ)作为第2代烷化剂,可通过诱导鸟嘌呤残基的甲基化从而诱导细胞凋亡,TMZ结合放疗治疗胶质瘤较单独放疗可明显改善胶质瘤患者预后,目前已成为胶质瘤治疗中的标准化疗药物。但仅有不超过一半胶质瘤患者对TMZ敏感,机体先天及获得性耐药是制约患者对TMZ化疗效果的关键原因。因此,寻找能有效抑制胶质瘤对TMZ耐药的治疗手段一直是当前神经外科领域的重要研究领域[3-4]。
微小RNA(microRMA,miRNAs,miR)作为一组内生的非编码序列,可通过与目的基因3’-UTRs的不完全配对从而诱导目的基因mRNA降解。当前研究发现,miRNAs所调控的靶基因在包括细胞增长、分化及转移在内的多种病理生理过程中扮演着重要的角色[5]。近来研究表明,miRNAs在肿瘤细胞对化疗药物耐药中发挥着关键的作用,例如miR-873可通过靶向调控Bcl-2从而改善胶质瘤对顺铂的耐药性[6],而miR-16可通过调控胶质瘤细胞凋亡从而改善胶质瘤细胞对TMZ的耐药性[7],继而表明miRNAs可作为一种有效改善胶质瘤耐药性的调节剂从而用于胶质瘤临床治疗。目前miR-130b在胶质瘤细胞中的表达以及与胶质瘤耐药性是否存在一定相关性尚未可知。本次研究将探讨miR-130b与胶质瘤对TMZ获得性耐药的关系及其可能的作用机制,为胶质瘤的防治研究提供有益的实验参考,造福于胶质瘤患者健康。
材 料 和 方 法
1 细胞和试剂
胶质瘤细胞株U251、SHG-44和U87购自上海细胞生物研究所。DMEM高糖培养基和胎牛血清购自杭州四季青公司;含EDTA胰蛋白酶购自中国吉诺公司;TMZ购自Schering-Plough;Bay 11-7082购自Sigma;LipofectamineTM2000购自Life Technologies;miR-130b及内参照U6的引物和探针由广州锐博生物公司设计合成;RNA逆转录试剂盒和实时荧光定量聚合酶链反应试剂盒购自ABI;miR-130b mimics和miR-130b inhibitor及其阴性对照mimics NC和inhibitor NC均购自上海吉凯基因化学技术有限公司;DMSO、CCK-8试剂盒和Annexin V/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自碧云天生物技术研究所;BCA蛋白浓度测定试剂盒和RIPA裂解液购自北京中山生物工程公司;萤光素酶报告基因检测试剂盒购自Promega;电泳迁移率变动分析(electrophoretic mobility shift assay,EMSA)试剂盒购自Pierce;抗肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和Bcl-2抗体购自Epitomics;抗X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)、survivin和β-actin抗体购自Santa Cruz。
2 方法
2.1细胞培养 U251、SHG-44和U87细胞均培养于DMEM培养基中,DMEM培养基中均添加10%的胎牛血清,细胞均置于37 ℃、5% CO2的饱和湿度细胞培养箱中,当细胞贴壁铺满80%~90%视野时,使用0.25%含EDTA的胰蛋白酶消化传代。
2.2不同浓度TMZ的配制 TMZ在pH<5时保持稳定,而当pH>7时易分解。TMZ为脂溶性,使用DMSO将TMZ溶解。将100 mg原药TMZ加入10 mL的DMSO中,待其完全溶解后再经0.22 μm的微孔滤膜过滤除菌后,配制成1 g/L的母液,避光保存于4 ℃冰箱内,临使用时将母液置于37 ℃水浴箱内溶解后再添加DMEM培养基稀释成所需浓度,控制DMSO终浓度保持在0.1%以下,该浓度对细胞生长无明显影响。使TMZ梯度浓度为1 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L和100 μmol/L,现配现用。
2.3CCK-8法检测胶质瘤细胞活力及测定IC50值 将对数生长期的胶质瘤细胞制备成单细胞悬液后接种于96孔板中,每孔2×104个细胞,并调整每孔接种细胞悬液量为100 μL,每组细胞设立5个复孔,加入含TMZ的DMEM完全培养基液(0~1 000 μmol/L),将细胞培养板置于细胞培养箱中继续培养,于细胞孵育48 h后每孔加入CCK-8溶液10 μL,再次将培养板放置在细胞培养箱中继续培养1 h,最后在酶标仪的490 nm波长处测定吸光度(A)值。横坐标为不同浓度TMZ,纵坐标为细胞生长抑制率,绘制不同剂量-细胞生长抑制率曲线图,通过SPSS 17.0统计学软件的Probit过程计算出IC50。
2.4建立对TMZ耐药的胶质瘤细胞株 取对数生长期的胶质瘤U251细胞,通过梯度递增培养基中TMZ浓度,结合参考文献中得出较为合理的TMZ耐药性诱导浓度梯度为1 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L、80 μmol/L和100 μmol/L,诱导期间每隔3 d 更换TMZ培养液1次。首先添加浓度为1 μmol/L的TMZ培养基,待细胞生长稳定2周后开始增加TMZ药物浓度,每个浓度维持10 d 左右,6个月后即可诱导出对浓度为20 μmol/L的TMZ耐药的细胞株,将其命名为U251/TR细胞株,为了维持U251/TR细胞的耐药性保持稳定,培养耐药细胞的培养基为含20 μmol/L TMZ的完全培养基。U251/TR细胞株的耐药指数(resistance factor, RF)=IC50(U251/TR)/IC50(U251)。
2.5细胞转染及分组 收集对数生长期胶质瘤细胞,用完全培养基制成单细胞悬液并调整浓度为5×109/L,将细胞悬液接种至6孔板中,每孔100 μL,每组设3个复孔,待细胞融合至70%~80%时进行细胞转染。根据LipofectamineTM2000 试剂盒说明书进行操作,实验分为4组:mimics NC组,每孔U251/TR细胞加入100 nmol的mimics NC及5 μL 转染试剂;miR-130b mimics组,每孔U251/TR细胞加入100 nmol的miR-130b mimics及5 μL 转染试剂;inhibitor NC组,每孔U251细胞加入100 nmol的inhibitor NC及5 μL 转染试剂;miR-130b inhibitor组,每孔U251细胞加入100 nmol的miR-130b inhibitor及5 μL 转染试剂。转染后48 h收集细胞行RT-qPCR检测,确定转染效率后再进行细胞体外实验。
2.6RT-qPCR检测miR-130b 的表达 在转染后的胶质瘤细胞中用TRIzol试剂提取细胞总RNA,RNA浓度由超微量分光光度计检测,逆转录和荧光定量PCR过程严格按照试剂盒说明书进行操作,设置U6作为内参照,通过2-ΔΔCt法计算miR-130b的相对表达量,实验重复3次,取平均值。
2.7流式细胞术检测细胞凋亡 收集处于对数生长期的U251/TR和U251细胞,经冰PBS缓冲液洗涤3次,调整细胞浓度为1×106~1×107/L,加入50 μL Binding Buffer和2.5 μL Annexin V试剂(20 mg/L)在室温下避光反应30 min,再添加5 μL PI和100 μL Binding Buffer在室温下避光反应5 min,立即使用流式细胞仪进行定量检测,实验重复3次,取平均值。
2.8萤光素酶报告基因检测 将重组萤光素酶报告载体Mut-psiCHECK-TNF-α-3’UTR和WT-psiCHECK-TNF-α-3’UTR共转染入U251细胞中,再分别将miRNA-130b inhibitor和inhibitor NC转染至U251细胞中,转染48 h后收获细胞,按萤光素酶报告基因检测试剂盒说明书提供的方法对样品萤光素酶活性进行检测,每组样本设5个复孔。萤光素酶相对活性=萤火虫萤光素酶发光强度/海肾萤光素酶发光强度。
2.9EMSA检测NF-κB活性 按照EMSA试剂盒的说明书进行检测,使用细胞裂解液处理细胞后,再使用BSA法对各组细胞蛋白含量进行测定。采用双链寡核酸NF-κB序列探针(sense: 5’-AGTTGAGGGGACTTTCCCAGGC-3’; antisense: 5’-GCCTGGGAAA-GTCCCCTCAACCTGA-3’),6.5%非变性聚丙烯酰胺凝胶100 V预电泳60 min,待溴酚蓝泳动为3/4全长时停止电泳,再将带正电的尼龙膜和胶同时夹入电泳转移槽进行印迹转移,反应条件为380 mA转移30 min。将膜置于滤纸上吸干水分后转移至紫外灯下交联15 min,在封闭液和平衡液中于室温下分别反应20 min,经化学发光和X线曝光后拍照。用Quantity One 4.6.2软件(Bio-Rad)对图形进行灰度扫描,灰度值越高表示NF-κB激活程度越高。
2.10Western blot法检测蛋白表达 胶质瘤细胞提取蛋白后经按BCA蛋白浓度测定试剂盒说明书提取总蛋白,每份样品使用20 μg蛋白质,使用10% SDS-PAGE后转移至PVDF膜上,在4 ℃下使用5%脱脂奶粉封闭过夜,硝酸纤维素膜经 I 抗和 II 抗反应后滴加新鲜配制的ECL化学发光液显色、曝光和显影。
3 统计学处理
采用SPSS 16.0统计分析软件进行统计学分析。所有本次实验所得的计量数据均以均数±标准差(mean±SD)表示。采用单因素方差分析(one-way ANOVA)及SNK-q法分析总体及总体中两样本均数之间差异。以P<0.05为差异有统计学意义。
结 果
1 不同浓度TMZ对不同胶质瘤细胞的生长抑制作用
CCK-8法检测细胞活力结果表明,TMZ对体外U251、SHG-44和U87细胞均有不同程度的生长抑制作用,随着TMZ浓度的增加,其生长抑制作用更强,见表1。通过Probit过程计算得出,TMZ对不同胶质瘤细胞株(U251、SHG-44和U87)的IC50分别为54.8、94.8和149.6 μmol/L,选择TMZ的IC50相对较低的U251细胞作为后续实验。
2 体外耐TMZ胶质瘤细胞株(U251/TR)的建立
历时6个月,经过8个浓度梯度诱导,成功培养对TMZ耐药的U251/TR细胞株,利用CCK-8法检测TMZ对U251/TR细胞的生长抑制作用,检测结果如表1。TMZ对U251/TR细胞的IC50为465.4 μmol/L,RF为8.1。
表1CCK-8法检测不同浓度TMZ对不同胶质瘤细胞的生长抑制作用
Table 1.The viability of glioma cell lines was analyzed by CCK-8 assay after incubated with TMZ at increasing concentrations (Avalue. Mean±SD.n=5)

TMZ (μmol/L)U251 cellsSHG-44 cellsU87 cellsU251/TR cells01.485±0.3571.652±0.3431.581±0.4160.927±0.19651.047±0.2861.428±0.2411.286±0.3610.907±0.246500.915±0.2471.206±0.2491.207±0.2490.867±0.2181000.804±0.2480.987±0.2681.176±0.3130.843±0.1692500.517±0.1380.876±0.1960.954±0.2320.784±0.1585000.377±0.0860.547±0.1130.685±0.1270.724±0.1281 0000.261±0.0370.449±0.1240.559±0.1470.531±0.104
3 转染miR-130b mimics和miR-130b inhibitor对胶质瘤细胞中miR-130b表达的影响
首先运用RT-qPCR方法检测miR-130b在体外U251细胞和U251/TR细胞中的表达,结果表明miR-130b在U251细胞中的表达较在U251/TR细胞中明显上调,两者相差7.51倍(P<0.01),见图1A。
将miR-130b mimics转染至U251/TR细胞,同时将miR-130b inhibitor转染至U251细胞48 h后,利用RT-qPCR检测细胞中miR-130b的表达,结果表明miR-130b mimics组U251/TR细胞中的miR-130b表达明显高于mimics NC组(P<0.01),而miR-130b inhibitor组U251细胞中的miR-130b表达水平显著低于inhibitor NC组(P<0.01),见图1B。
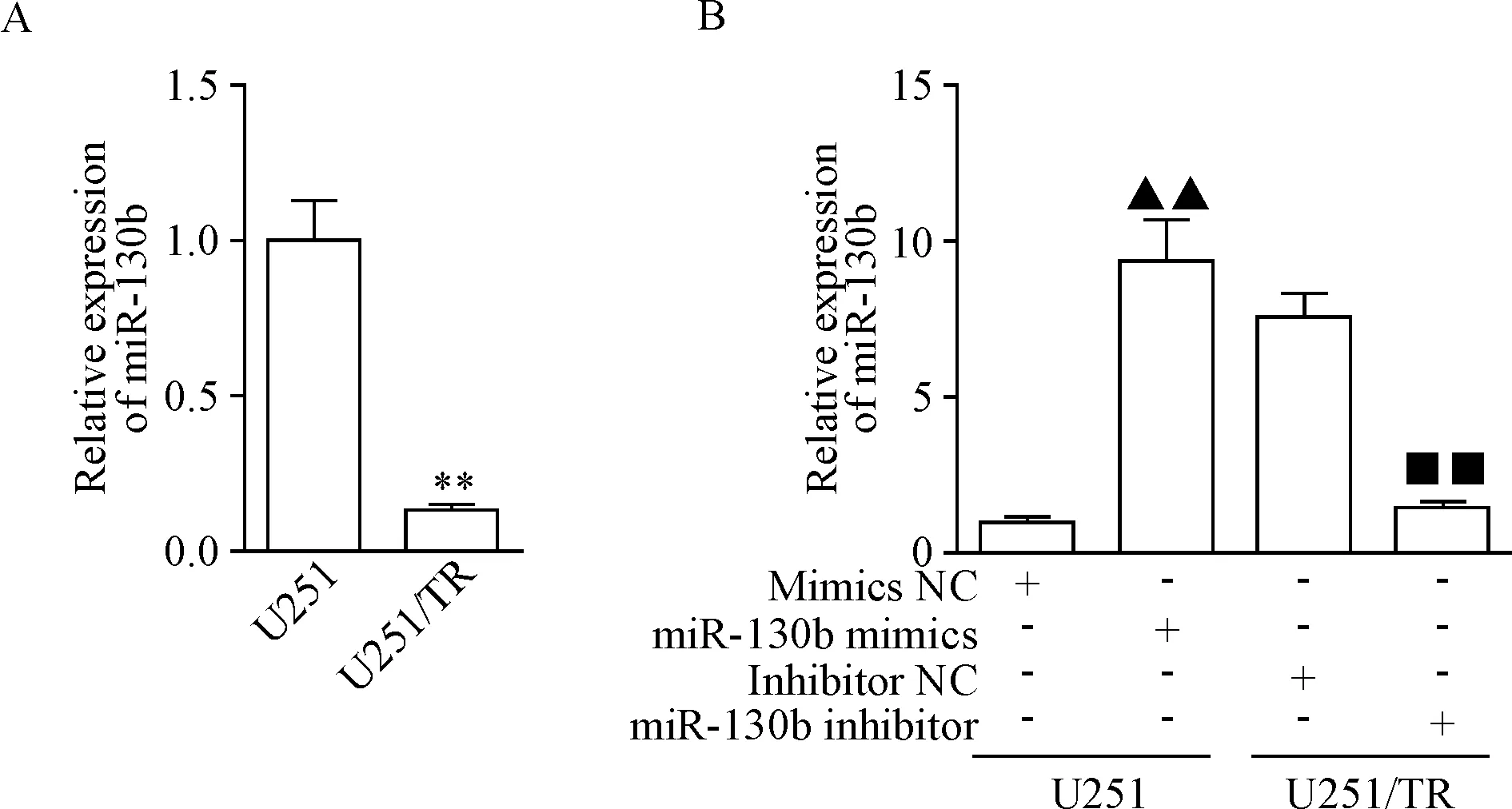
Figure 1.The levels of miR-130b in U251 and U251/TR cells (A) and the relative expression of miR-130b in glioma cells after transfected with miR-130b mimics, miR-130b inhibitor or their matched negative controls (B). Mean±SD.n=3.**P<0.01vsU251 cells;▲▲P<0.01vsmimics NC group;■■P<0.1vsinhibitor NC group.
图1RT-qPCR检测miR-130b在亲代U251细胞和耐药型U251/TR细胞中的表达差异
4 过表达/敲减miR-130b表达对体外胶质瘤细胞TMZ治疗反应的影响
将U251/TR细胞接种于96孔板中,每孔5 000个细胞,分为mimics NC组、mimics NC+TMZ组和miR-130b mimics+TMZ组,TMZ作用浓度为100 μmol/L,实验结束后使用CCK-8法检测A值,mimics NC组、mimics NC+TMZ组和miR-130b mimics+TMZ组细胞的A值分别为0.945±0.368、0.849±0.231和0.337±0.085,miR-130b mimics+TMZ组的A值显著低于mimics NC+TMZ组(P<0.01);使用流式细胞术检测3组细胞的凋亡率,结果显示,miR-130b mimics+TMZ组的凋亡率显著高于mimics NC+TMZ组(P<0.01),见图2A。
将U251细胞接种于96孔板中,每孔5 000个细胞,分为inhibitor NC组、inhibitor NC+TMZ组和miR-130b inhibitor+TMZ组,TMZ作用浓度为100 μmol/L,实验结束后使用CCK-8法检测A值,inhibitor NC组、inhibitor NC+TMZ组和miR-130b inhibitor+TMZ组细胞的A值分别为1.462±0.428、0.823±0.247和1.448±0.367,miR-130b inhibitor+TMZ组的A值显著高于inhibitor NC+TMZ组(P<0.01);使用流式细胞术检测3组细胞凋亡率,结果显示, miR-130b inhibitor+TMZ组的凋亡率显著低于inhi-bitor NC+TMZ组(P<0.01),见图2B。

Figure 2.Up-regulation of miR-130b promoted apoptosis induced by TMZ in U251/TR cells (A), while the apoptosis in U251 cells induced by TMZ was inhibited by down-regulation of miR-130b (B). Mean±SD.n=3.*P<0.05vsmimics NC group;▲▲P<0.01vsmimics NC+TMZ group;■■P<0.01vsinhibitor NC group;●●P<0.01vsinhibitor NC+TMZ group.
图2流式细胞术检测转染miR-130bmimics或miR-130binhibitor对体外胶质瘤细胞凋亡的影响
5 验证miR-130b的直接靶基因TNF-α
为了研究miR-130b在胶质瘤细胞血管新生中的可能作用机制,通过检索miRBase数据库获得hsa-miR-130b序列,并通过运用生物信息学工具RNAhybrid 2.1、TargetScan和PicTar对miR-130b的靶基因进行预测。结果显示,发现TNF-α与hsa-miR-130b存在潜在的结合位点,见图3A。为此,我们进一步应用萤光素酶报告基因检测系统对体外U251细胞中miR-130b对TNF-α的调控作用进行验证。
萤光素酶报告基因检测系统结果显示,与共转染WT-psiCHECK-TNF-α-3’UTR和inhibitor NC后细胞萤光素酶活性相比较,在U251细胞中共转染WT-psiCHECK-TNF-α-3’UTR和miR-130b inhibitor后的萤光素酶活性值明显升高(P<0.01);而共转染Mut-psiCHECK-TNF-α-3’UTR和miR-130b inhibitor后细胞萤光素酶活性值与共转染Mut-psiCHECK-TNF-α-3’UTR和inhibitor NC后的细胞萤光素酶活性值相比较,差异无统计学显著性,见图3B。
将miR-130b mimics和miR-130b inhibitor分别转染U251/TR和U251细胞后,应用Western blot检测胶质瘤细胞中TNF-α蛋白的表达,结果表明miR-130b mimics组的U251/TR细胞中TNF-α的表达明显低于mimics NC组(P<0.01),而miR-130b inhibitor组U251细胞中的TNF-α表达水平显著高于inhibitor NC组(P<0.01),见图3C。以上结果表明,miRNA-130b可与TNF-α的3’-UTR结合,TNF-α是miR-130b的直接靶向基因。

Figure 3.Prediction and validation of the target gene of miR-130b. A: the putative miR-130b binding sequences in the 3’-UTR of TNF-α; B: the relative luciferase activity was measured in the U251 cells after co-transfection of TNF-α-3’-UTR-WT or TNF-α-3’-UTR-Mut with miR-130b inhibitor or appropriate negative control; C: the protein level of TNF-α was examined in the U251 cells by Western blot. Mean±SD.n=3.**P<0.01vsinhibitor NC group;▲▲P<0.01vsmimics NC group.
图3生物信息学工具预测及荧光素酶报告检测系统验证miR-130b的靶基因
6 过表达/敲减miR-130b表达对胶质瘤细胞中NF-κB活性及Bcl-2、XIAP和survivin蛋白表达的影响
将miR-130b mimics和mimics NC转染至U251/TR细胞,同时将miR-130b inhibitor和inhibitor NC转染至U251细胞48 h后,利用EMSA检测胶质瘤细胞中NF-κB活性,结果显示,miR-130b mimics组U251/TR细胞中NF-κB活性较mimics NC组明显减弱(P<0.01),而miR-130b inhibitor组U251细胞中NF-κB活性显著强于inhibitor NC组(P<0.01),见图4A。
miR-130b mimics和miR-130b inhibitor转染胶质瘤细胞48 h 后,应用Western blot法检测胶质瘤细胞中蛋白表达水平, 结果表明,miR-130b mimics组U251/TR细胞中的Bcl-2、XIAP和survivin的表达水平明显低于mimics NC组(P<0.01),而miR-130b inhibitor组U251细胞中Bcl-2、XIAP和survivin的表达水平显著高于inhibitor NC组(P<0.01),见图4B。
7 NF-κB抑制剂Bay 11-7082对体外胶质瘤细胞TMZ治疗反应的影响
将U251/TR细胞分为对照组、TMZ组和Bay 11-7082+TMZ组,TMZ作用浓度为100 μmol/L,Bay 11-7082作用浓度为5 μmol/L,药物作用结束后使用CCK-8法和流式细胞术分别检测3组细胞活力和凋亡。
对照组、TMZ组和Bay 11-7082+TMZ组细胞的A值分别为1.049±0.177、0.874±0.080和0.552±0.094,Bay 11-7082+TMZ组的A值显著低于TMZ组(P<0.01);如图5所示,Bay 11-7082+TMZ组的凋亡率显著高于TMZ组,差异有统计学意义(P<0.01)。
讨 论
胶质瘤患者术后复发和转移最主要的原因是由于恶性胶质瘤细胞异常活跃的增殖活性和高侵袭性引起。胶质瘤细胞失去控制的过度增殖可升高颅内压,从而导致胶质瘤患者严重的并发症-脑疝,对患者生命安全造成严重影响。而随着第2代烷化剂TMZ的出现,使得当前胶质瘤的治疗取得了长足的进步,然而,仅有不超过一半患者对TMZ等化疗药敏感,使得TMZ对胶质瘤患者的生存延长作用十分有限。血脑屏障和胶质瘤细胞对化疗药物的获得性耐药是制约患者化疗效果的关键原因。因此,胶质瘤对TMZ耐药是当前化疗急需解决的难题[8-10]。为研究胶质瘤对TMZ耐药的具体机制,本研究通过参考既往文献[11],利用梯度递增浓度法建立体外耐TMZ胶质瘤细胞株。所建立的耐药型细胞株对TMZ的IC50值较其亲代细胞明显升高,其RI指数为8.1,属中度耐药;冻存后的U251/TR细胞经复苏后仍能保持生长和传代;同时U251/TR细胞在脱离TMZ作用后,该细胞株对TMZ的耐药指数有所下降,但仍维持于80%~90%之间。以上结果均表明,本次研究所建立的耐药细胞株的耐药性较为稳定,适合进行下一步机制研究。
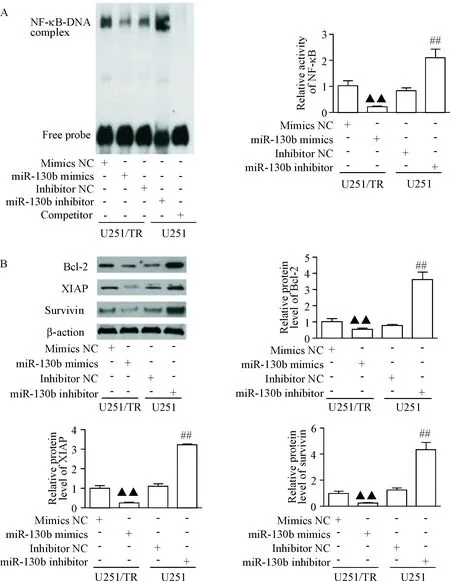
Figure 4.The EMSA analysis for determining NF-κΒ activation in miR-130b-overexpressing U251/TR cells and miR-130b-knockdown U251 cells (A), and Western blot results of endogenous Bcl-2, XIAP and survivin in glioma cells (B). Mean±SD.n=3.▲▲P<0.01vsmimics NC group;##P<0.01vsinhibitor group.
图4转染miR-130bmimics和miR-130binhibitor至胶质瘤细胞后,EMSA检测NF-κB活性,Westernblot法检测胶质瘤细胞中Bcl-2、XIAP和survivin蛋白表达
最新研究表明,miRNAs在肿瘤细胞耐药过程中发挥了重要调节作用,但目前尚未有miR-130b与胶质瘤耐药的相关性研究报道。为此,本研究探讨了miR-130b在亲代胶质瘤细胞和耐药型胶质瘤细胞中的差异,检测结果表明,miR-130b在U251/TR细胞中的表达较U251细胞明显降低,这种表达差异提示miR-130b可能与胶质瘤细胞获得性耐药存在一定联系,但这种联系究竟是通过何种作用方式来实现尚未可知,为此,下一步我们将特异性上调及下调miR-130b在胶质瘤细胞中的表达来观察miR-130b对胶质瘤细胞生长及凋亡的影响。
CCK-8结果表明,胶质瘤U251细胞经转染miR-130b inhibitor可有效削弱TMZ对胶质瘤细胞的生长抑制作用。另外,而上调miR-130b在胶质瘤细胞中的表达后可有效增强TMZ对体外胶质瘤细胞的生长抑制作用,提示miR-130b在体外胶质瘤细胞生长中发挥了重要的调控作用。另外,进一步研究miR-130b与体外胶质瘤细胞凋亡的实验结果表明,下调miR-130b在体外U251细胞中的表达可有效抑制细胞凋亡,而上调miR-130b的表达可增强TMZ对胶质瘤细胞的凋亡诱导作用,从而表明miR-130b可能作为耐药型胶质瘤细胞对TMZ治疗的增敏剂。然而,关于miR-130b调控胶质瘤细胞获得性耐药的信号传导机制尚不清楚。
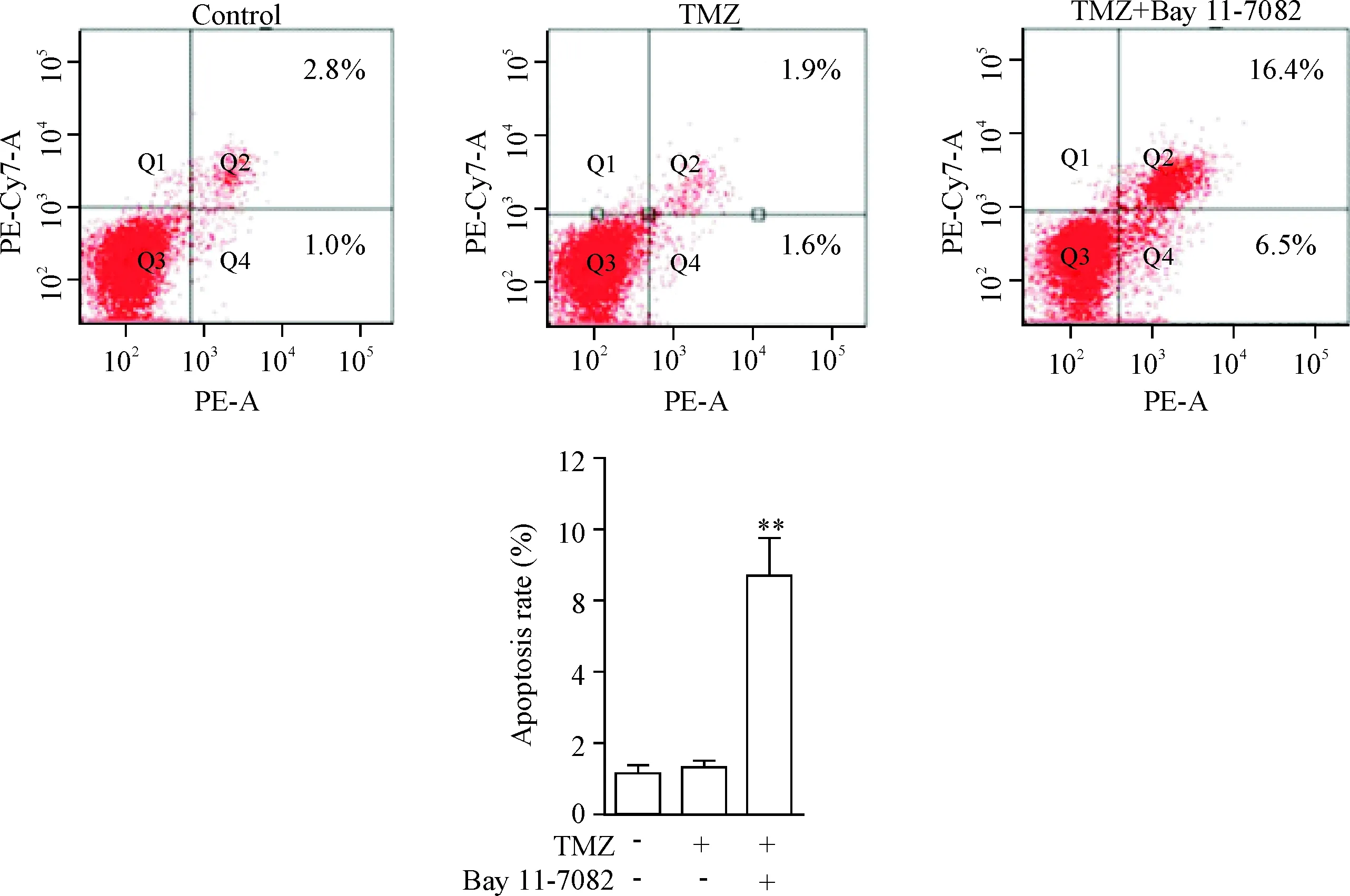
Figure 5.The apoptosis in U251/TR cells induced by TMZ was promoted by the addition of Bay 11-7082. Mean±SD.n=3.**P<0.01vsTMZ group.
图5流式细胞术检测Bay11-7082对TMZ诱导胶质瘤细胞凋亡的影响
TNF-α在大量良性疾病和恶性肿瘤的发生和发展过程中扮演着关键调节器的作用[12];最新证据显示,TNF-α在胶质瘤细胞中的表达水平要显著高于正常脑组织,同时与胶质瘤细胞的增殖、迁移和侵袭密切相关[13];TNF-α还可通过激活ERK、JNK、Akt和NF-κB等下游信号通路,从而促进肿瘤细胞生长并诱导肿瘤细胞耐药[14];另外,TNF-α还可诱导ABCG2 在肿瘤细胞中表达,增强肿瘤细胞对化疗药物的抵抗作用[15]。然而,迄今为止尚未有miR-130b和TNF-α的生物学功能研究报道。在我们的研究中,下调miR-130b的表达可促进TNF-α在胶质瘤细胞中的表达,而TNF-α在miR-130b高表达的U251细胞中的表达水平显著降低。此外,萤光素酶报告实验进一步证实,miR-130b直接靶向调控TNF-α。研究表明,NF-κB在肿瘤的发生和发展中起着至关重要的作用,并且在人脑胶质瘤细胞中,NF-κB 可以通过诱导MGMT等凋亡抑制蛋白的表达,从而诱导胶质瘤细胞对烷化剂耐药[16]。TNF-α作为NF-κB的主要活化因子之一,TNF-α激活NF-κB的作用机制已有详尽的研究[17]。本次研究表明,miR-130b在胶质瘤细胞中的异位表达可抑制NF-κB活性,而敲除miR-130b的表达可增强NF-κB活性;此外,我们发现miR-130b的表达下调可增加NF-κB的下游蛋白,如Bcl-2、XIAP和survivin的表达,这些凋亡抑制蛋白与肿瘤细胞耐药关系密切[18];另外,使用Bay 11-7082特异性阻断NF-κB信号通路可增强TMZ对耐药型胶质瘤细胞的凋亡诱导作用,进一步强调NF-κB信号通路在胶质瘤细胞对TMZ获得性耐药中的重要作用。至此,我们发现miR-130b调控胶质瘤细胞耐药的调控机制是通过TNF-α/NF-κB这一信号通道来实现,TNF-α/NF-κB信号通道可诱导下游凋亡抑制蛋白的表达,进而促进胶质瘤细胞耐药性,miR-130b/TNF-α/NF-κB信号通路可能在调控胶质瘤对TMZ获得性耐药中发挥关键作用。
在当前研究背景下,我们发现在U251细胞中,miR-130b可直接靶向调控 TNF-α,从而进一步调控NF-κB信号通道而控制胶质瘤对TMZ的获得性耐药。从机理上看,下调miR-130b可促进TNF-α的高水平表达,并有助于激活NF-κB并促进其下游蛋白Bcl-2、XIAP和survivin的表达。但本文的不足在于仅用一种胶质瘤细胞进行实验,miR-130b是否在其它胶质瘤细胞耐药中发挥一定作用还未明确;同时TNF-α在调控体外U251/TR细胞耐药中发挥主导作用还是部分作用尚未可知;另外,TMZ在诱导胶质瘤细胞耐药过程中是直接还是间接调控miR-130b还有待进一步实验明确。总之,miR-130b/TNF-α/NF-κB通路可能是未来胶质瘤治疗的具体作用靶点,从而在揭示胶质瘤的发病机制及治疗上具有一定积极意义。

