晚期胃癌不同一线化疗方案治疗及生存分析
,, ,
胃癌是我国最常见的恶性肿瘤之一,发病率逐年增长,位居肿瘤中第3位,死亡率位居肿瘤相关死亡的第3位[1]。因我国早期胃癌筛查尚不普及,约60%患者确诊时已为晚期,失去手术切除的机会,而根治术后患者仍有相当一部分出现复发、转移[2-3]。因此,合理布局晚期胃癌一线治疗具有重要意义。目前晚期胃癌化疗的疗效仍不理想,中位生存期为7~12个月,2年的生存率<10%。研究显示,与单药化疗相比,联合化疗改善晚期胃癌患者生存,中位总生存时间(overall survival,OS)可从10.5个月提高到11.6个月,联合化疗已成为晚期胃癌公认的标准一线治疗[4]。尽管已有不少随机研究对各个化疗方案进行探索,已证实许多化疗药物对进展期胃癌的一线化疗有效,但对于最佳化疗方案的选择,目前尚无定论[5]。美国国家综合癌症网络指南:胃癌(2018.V1)一线化疗推荐的化疗方案包括奥沙利铂联合氟尿嘧啶类(FOLFOX或XELOX),多西他赛/紫杉醇联合顺铂(TP)、伊立替康联合氟尿嘧啶(FOLFIRI)、顺铂联合卡培他滨(PX)、顺铂联合S-1(PS)、多西他赛+顺铂+氟尿嘧啶(DCF)、表柔比星+顺铂+氟尿嘧啶(ECF)、DCF和ECF改良方案等,而在众多治疗方案中哪一个更优、更适合布局一线治疗,目前仍没有十分明确的答案。本研究旨在回顾性分析不同的一线化疗方案治疗晚期胃癌的疗效以及常见临床病理指标与预后的关系。
1 资料与方法
1.1 一般资料 收集汕头大学医学院附属肿瘤医院肿瘤内科自2013年1月—2015年12月收治的晚期胃癌患者87例,其中男性63例,女性24例,年龄33~79岁,平均年龄58.83岁。卡氏评分量表(Karnofsky performance scale,KPS)评分≥70分,经病理学确诊(其中77例为腺癌,5例为粘液腺癌,5例为印戒细胞癌),经影像学检查明确有可测量病灶,预期寿命在3个月以上,签署化疗同意书,无重要器官功能障碍,血液学检测符合化疗基本要求。
1.2 分组及治疗方法 根据所接受化疗方案的不同,分为含奥沙利铂、含紫杉类及其他化疗方案组。含奥沙利铂组57例,采用mFOLFOX6/XELOX方案。mFOLFOX6方案:奥沙利铂85 mg/m2静滴,d1,5-FU 400 mg/m2静推,2 400 mg/m2持续泵入48 h,醛氢叶酸400 mg/m2静滴,每2周为1周期;XELOX方案:奥沙利铂130 mg/m2静滴,d1;卡培他滨1 000 mg/m2口服,2/d,d1~d14,每3周为1周期。含紫杉类组23例,采用多西他赛或紫杉醇联合顺铂或5-氟尿嘧啶。DP方案:多西他赛60 mg/m2静滴,d1,顺铂25 mg/m2静滴,d1~d3;TP方案:紫杉醇135 mg/m2静滴,d1,顺铂25 mg/m2静滴,d1~d3;DF方案:多西他赛60 mg/m2静滴,d1,5-FU 400 mg/m2静推,2 800 mg/m2持续泵入48 h,醛氢叶酸400 mg/m2静滴;TF方案:紫杉醇135 mg/m2静滴,d1,5-FU 400 mg/m2静推,2 800 mg/m2持续泵入48 h,醛氢叶酸400 mg/m2静滴。以上方案均以3周为1周期。其他化疗方案组7例,采用卡培他滨单药(1 000 mg/m2口服,2/d,d1~d14,每3周为1周期)、FOLFIRI(伊立替康180 mg/m2静滴,d1,5-FU 400 mg/m2静推,2 400 mg/m2持续泵入48 h,醛氢叶酸400 mg/m2静滴,每2周为1周期)或顺铂腹腔化疗。双周方案每4个周期、三周方案每2个周期进行疗效评价,直至疾病进展或出现不可耐受的不良反应,或患者拒绝继续化疗。3组患者的临床病理特征见表1。
1.3 疗效评价及不良反应评价标准 疗效评价按实体肿瘤的疗效评价标准1.1版分为完全缓解(complete response,CR)、部分缓解(partial response,PR),病情稳定(stable disease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)为CR和PR的总和,疾病控制率(disease control rate,DCR)为CR、PR和SD的总和。无进展生存时间(progression-free survival,PFS)指从化疗开始到疾病进展的时间、或者任何原因导致的死亡时间,以先发生者为准。OS指从化疗开始至死亡或末次随访的时间。
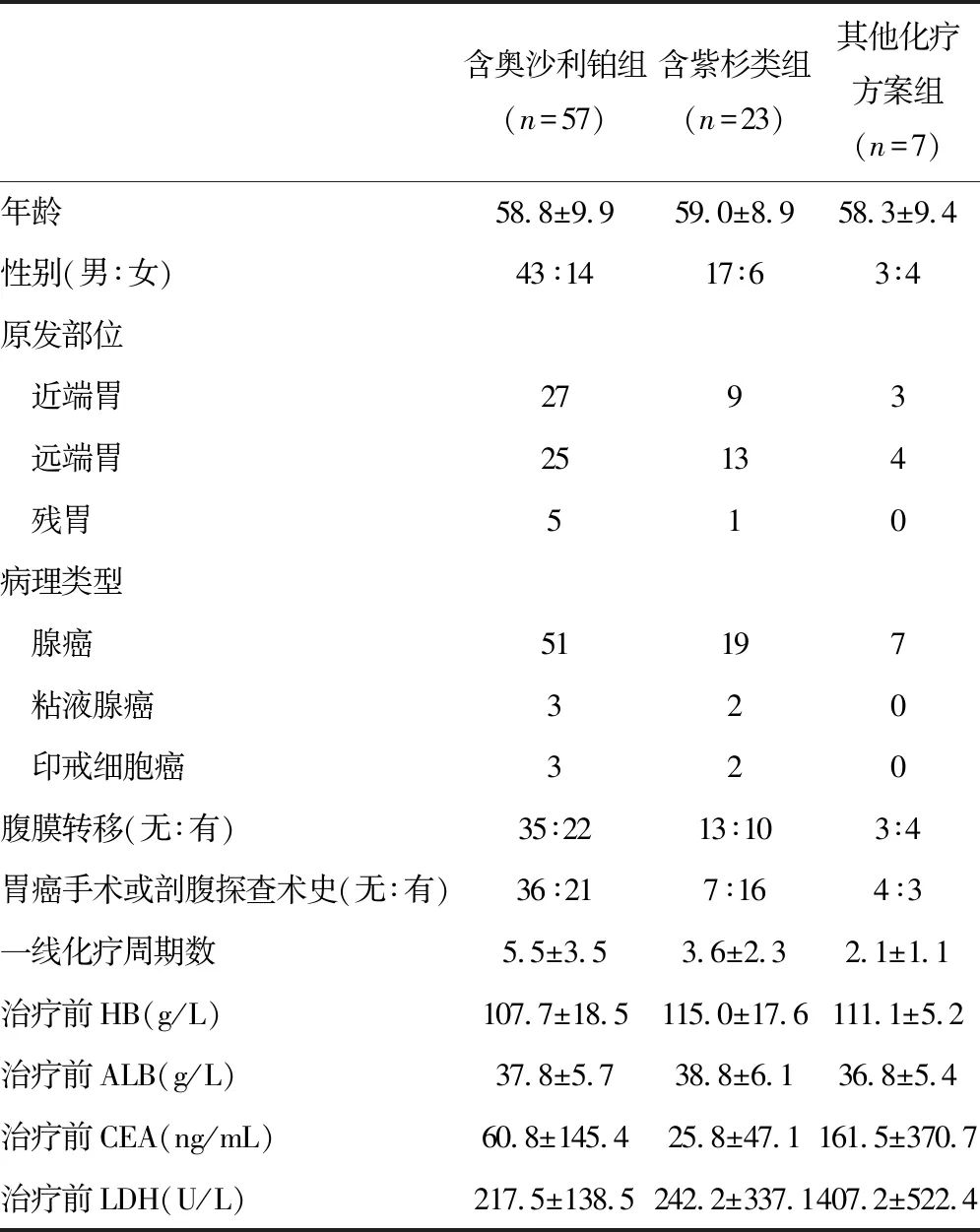
表1 3组患者的临床病理特征
2 结果
2.1 3组患者的近期疗效比较 含奥沙利铂组57例患者中有51例可评价疗效,PR 13例,SD 20例,PD 18例;含紫杉类组23例患者中有19例可评价疗效,PR 4例,SD 8例,PD 7例;其他化疗方案组7例患者中有6例可评价疗效,PD 6例。3组患者ORR分别为25.5%,21.1%,0%(χ2=9.618,P=0.047),差异比较有统计学意义,其中前2组间比较差异无统计学意义(χ2=0.150,P=0.928);DCR分别为:64.7%,63.2%,0%,3组间差异比较有统计学意义(χ2=9.470,P=0.009),其中前2组间差异比较无统计学意义(P=0.559)。表2。
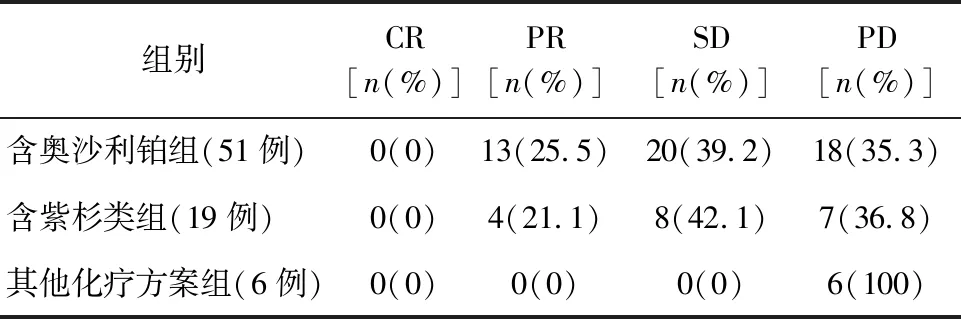
表2 3组患者的近期疗效比较
2.2 3组患者中位PFS及中位OS比较 随访日期截至2016年6月30日,含奥沙利铂组、含紫杉类组及其他化疗方案组患者中位PFS分别为:6.9个月、4.1个月、2.1个月(χ2=11.1637,P=0.004),其中第1,2组间、第1,3组间差异比较有统计学意义(χ2=5.13,P=0.024;χ2=8.927,P=0.003),第2,3组间差异比较无统计学意义(χ2=1.198,P=0.274)。3组患者的中位OS分别为22.6个月、5.8个月、3.2个月(χ2=34.486,P<0.001),其中第1,2组间、第1,3组间及第2,3组间差异比较均有统计学意义(χ2=13.258,P<0.001;χ2=34.031,P<0.001;χ2=4.171,P=0.041)。图1,2。
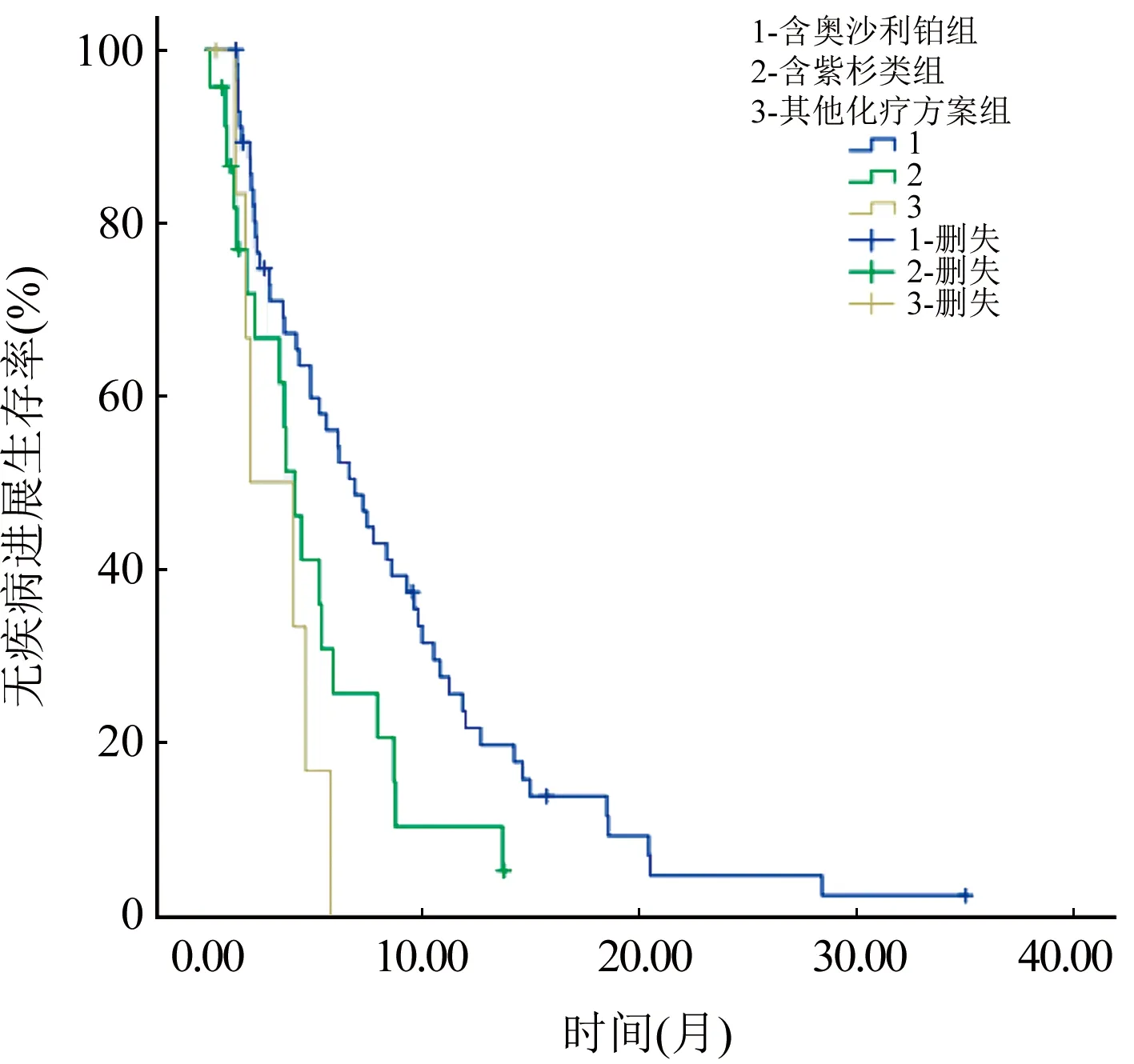
图1 3组患者无进展生存时间曲线
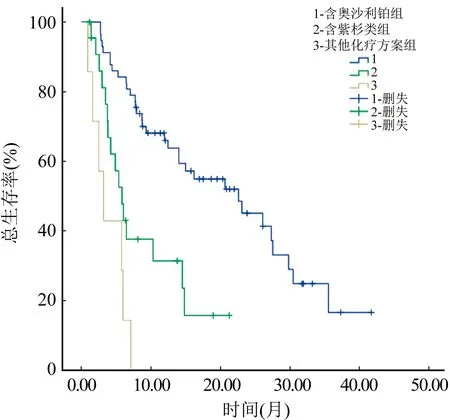
图2 3组患者总生存时间曲线
2.3 各临床参数对OS的影响
2.3.1 影响晚期胃癌患者预后的单因素分析 一线化疗方案、一线化疗周期数、一线化疗疗效、肿瘤原发部位、化疗前有无腹膜转移与患者的预后有关(均P<0.05);而性别、年龄、KPS评分、病理类型、是否有胃癌切除或剖腹探查史、治疗前是否贫血、是否合并低白蛋白血症、血清CEA、CA19-9、LDH是否升高与晚期胃癌患者的预后无关(P>0.05)。见表3。
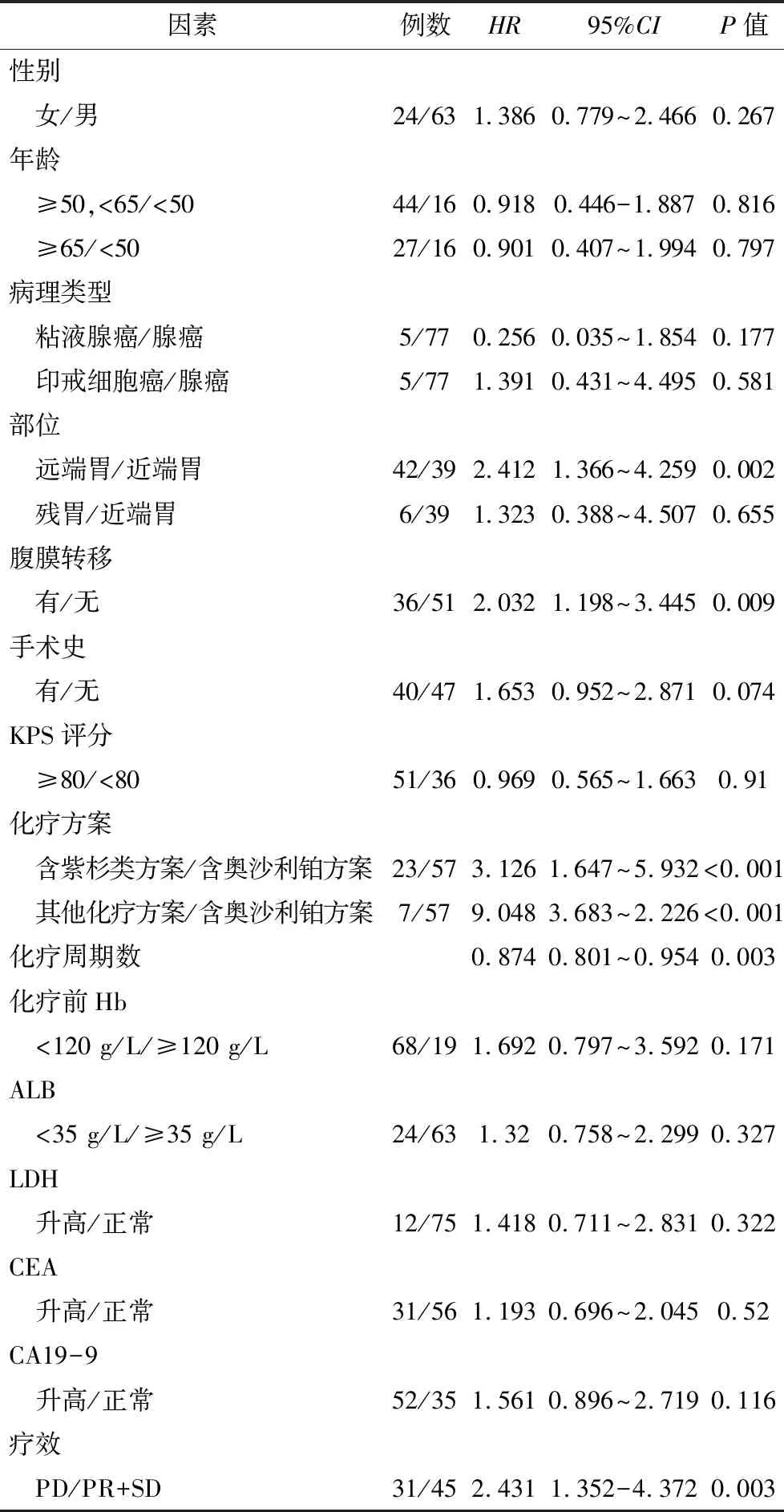
表3 影响晚期胃癌患者预后的单因素分析
进一步分析各预后影响因素:一线化疗选择含奥沙利铂方案患者的中位OS为22.6个月,高于选择含紫杉类方案及其他化疗方案组患者(5.8个月、3.2个月),差异比较有统计学意义;而后2者间差异比较无统计学意义。
一线化疗疗效为PR或SD患者的中位OS高于一线化疗疗效PD患者(23.1个月 vs 6.4个月);肿瘤原发部位为近端胃(包括胃底、贲门、食管胃结合部)患者的中位OS高于远端胃(包括胃体、胃窦、胃角)(27.5个月 vs 8.7个月)。化疗前有腹膜转移患者中位OS较无腹膜转移者短(6.5个月 vs 26.1个月)。
2.3.2 影响晚期胃癌患者预后的多因素分析 将影响晚期胃癌患者预后单因素分析中P≤0.15者纳入Cox模型进行多因素分析,结果显示:一线化疗方案、一线化疗周期数、化疗前有无腹膜转移、化疗前CA19-9水平为影响预后的独立因素(P<0.05),表4。
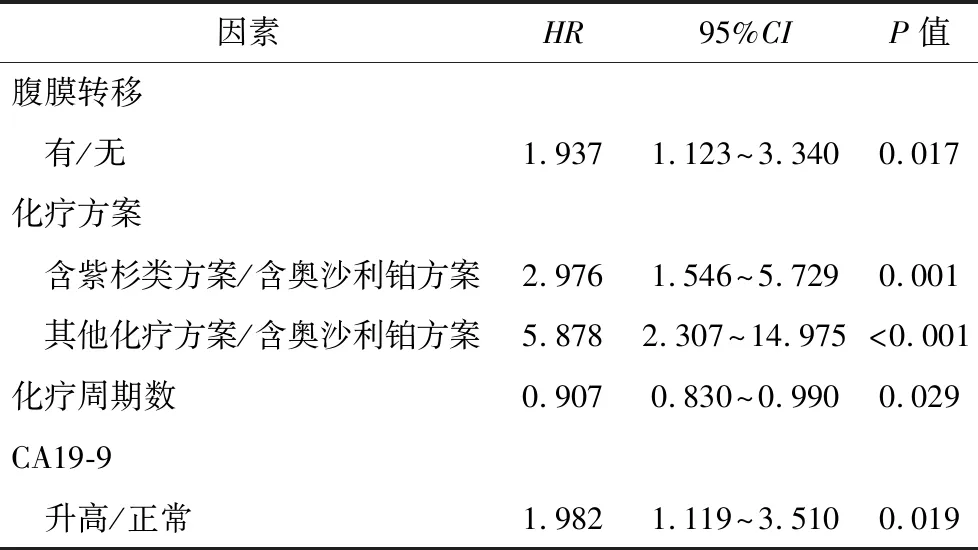
表4 影响晚期胃癌患者预后的多因素分析
3 讨论
胃癌是全球第五大常见恶性肿瘤,死亡率居全球肿瘤相关性死亡的第3位[6];在我国,胃癌发病率居肿瘤中第3位,死亡率位居肿瘤相关死亡的第3位[1]。初诊时有大部分患者(约60%)已为晚期,失去手术机会,而可以手术的患者又约60%会出现术后复发转移[7],对于这部分患者,姑息化疗是主要的治疗手段。研究表明[8-10],化疗对比最佳支持治疗,可使晚期胃癌患者的中位OS从2~4个月延长到1年,并提高生活质量。当然,有少部分抗人表皮生长因子受体2阳性的患者(12%~20%)[11],可以从抗人表皮生长因子受体2治疗中获益,大部分患者仍主要靠化疗改善生存。
奥沙利铂是第三代铂类抗癌药物,其胃肠道反应较顺铂轻、骨髓抑制较卡铂轻,在消化道肿瘤的治疗中占有一席之地[12]。奥沙利铂联合5-FU或希罗达最初是治疗结直肠癌的常用方案,近年来有多个临床研究对奥沙利铂治疗晚期胃癌的疗效进行了探索[12-19]。REAL-2研究[13]以ECF方案(表阿霉素+顺铂+5-FU)为对照组,分别以奥沙利铂代替顺铂、卡培他滨代替5-FU,结果显示:含奥沙利铂方案与含顺铂的方案相比,含卡培他滨方案与含5-FU方案相比,2者均显示出延长OS的趋势。Al-Batran等[14]报道的一项Ⅲ期临床试验,将220例晚期胃食管结合部腺癌患者随机分为2组,分别接受FLO方案(奥沙利铂+5-FU+四氢叶酸)和FLP方案(顺铂+5-FU+四氢叶酸)化疗,结果显示FLO方案较FLP方案,PFS有延长趋势(5.8个月vs 3.9个月),但OS比较差异无统计学意义(P=0.077)。Yamada等[20]的研究表明:SOX方案(奥沙利铂联合S1)在OS、PFS上非劣于CS方案(顺铂联合S1),且安全性、耐受性好。Hironaka等[12]报道的一项Ⅱ期临床研究提示S1联合奥沙利铂的疗效优于S1联合顺铂,目前对比上述2个方案的Ⅲ期临床试验正在进行中。
紫杉类药物包括多西他赛和紫杉醇,为细胞周期特异性药物[21]。目前探索多西他赛联合方案作为一线用药在进展期胃癌中作用的最重要的研究是TAX325研究[22],共有457例初治胃癌患者入组,随机分为DCF(多西他赛+顺铂+5-FU)和CF(顺铂+5-FU)组,结果显示含多西他赛的化疗方案(DCF)在PSF和OS方面均具有明显优势,因此,DCF可以作为一种新的标准方案。但该方案也带来了较严重不良反应,使患者难以耐受(DCF组中3~4级粒细胞减少继发的感染性发热发生率高达30%,明显高于CF组)。随后,有学者尝试将三药联合方案变为两药联合方案[23-28],紫杉类药物分别联合顺铂或氟尿嘧啶类药物,也获得了与三药联合相似的疗效,但不良反应明显降低。在一项纳入11个临床研究(共1 932例)晚期胃癌患者的Meta分析[29]中,将患者根据一线化疗方案中是否含紫杉类药,分成紫杉类组和对照组,分析2组间的OS、PFS、ORR及安全性,结果提示紫杉类组对比对照组,OS、PFS、ORR均有获益。
综上所述,目前晚期胃癌的一线化疗方案以新一代的细胞毒药物奥沙利铂、紫杉类药物为基础,故本研究将入组患者所接受化疗方案不同分为含奥沙利铂方案组和含紫杉类方案组,另有7例患者化疗方案中不包含奥沙利铂或紫杉类,将其单独列为一组(其他方案组)。本研究中,含奥沙利铂组和含紫杉类组的客观有效率和疾病控制率接近,分别为25.5%,21.1%和64.7%,63.2%,差异比较无统计学意义,这与袁霞等[30-32]的研究结果类似。而2组的中位PFS和OS分别为6.9个月、4.1个月和22.6个月、5.8个月,这与先前的研究结果[19-21]不同,先前的结果多提示含紫杉类组的OS接近或优于含奥沙利铂组,而我们的研究提示含紫杉类组的中位PFS、OS显著低于含奥沙利铂组,考虑可能的原因是:一线化疗周期数为影响晚期胃癌预后的独立因素,而本研究中含奥沙利铂组和含紫杉类组接受一线化疗的周期数有显著性差异,分别为(5.5±3.5)周期、(3.6±2.3)周期,因此,前者接受了更多周期数的化疗,预后优于后者。同时,因为本研究是回顾性研究,没有进行随机分组,且含紫杉类组包含的方案过于杂乱,疗效不一,加上病例数较少,存在偏倚,导致了含紫杉类组的PFS、OS明显降低。
本研究中其他方案组仅有7例,其中4例选择卡培他滨单药化疗,2例选用FOLFIRI方案,1例选用顺铂腹腔化疗,其ORR及DCR均为0,中位PFS和OS分别为2.1个月、3.2个月。该结果提示一线化疗方案选择氟尿嘧啶类单药联合或不联合伊立替康,或者单纯行腹腔化疗近、远期疗效均较差。同时,分析这7例患者临床特点,其中有5例患者治疗前已出现腹膜转移,该组患者接受化疗的周期数也较少(1~3周期),这2个因素可能也导致了疗效及预后不理想。
本研究多因素分析结果提示:一线化疗方案、一线化疗周期数、化疗前有无腹膜转移、化疗前CA19-9水平为影响预后的独立因素。该结果给我们带来的启示是合理选择一线化疗方案,提高患者的耐受性、依从性,让患者得以接受更多周期化疗,可提高疗效及改善预后;同时,若治疗前已存在腹膜转移或CA19-9升高,则提示预后不良,倾向于选择较强烈化疗方案。

