乳腺癌中CCR7、E-cadherin的表达与侵袭转移的研究
周海玲 李 壮 曹自平
佳木斯大学,黑龙江省佳木斯市 154007
在中国乳腺癌呈逐年上升趋势[1],如何预防及医治乳腺癌成为医学研讨的一个重要内容。肿瘤的发生一般相对比较隐秘,特别有些人更是缺少医学常识延误治疗时机。乳腺癌患者新发病人数每年都在增多,其因癌症死亡的人数也是呈上升趋势。癌症的发生与基因异常改变有很大干系。最近几年许多学者发现特异性趋化因子及其受体是许多肿瘤发生转移的必要因素,尤其CCR7的表达成为乳腺癌发生转移的必须因素。乳腺癌组织中CCR7的出现在癌细胞的趋化与侵袭活性中有一定的加速作用。大量研究证实乳腺癌以及多种实体肿瘤的转移与CCR7有关。钙粘附蛋白(Cadherin)可以把它归为能够参与细胞间同质黏附的钙依赖性跨膜糖蛋白。其中的 N-cadherin存在于神经组织、肌肉组织中,本题研究的 E-cadherin存在于上皮组织中, P-cadherin存在胎盘组织中等。在此之中E-cadherin 与肿瘤的转移关系密切,也是上皮间质转化过程当中的重要生物标识物,而多受研究者关注。人的E-cadherin编码基因位于16号染色体q22.1附近,由723~748个氨基酸组成,分子量80~124KD,分子位于跨膜区。CC类趋化因子受体成员CCR7被证明在包含乳腺癌在内的多种肿瘤的淋巴转移中发挥着主要作用[2],肿瘤转移的过程包含肿瘤细胞向肿瘤细胞团外侵袭,向血管、淋巴管迁徙,然后经此过程管道上的开口进入当中,沿着血管、淋巴管到达转移部位。谈及肿瘤细胞的侵袭,细胞外基质(ECM)的降解是肿瘤细胞可以向外侵袭以及血管淋巴管开放的重要环节,而基质金属蛋白酶MMPs成员MMP-9 在这一过程中起到的作用极其重要。相关文献报道MMP-9 可以降解E-cadherin 调节组织重塑、增殖和迁移,也能从胞外区近质膜处将其分裂开[3]。在肿瘤细胞的定向迁移方面,趋化因子与其相应受体之间能为治疗乳腺癌提供大量理论依据。本课题研究通过免疫组织化学方法测验CCR7与E-cadherin两因子在乳腺癌中的表达情况及对相关性进行分析。
1 资料与方法
1.1 标本来源 搜集在2017年7月—2018年11月佳木斯大学附属第一医院病理科80例乳腺浸润性导管癌的石蜡包块,取癌旁5cm组织45例,另取对应腋窝转移淋巴结40例。术前均未行任何放化疗、内分泌治疗及生物靶向治疗,术后病理诊断明确,上述标本均常规制作石蜡包埋切片。
1.2 主要试剂 试剂包含兔抗人CCR7单克隆抗体,兔抗人 E-cadherin(bs-1016R,1∶200)蛋白单抗,和由北京博奥森生物技术有限公司生产PS法试剂盒和DAB显色试剂,PBS磷酸盐缓冲液缓冲液。
1.3 免疫组化 通过免疫组化方法(SABC)处理蜡块,染色,研究CCR7、E-cadherin在浸润性乳腺癌、转移淋巴结及癌旁组织中的表达情况。
1.4 结果处理 在高倍镜下进行观察癌细胞数量,CCR7 和E-cadherin均以细胞膜和(或)细胞质染色。几乎不染色为阴性(-);浅黄为弱阳性(+);棕黄染阳性(++);深棕染强阳性(+++)。
1.5 统计学方法 采用Spearman等级相关进行检验分析,用SPSS17.0软件包处理本文数据;均以α=0.05作为测验水准,P<0.05有意义。用χ2检验研究CCR7与E-cadherin在浸润性乳腺癌中表达情况。
2 结果
2.1 CCR7、E-cadherin在乳腺中的表达 由表1所示可见,
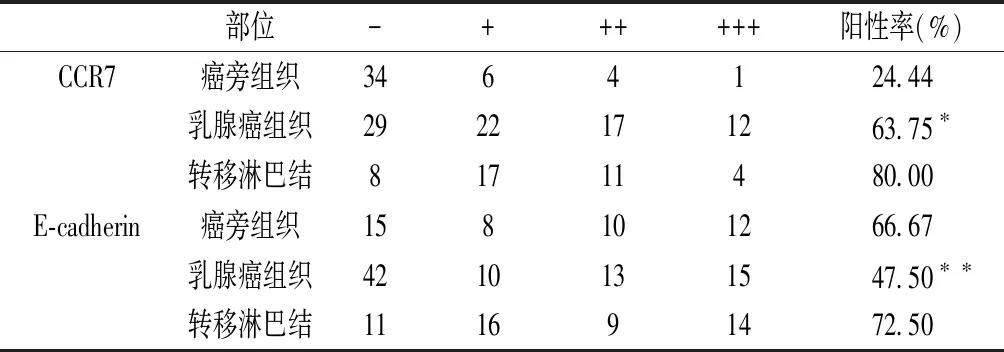
表1 CCR7、E-cadherin在癌旁正常组织、浸润性导管癌及转移淋巴结的表达
注:*χ2=11.424,P<0.05,**χ2=15.374,P<0.05。
CCR7在乳腺癌、转移淋巴结组织中的阳性表达率均高于癌旁正常组织,差异有统计学意义(P<0.05)。E-cadherin在乳腺浸润性导管癌组织、转移淋巴结及癌旁组织皆有表达,差异有统计学意义(χ2=15.374,P<0.05),且E-cadherin在转移淋巴结、癌旁组织中的阳性表达率均高于乳腺浸润性导管癌组织,差异有统计学意义(P<0.05)。
2.2 CCR7、E-cadherin在乳腺癌组织中的表达与其临床病理特征的关系 由表2可见,CCR7、E-cadherin与乳腺癌组织的组织分化水平、临床TNM分期、淋巴结转移情况显著相关(P<0.05),与患者年龄、肿块大小及绝经前后无相关性(P>0.05)。
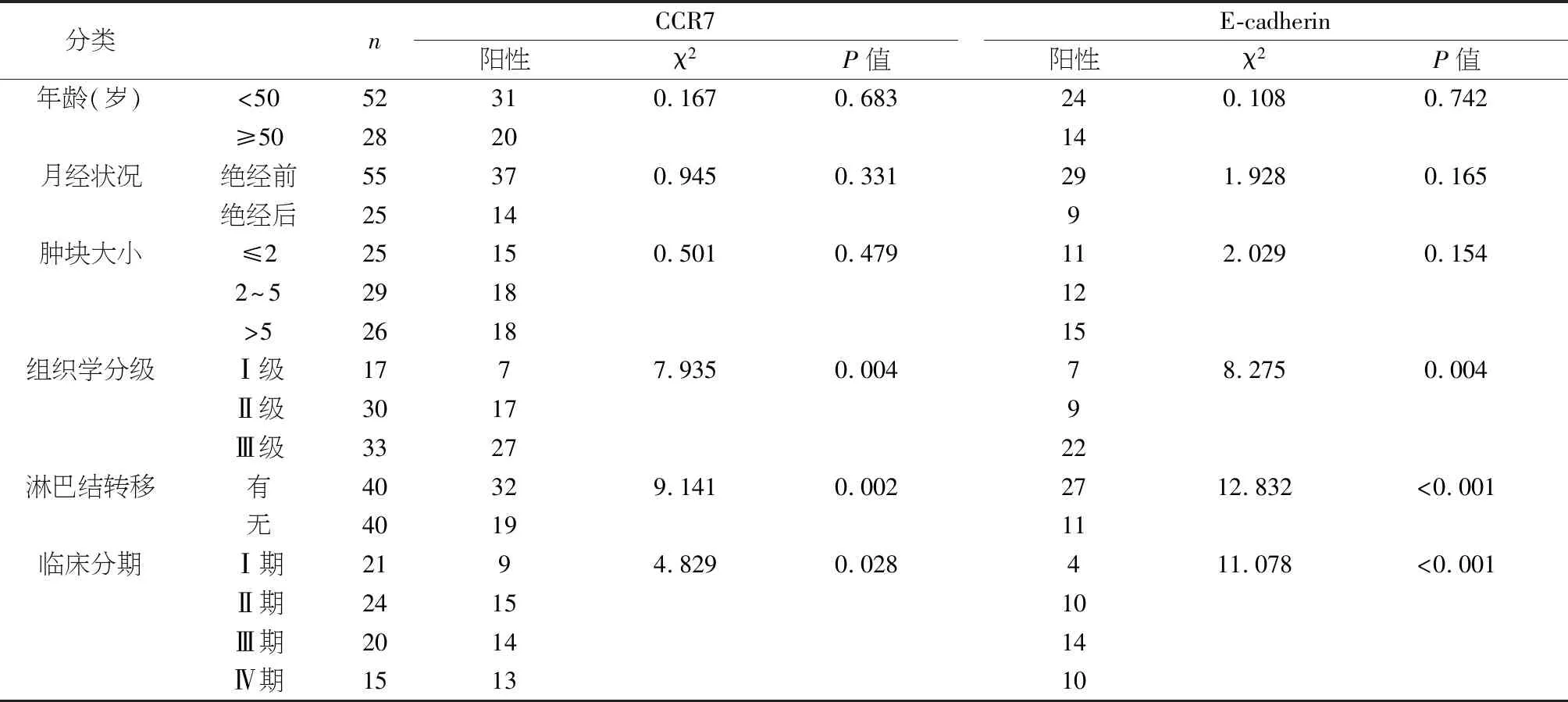
表2 CCR7、E-cadherin在乳腺癌组织中的表达与其临床病理特征的关系
2.3 乳腺癌组织和癌旁组织中CCR7与E-cadherin表达相关性 利用Spearman措施计算,剖析CCR7、E-cadherin二者在乳腺癌中的表达相关性,前者在乳腺癌组织中出现高表达,后者在癌旁组织中出现高表达。结果为CCR7与E-cadherin表达呈负相关性(r=-0.42),差异具有统计学意义(P<0.05)。见表3。

表3 乳腺癌组织和癌旁组织中CCR7与E-cadherin表达相关性
3 讨论
乳腺癌最常见的转移形式是经过腋窝淋巴结转移,其转移部位包含骨、肝、肺,其中肾脏和皮肤部位的转移较罕见。值得注意的是转移是致使绝大多数癌症患者复发以致死亡的主要影响因素。乳腺癌转移现如今有两种说法,第一种理论为“种子和土壤”学说,认为体内各部位的组织器官给癌细胞供的生长条件是有差别的,因此具有相对特异性生长的肿瘤细胞。第二种认知是“归巢理论”,癌症的转移是因为人来自身的器官能够产生某些趋化因子,正是在这些趋化因子的介导下,癌细胞最终经过富含趋化因子的器官的血管壁转移到特定的部位[3]。研究乳腺癌细胞如何转移,将对治疗其复发、侵袭转移带来不小启迪。研究表明,乳腺癌干细胞既是乳腺癌细胞群体中具备强大成瘤能力的细胞亚群,而且与乳腺癌发生发展、转移、治疗抵抗等多种生物学行为显著相关。现今观点认为,乳腺癌治疗后复发转移的根源是乳腺癌干细胞在化疗、内分泌治疗中能够发生抵抗。导致乳腺癌患者预后不良的重要因素是肿瘤发生转移,而淋巴结是乳腺癌转移最常见的部位。乳腺癌细胞侵袭进入微淋巴管是乳腺癌淋巴转移的早期事件。Muller等提出了CCR7在乳腺癌组织中的异常表达与乳腺癌的转移密切相关。最近大量研究发现CCR7在癌细胞转移过程中起到主要作用。CCR类趋化因子受体主要在单核细胞、中性粒细胞、T细胞、B细胞和嗜酸性粒细胞及肺和肝等组织中表达。CC类趋化因子受体成员CCR7 与其配体CCL21的结合在乳腺癌的发生、发展及淋巴转移中发挥重要作用,很可能作为防止肿瘤转移的靶点。大量研究表明在对黑色素瘤、甲状腺癌、肝癌宫颈癌、肺癌等多种肿瘤的研究中发现CCR7的表达与肿瘤淋巴结转移关系密切。因此,CCR7与其配体的相互作用在肿瘤的淋巴转移过程中充当重要介质。已有研究证明,CCR7活化后可以激活细胞外信号调节蛋白激酶1/2(Erk1/2),而Erk1/2是MMP-2/9的上游信号分子,通过下调E-cadherin诱发上皮间质转化的发生[4],从而促使乳腺癌多阶段过程的发展,推测乳腺癌CSCs中CCR7可能通过活化Erk1/2促进肿瘤细胞 MMP-2/9的分泌,下调E-cadherin降解细胞外的基质及破坏微淋巴管基底膜,为乳腺癌 CSCs转移创造条件[5-7]。
本实验通过免疫组化方法来检测CCR7、E-cadherin在乳腺正常组织、乳腺浸润性导管癌组织及转移淋巴结中的表达与侵袭转移情况的研究。检测发现CCR7、E-cadherin在浸润性导管癌组织、转移淋巴结中的阳性率不同于癌旁组织的阳性率(P<0.05),揭示其在乳腺癌的恶变与转移中能够起到促成作用。CCR7、E-cadherin在有淋巴结转移的阳性率高于无结转移淋巴结组(P<0.05)。CCR7、E-cadherin在转移淋巴结组织中的阳性率也较浸润性乳腺癌组织阳性率相对高一些。上述结果说明,CCR7、E-cadherin可能与乳腺癌淋巴结的侵袭转移有相关性,这两种因子可能作为乳腺癌淋巴结转移及预后的重要检测目标。并且CCR7、E-cadherin在浸润性乳腺癌的组织分化程度、临床TNM分期及淋巴结转移相关(P<0.05),而与患者年龄、是否绝经及肿瘤大小无相关性(P>0.05)。揭示两者在转移性淋巴结组织中阳性率高,与淋巴结转移、临床TNM分期及组织分化程度有关,证明了异常表达的CCR7、E-cadherin对浸润性乳腺癌的进展过程可能起到一定作用,可认为是乳腺癌患者预后不良的标志。最后在乳腺癌组织中CCR7、E-cadherin呈现负相关(r=-0.42,P<0.05),提示CCR7、E-cadherin在乳腺癌发生发展中起到对抗作用,并且CCR7能下调E-cadherin的表达,同时也预示在其高表达时可能有复发转移的可能。本试验检测到CCR7、E-cadherin与浸润性乳腺癌的产生侵袭及转移有关,CCR7可能加强E-cadherin对细胞外基质的破坏作用,从而肿瘤细胞通过趋化作用由细胞外基质向远处转移。如果这个推论成立,将可能为乳腺癌的治疗及防止其复发转移提供很好的依据。

