1 249例氟喹诺酮类口服制剂不良反应/不良事件及说明书对比分析
龚立雄,王 丽,王新茹,周晓杰,马雪皎
(河南省食品药品评价中心,河南 郑州 450018)
氟喹诺酮类抗菌药物抗菌谱广、抗菌活性强、口服吸收好、组织浓度高、与其他抗菌药无交叉耐药性,故广泛应用于临床[1],但其药品不良反应(ADR)也随之增多[2]。2015年和2016年的国家药品不良反应监测年度报告显示,在所有抗菌药物的严重报告中,氟喹诺酮类药物位居前列。对此,国家药品监督管理部门也多次发布药品不良反应信息通报(第35期和第58期),警示该类药物的用药风险。2016年12月,新加坡药品监督管理部门(HSA)也发出警告,指出氟喹诺酮类药物有引起视网膜脱离的潜在风险,并更新了含氟喹诺酮类产品的说明书,且有两项大型队列研究证实了这一结论。基于上述研究,本研究中对氟喹诺酮口服制剂ADR/药品不良事件(ADE)病例报告进行统计,并分析其一般规律及特点,为临床安全用药提供参考。现报道如下。
1 资料与方法
对2011年1月1日至2017年12月31日河南省药品不良反应监测中心数据库中的1 249例氟喹诺酮口服制剂ADR/ADE病例报告进行统计与分析。采用回顾性研究方法,对报告中涉及患者的性别、年龄,药品分布,ADR/ADE发生时间,ADR临床表现和转归,以及药品说明书等进行描述性分析。
2 结果
2.1 患者一般情况
报告涉及患者男女比例约为1.2∶1,年龄3~96岁,且以19~64岁患者居多。详见表1。
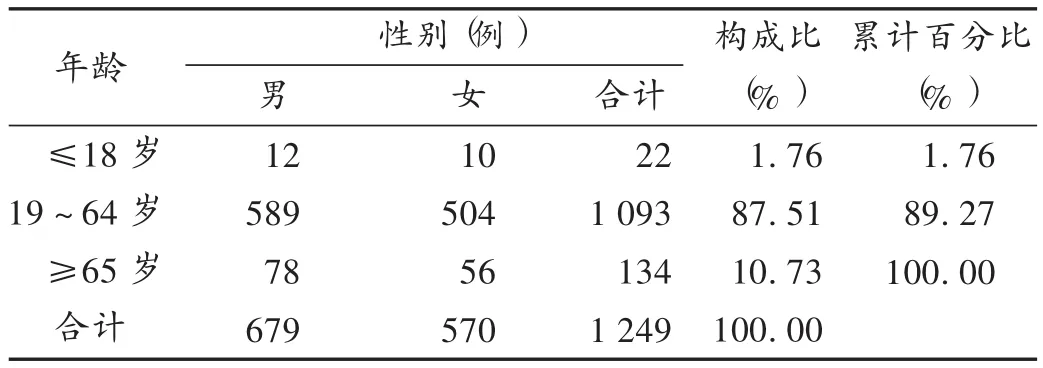
表1 患者性别与年龄分布
2.2 药品分布
报告中共涉及8种药品,其中诺氟沙星、左氧氟沙星和环丙沙星报告数量居前3位。详见表2。剂型分布,胶囊剂最多,574 例(45.96%),片剂 519 例(41.55%),其他剂型(主要包括颗粒剂、丸剂、合剂等)156例(12.49%)。

表2 ADR/ADE报告涉及药品分布(n=1 249)
2.3 ADR/ADE发生时间
结果见表3。报告中ADR/ADE发生时间明确的有1 222例,其中817例发生在用药后1 d内(65.41%);发生时间介于用药后5 min至用药后4个月。
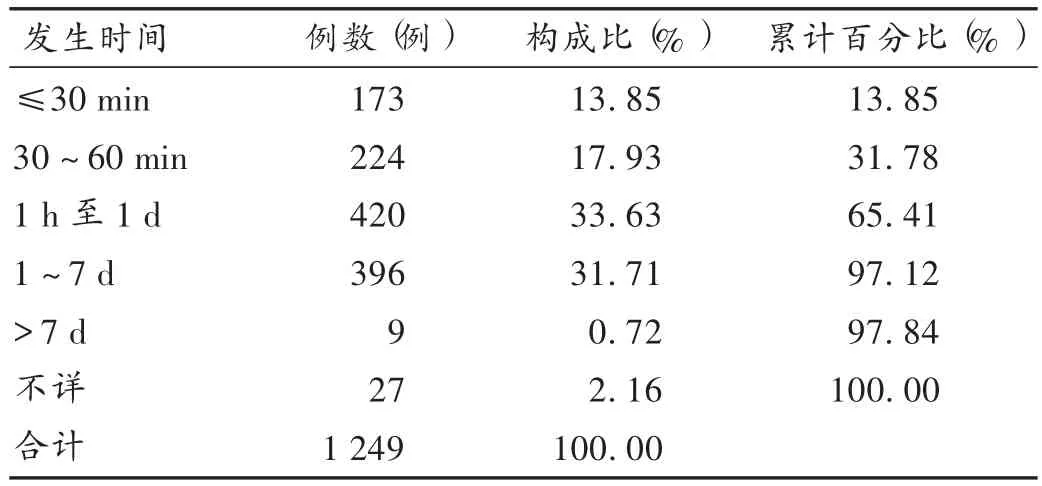
表3 ADR/ADE发生时间
2.4 ADR/ADE累及系统/器官及临床表现
报告中ADR/ADE主要累及胃肠道系统、皮肤及其附件,以及中枢及外周神经系统,主要表现为恶心、呕吐、皮疹、瘙痒、头晕等。详见表4。

表4 ADR/ADE累及系统/器官及主要临床表现
2.5 不良反应转归
经过停药、观察或积极治疗后,除5例患者结果不详外,其余均痊愈或好转。
2.6 关联性评价
结果见表5。
2.7 药品说明书对比结果
以ADR/ADE报告数排前3的诺氟沙星、左氧氟沙星和环丙沙星的药品说明书为例进行对比分析。结果发现,1)在原国家食品药品监督管理总局仅查到环丙沙星有进口注册信息。国内外对比发现,进口药品说明书描述全面详细,国产药品说明书信息特别是安全性信息描述过于简单,如ADR项中无肌肉骨骼系统损害、严重皮肤及其附件损害、心血管系统损害、异常视觉等的风险警示;2)国产环丙沙星和诺氟沙星口服制剂不同品种间产品说明书的安全性信息项,除儿童用药项有“不宜使用”和“禁用”两种不同表述外,其他如ADR、禁忌、注意事项、药物过量等信息描述基本一致;3)国内企业左氧氟沙星口服制剂说明书描述一致,安全性信息描述也相对全面、详细,但未见致视觉异常的风险提示。
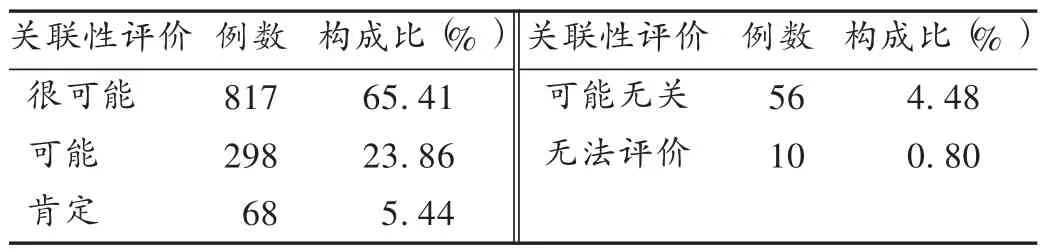
表5 ADR/ADE关联性评价结果
3 讨论
3.1 相关因素分析
患者个体因素:《抗菌药物临床应用指导原则》中喹诺酮类抗菌药物注意事项中提示,未成年(18岁以下)患者应避免使用该类药物[3]。但本组资料中仍有22例未成年患者使用该类药物发生ADR。报告中男性略多于女性,这与杜洋[4]的报道一致;年龄以19~64岁居多,原因可能与成年患者使用该类药物频率较高有关。
发生时间:本组资料中,1 d内发生ADR/ADE的比例较高,这与刘芳群[5]的报道一致。因此,在应用氟喹诺酮类药物时,医护人员应重点观察用药第1天的临床反应,及时处理,避免严重ADR发生。
临床表现:表4可见,氟喹诺酮类口服制剂所致ADR/ADE可累及机体多个系统/器官,主要累及胃肠道系统、皮肤及其附件和中枢及外周神经系统。主要ADR有恶心、呕吐、皮疹、瘙痒、头晕等,这与前文新加坡警示中和说明书上标注的ADR基本一致。ADR还有心悸和视觉损害,但国产药品说明书中无相关风险提示。有研究显示,氟喹诺酮类药物可引发QT间期延长[6],其导致严重心律失常的发生率为每年0.47‰[7]。使用氟喹诺酮类药物可增加发生严重心律失常的危险程度,但不同品种间有差异[8],如司帕沙星与格帕沙星均因为可致QT间期延长而退市[9]。口服氟喹诺酮类药物患者视网膜脱落风险增加,但仅限正在使用该类药物的患者,提示视网膜脱落属急性ADE[10]。氟喹诺酮类药物引起视网膜脱落风险增加的机制可能为药物破坏胶原和结缔组织,导致玻璃体后脱离,进而增加视网膜脱落的风险[11]。
药品分布:目前,氟喹诺酮类药物已发展到第4代,但本组资料报告排名前3位的均为第3代氟喹诺酮类,这与杜洋[4]的研究结果一致。原因可能与第3代该类药效果较好,以及第4代该类药物价格相对昂贵,导致临床使用受限有关[12]。
3.2 国产药品说明书仍需规范
药品说明书是指导临床正确合理用药的重要依据。对比发现,国产企业喹诺酮类口服制剂说明书描述差异不大;与进口药品说明书相比,环丙沙星口服制剂国产药品说明书特别是安全性信息的描述过于简单,ADR项缺少相应风险警示;国内企业左氧氟沙星口服制剂说明书描述一致,安全性信息描述也相对全面、详细,与2012年12月原国家食品药品监督管理总局发布《关于修订左氧氟沙星口服和注射剂说明书的通知》有关。建议国内生产企业应加强上市前临床试验和上市后药物监测等基础研究;对可能存在潜在风险的药品,药品监督管理部门应加大监管力度,促进国内企业药品说明书进一步规范、完善,使之更具有科学性和临床用药指导性,保障临床用药安全。
3.3 对策建议
医师应按药品说明书的指导开具氟喹诺酮类药品,详细了解该类药品的用法用量、禁忌证、注意事项、ADR、药物相互作用、特殊人群用药等信息,合理使用。应重视该类药物可能引发的ADR,特别是心脏毒性和视觉损害。国内企业应加强上市前临床试验和上市后药物监测等基础研究,明确该类药物与心脏毒性和视觉损害风险的关联性;药品监督管理部门应加强对该类药物的重点监测,督促企业主动、积极修改、修订药品说明书,保障公众用药安全有效。

