CO2浓度增高对水稻籽粒淀粉代谢相关酶活性的影响*
王惠贞,武荣盛,蔺汝罡,韩 雪
CO2浓度增高对水稻籽粒淀粉代谢相关酶活性的影响*
王惠贞1,武荣盛1,蔺汝罡2,韩 雪3
(1.内蒙古生态与农业气象中心,呼和浩特 010051;2.内蒙古自治区气象局,呼和浩特 010051;3.中国农业科学院农业环境与可持续发展研究所,北京 100081)
以高产优质粳稻松粳9号和稻花香2号为材料,利用开放式空气CO2浓度富集系统(FACE)实验平台,研究CO2浓度增高对水稻籽粒淀粉代谢相关酶活性的影响。试验设正常大气CO2浓度(400±40μmol·mol−1)和高CO2浓度(600±60μmol·mol−1),测定开花后两个水稻品种籽粒中ADPG焦磷酸化酶、淀粉合成酶和淀粉分支酶活性的变化。结果表明,CO2浓度增高对不同灌浆进程中酶活性的影响程度有显著差异,对乳熟期之后ADPG焦磷酸化酶、可溶性和颗粒型淀粉合成酶活性的表达均有较明显的促进作用,仅阻碍了乳熟期籽粒中淀粉分支酶活性的表达;淀粉代谢相关酶活性对CO2浓度增高的响应因品种而异,松粳9号籽粒中ADPG焦磷酸化酶活性受CO2浓度增高的影响较大,而稻花香2号淀粉合成酶活性受其影响更大。说明随着灌浆进程的推进,CO2浓度增高对淀粉生物合成途径中关键酶活性表达的影响程度存在明显的时段特征,且不同品种的响应程度有显著差异,总体来看,CO2浓度增高可在一定程度上促进淀粉代谢相关酶活性的表达。
CO2浓度;FACE系统;水稻;ADPG焦磷酸化酶;淀粉合成酶;淀粉分支酶
大气CO2浓度增高对作物影响已成为全球关注的热点问题之一[1]。根据世界气象组织(WMO)的年度报告,至2012年底全球大气CO2浓度比工业革命前的280µmol·mol−1增加了约42.86%,预计到21世纪中期将达550µmol·mol−1,21世纪末将增至936µmol·mol−1[2−4]。水稻是世界最重要的三大粮食作物之一,中国水稻的种植面积为3000万hm2左右,居世界第二[5]。大气CO2浓度变化必然影响水稻的生长发育和生理过程[6−8],水稻籽粒胚乳中淀粉代谢相关酶是影响水稻品质的关键因素,因此,研究CO2浓度增高对淀粉代谢相关酶活性的影响对于未来优质水稻栽培和品种选育具有重要意义。
淀粉的生物合成是由一系列酶调控的反应过程[9−11]。关于水稻籽粒灌浆过程中有关酶活性与淀粉积累关系的研究认为,ADPG焦磷酸化酶、淀粉合成酶和淀粉分支酶对控制淀粉合成与积累作用较大[12−13],其中ADPG焦磷酸化酶和颗粒结合型淀粉合成酶催化直链淀粉的合成[14−15],ADP葡萄糖焦磷酸化酶、可溶性淀粉合成酶和淀粉分支酶催化支链淀粉的合成[9,16−17]。关于温度、光照、水分胁迫对上述酶活性变化影响等方面国内外已有很多研究[18−22],但CO2浓度增高对水稻籽粒中淀粉代谢相关酶活性影响方面的研究尚未见报道。因此,本研究旨在采用更接近于自然环境的开放式空气CO2浓度富集(FACE)系统对水稻籽粒淀粉代谢相关酶活性变化进行探讨,深入研究CO2增高对水稻淀粉代谢相关酶活性的影响。
1 材料与方法
1.1 试验地概况与土壤类型
FACE实验平台位于中国农业科学院昌平实验基地(40°08´N,116°08´E),土壤类型属褐潮土,土壤含有机质18.27g·kg−1,全氮10.38g·kg−1,全磷1.14g·kg−1,全钾14.17g·kg−1,碱解氮94.83mg·kg−1,速效磷49.10mg·kg−1,速效钾104.28mg·kg−1,pH为8.28。
1.2 供试材料
选用粳稻品种松粳9号(典型特征为高产稳产,平均产量10.5t·hm−2)和稻花香2号(典型特征为优质,全部指标达到农业部优质米一级标准)。松粳9号出苗−成熟需≥10℃活动积温2650℃·d,株高95~100cm,穗长20cm左右;稻花香2号需≥10℃活动积温2800℃·d左右,株高100~105cm,穗长21cm左右。
1.3 试验设计
试验采用miniFACE系统进行。设定2个CO2浓度水平,分别为大气CO2(400±40μmol·mol−1)和高CO2的FACE圈(600±60μmol·mol−1),误差约为10%,各设3次重复,即3个FACE圈,3个对照圈。采用盆栽试验,盆长55cm,宽40cm,深30cm,裂区设计,每圈种植水稻60盆,两品种各30盆,每盆播种6穴,每穴精选苗4株。
5月16日育苗,6月15日移栽,同时开始对FACE圈内通CO2气体至收获。移栽时对各盆施尿素4g,磷酸二铵4g,氯化钾2g,7月6日追加氯化钾3g。FACE圈与对照圈管理方式相同,移栽前盆土浇透水,水分管理(灌溉时间)与大田相同。10月2日全部收获。
1.4 生育期确定
参照国家水稻研究中心水稻生育期的划分标准,结合试验实际情况,两品种发育期较接近,8月16日进入抽穗开花始期(穗顶端从叶鞘露出并开花),8月20日植株约50%抽穗(抽穗开花盛期),8月28日进入齐穗期(植株80%出穗),8月31日进入乳熟期(籽粒内容物呈白色乳浆状,背部仍为绿色),9月16日进入蜡熟期(籽粒内容物浓黏,无乳状物出现,手压穗中部籽粒有坚硬感,米粒背部绿色逐渐消失,谷壳微黄),9月26日为完熟期(谷壳变黄,不易破碎,可以收获)。
1.5 测定项目及方法
1.5.1 制样
抽穗开花初期,各小区选择穗型大小基本一致且开花1/3的分蘖穗100个,于穗上部颖花开花之日在穗颈部挂牌标记颖花开花日期。自8月20日起每隔8d各小区随机选取同日开花的挂牌穗10个,取样时间为10:00−12:00,取样5次,取样后用铝箔包裹,放入液氮中冷冻,再装入自封袋中,在−80℃超低温冰箱中保存。取样完毕后进行统一测定,各处理3次重复,测定方法参照李天等[22−23]的方法,略有改进。
测定时每穗选取灌浆基本一致的穗中部强势粒3粒用于酶活性测定,去内外颖,加1mL GS-buffer [100mmol·L−1Hepes-NaOH(pH7.4)、8mmol·L−1MgCl2、2mmol·L−1K2HPO4、2mmol·L−1Na2-EDTA、12.5% (V/V) Glycerol]、0.05g的PVPP(聚乙烯吡咯烷酮)和3.6µL的2-ME(2-巯基乙醇),冰浴研磨,离心10min(2℃,15000r·min−1),取上清液得到可溶性粗酶液。对沉淀部分加入0.5mL GS-buffer,离心10min,去除上清液,重复2次,得到的沉淀测定时加1mL GS-buffer混匀即为不溶性粗酶液。
1.5.2 仪器和耗材
包括紫外分光光度计/酶标仪、水浴锅、台式离心机、可调式移液器、微量石英比色皿/96孔板、研钵、冰和蒸馏水等。
1.5.3 ADPG焦磷酸化酶活性测定
1.5.3.1 测定意义
淀粉的生物合成途径中,ADPG焦磷酸化酶的作用是将葡萄糖-1-磷酸中的葡萄糖残基转移到ATP上生成ADPG,进而合成淀粉,这是淀粉生物合成的重要调节位点,是淀粉合成过程中的关键酶[24]。
1.5.3.2 测定原理
ADPG焦磷酸化酶作用机理为

6-P-葡萄糖脱氢酶是戊糖途径调控酶,催化不可逆反应,NADPH反馈抑制酶的活性。反应中生成的NADPH由于含有二氢吡啶环,在340nm处有一吸收峰。
1.5.3.3 测定方法
冰浴中,取粗酶液20μL加入230μL反应液[100mmol·L−1Hepes-NaOH(pH7.4)、3mmol·L−13-PGA、1.2mmol·L−1ADPG、3mmol·L−1NaH2PO4、5mmol·L−1MgCl2、4mmol·L−1DTT、蒸馏水],30℃振动反应20min,100℃沸水中30s终止反应,加入450µL蒸馏水, 移至小试管离心(2℃,15000r·min−1)取上清液至3mmol石英比色杯中, 加入10mg·mL−1NADP15µL,覆膜振动,紫外分光光度计测定波长340nm下吸光度,分别加入1µL PGM和G-6-PDH,再次测定波长340nm下吸光度。
1.5.4 淀粉合成酶活性测定
1.5.4.1 测定意义
ADPG生成后,在淀粉合成酶的催化下,葡萄糖残基以α-1,4糖苷键掺入葡聚糖引物的非还原末端,延长一个葡萄糖单位。根据在淀粉体中存在状态的不同,将淀粉合成酶分为颗粒结合型淀粉合成酶(Granule-bound starch synthase,GBSS)和可溶性淀粉合成酶(Soluble starch synthase,SSS)[10,25]。可溶性淀粉合成酶主要存在于质体的基质中,与淀粉分支酶一起合成支链淀粉;而颗粒结合型淀粉合成酶是与直链淀粉合成直接有关的酶。
1.5.4.2 测定原理
可溶性淀粉合成酶作用机理为
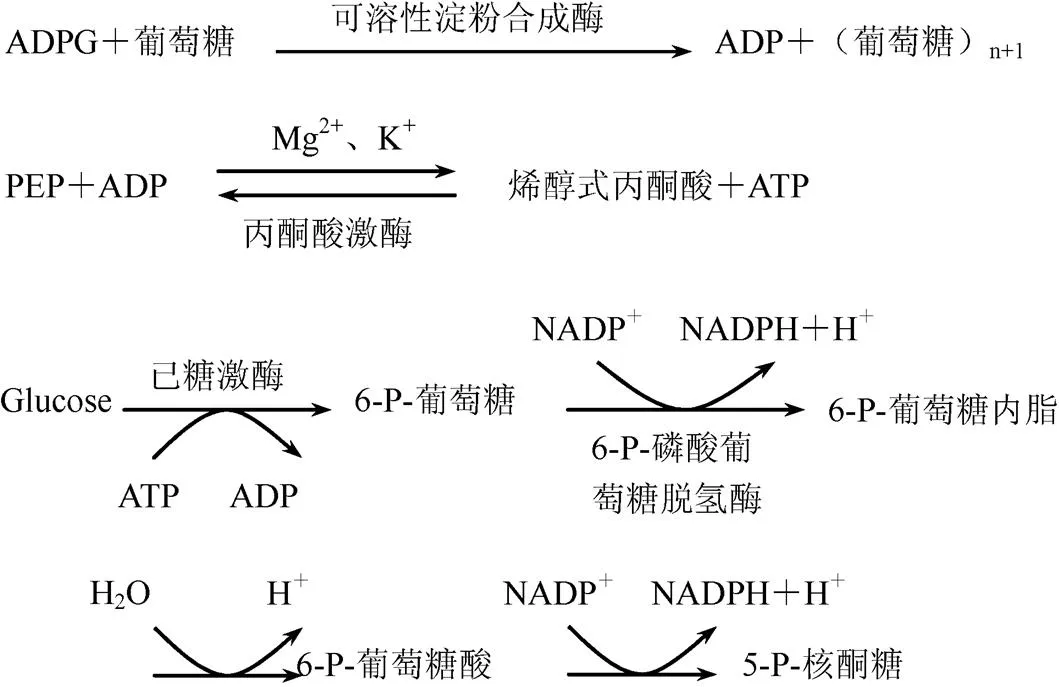
1.5.4.3 测定方法
(1)可溶性淀粉合成酶:冰浴中,取40µL粗酶液加入140µL反应液[50mmol·L−1Hepes-NaOH (pH7.4)、15mmol·L−1DTT、1.6mmol·L−1ADPG、20mg·mL−1Glycogen]和100µL蒸馏水,30℃振动反应40min,100℃沸水中2min终止反应。加入100µL反应液[50mmol·L−1Hepes-NaOH (pH7.4)、4mmol·L−1PEP、200mmol·L−1KCl、10mmol·L−1MgCl2、2µL Pyruvate kinase]于30℃震动反应30min,沸水中2min终止反应,加入100µL蒸馏水,移入小试管中离心(2℃,15000r·min−1)。取上清至3mmol石英比色杯中, 加入200µL反应液[50mmol·L−1Hepes-NaOH( pH7. 4)、20mmol·L−1MgCl2、10mmol·L−1Glucose、2mmol·L−1NADP、20µL蒸馏水],加入2µL G-6-PDH,于340nm波长下测定吸光度。
(2)颗粒结合型淀粉合成酶活性:取等量(40µL)不溶性粗酶液,方法同可溶性淀粉合成酶活性测定。
1.5.5 淀粉分支酶测定
1.5.5.1 测定意义
淀粉分支酶(Starch branching enzyme,SBE)又称Q酶。该酶对淀粉合成具有两方面意义,首先,使淀粉的α-1,4-糖苷键连接的直链变为含有α-1,6-糖苷键连接的支链,使葡聚糖的分子量不断增大,以便让有限的细胞空间能容纳更多的具有能量的物质;第二,α-1,6糖苷键的导入使葡聚糖的非还原性末端增加,有利于ADPG焦磷酸化酶和淀粉合成酶的催化反应,使它们能在短时间内催化合成更多的淀粉[10]。
1.5.5.2 测定原理
在淀粉合成过程中,淀粉分支酶能切开α-1,4-葡聚糖直链供体(直链淀粉或支链淀粉的直链区)的α-1,4-糖苷键并同时催化所切下的短链与受体链(原链或其他链)间α-1,6-糖苷键的形成,从而产生分支的糖链,促进支链淀粉的合成。
1.5.5.3 测定方法
冰浴中,取粗酶液40µL加入60µL反应液[50mmol·L−1Hepes-NaOH (pH7.4)、1.25mmol·L−1AMP、5mmol·L−1 G1P、3mg·mL−1Phosphorylase]和100µL蒸馏水,30℃下振动反应30min, 加入100µL HCl终止反应,加入500µL DMSO试剂、0.1% I2和700µL浓度为1%的KI,移至3mmol石英比色杯中,于540nm波长下测定吸光度。
1.6 统计分析
以SPSS统计软件进行数据处理和方差分析,检验CO2处理和品种间的显著性差异,用Excel绘制图表。
2 结果与分析
2.1 CO2浓度增高对水稻籽粒ADPG焦磷酸化酶活性的影响
在叶绿体内淀粉的合成中,ADPG焦磷酸化酶是合成葡萄糖供体ADPG的关键酶。由图1可见,在两种CO2浓度下,松粳9号(高产特征)和稻花香2号(优质特征)籽粒灌浆过程中,ADPG焦磷酸化酶活性均随灌浆进程呈现先升高后降低的变化趋势,在开花后23d(乳熟期)观测时达到最大值,但在每8d一次的观测中,处理间、品种间均有一定的差异。

图1 两种CO2浓度处理下两个水稻品种开花后籽粒中ADPG焦磷酸化酶活性变化过程的比较
注:FACE为开放式空气CO2浓度增加,AMB为正常大气CO2浓度,S为松粳9号,D为稻花香2号。*、**分别表示处理间在0.05、0.01水平上的差异显著性,ns为不显著。短线表示均方误。CO2表示CO2浓度处理间差异显著性,“品种”表示品种间差异显著性。下同。
Note: FACE is free air CO2enrichment; AMB is ambient CO2. S is Songjing9; D is Daohuaxiang2.*indicates the difference significance among treatments at 0.05 level, and**indicates the difference significance among treatments at 0.01 level , ns is no significant difference among treatments. CO2indicates the significance of difference among CO2treatments, varieties indicates the significance of difference among two varieties. The bar is mean squared error .The same as below.
图1显示,在开花后23d和41d(乳熟期和完熟期)观测时,FACE圈(CO2增高)内两个水稻品种籽粒中ADPG焦磷酸化酶活性均极显著高于对照圈(P<0.01),其中松粳9号两个处理间在乳熟期差异最大,增幅为29.51%,而稻花香2号两个处理间在完熟期差异最大,增幅为21.31%;但在开花后14d(齐穗期)观测时,FACE圈(CO2增高)内两个水稻品种籽粒中ADPG焦磷酸化酶活性均极显著低于对照圈(P<0.01),松粳9号和稻花香2号降幅分别为18.58%和7.58%。可见,对两个水稻品种而言,在齐穗期,CO2增高阻碍了籽粒中ADPG焦磷酸化酶活性的表达,但在乳熟期和完熟期,CO2增高有利于籽粒中ADPG焦磷酸化酶活性的表达。
比较两个水稻品种籽粒中ADPG焦磷酸化酶活性可见,在两种CO2浓度条件下,抽穗开花后各发育期松粳9号籽粒中ADPG焦磷酸化酶活性均高于稻花香2号,且该品种受CO2浓度增高的影响更大,表现最突出的是开花后23d(乳熟期)的观测结果,松粳9号胚乳中ADPG 焦磷酸化酶活性峰值(平均为35.61U·grain−1·min−1)比稻花香2号(平均为24.08 U·grain−1·min−1)高47.88%,差异达极显著(P<0.01),且在正常大气CO2浓度和高浓度CO2条件下,胚乳中ADPG 焦磷酸化酶活性峰值品种间差异分别为37.14%和57.38%。可见,籽粒灌浆过程,与稻花香2号相比,松粳9号籽粒中ADPG焦磷酸化酶活性更高,且受CO2浓度增高的影响更大。
2.2 CO2浓度增高对水稻籽粒淀粉合成酶活性的影响
2.2.1 可溶性淀粉合成酶活性
可溶性淀粉合成酶游离于造粉体基质中,是水稻籽粒中淀粉生物合成的调节位点,催化水稻胚乳淀粉合成的一种重要酶。由图2可见,在两种CO2浓度条件下,两个水稻品种籽粒灌浆过程中可溶性淀粉合成酶活性亦呈先升高后降低的变化趋势,松粳9号和稻花香2号分别在开花后23d(乳熟期)和32d(蜡熟期)观测时活性达到最大值,且在不同的灌浆进程中,品种和处理间存在差异。
图2显示,在开花后23~41d(乳熟期−完熟期)观测时,FACE圈(CO2浓度增高)内两水稻品种籽粒中可溶性淀粉合成酶活性均极显著高于对照圈(P<0.01),其中在开花后23d(乳熟期)两种CO2浓度处理差异最大,FACE圈松粳9号籽粒中该酶活性比对照圈内高9.55%、稻花香2号高66.67%。可见,对两个水稻品种而言,在乳熟期之前,CO2浓度增高对籽粒中可溶性淀粉合成酶活性的表达影响不大,而乳熟期之后,CO2浓度增高促进籽粒中可溶性淀粉合成酶活性的表达。
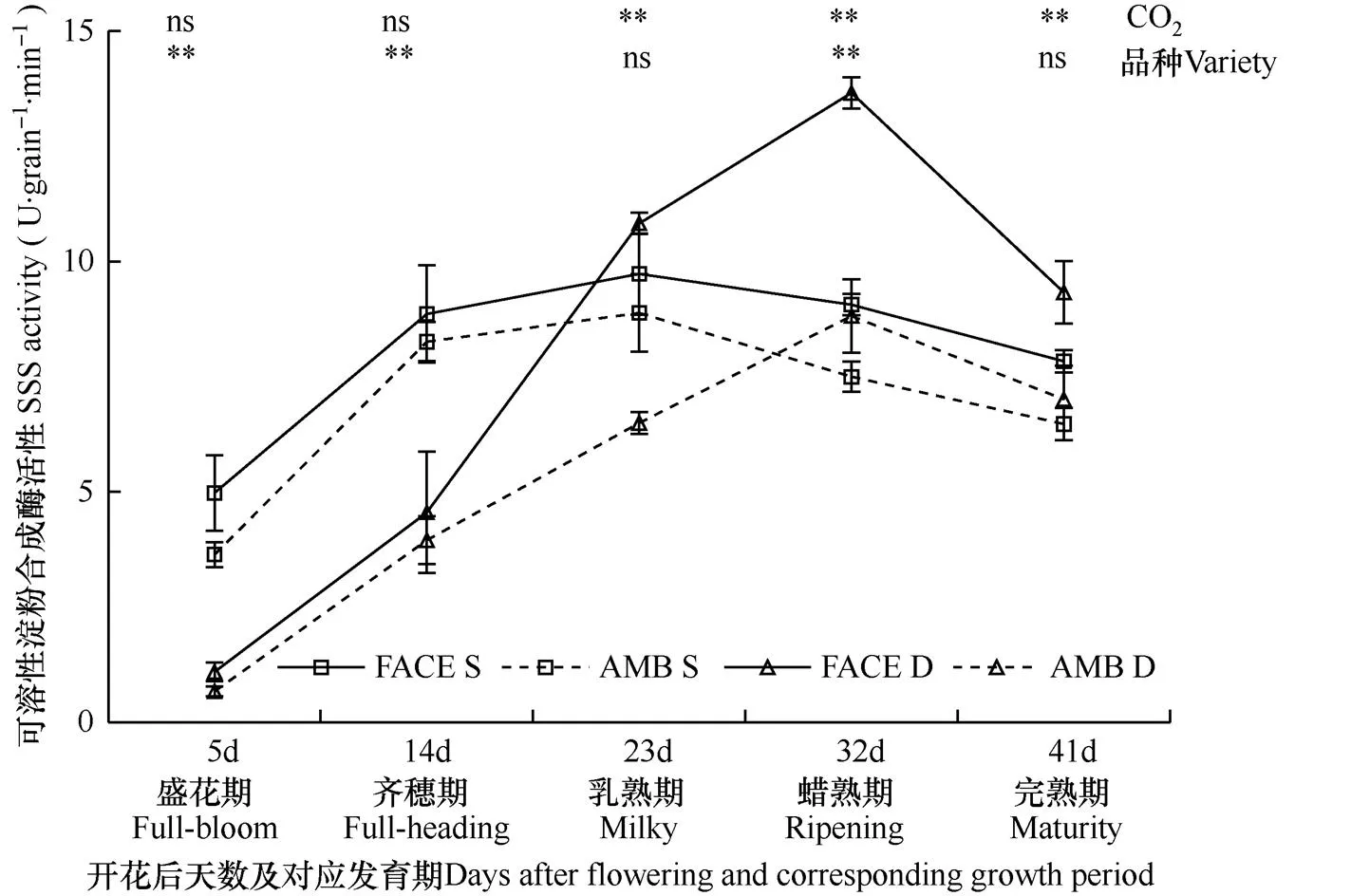
图2 两种CO2浓度处理下两个水稻品种开花后籽粒可溶性淀粉合成酶活性变化过程的比较
比较两个水稻品种籽粒中可溶性淀粉合成酶活性可见,在两种CO2浓度条件下,抽穗开花后各发育期,稻花香2号受CO2浓度增高的影响均更大,表现最突出的是开花后23d(乳熟期),受CO2浓度增高影响增幅达36.77%;松粳9号胚乳中可溶性淀粉合成酶活性峰值平均为9.31U·grain−1·min−1,比稻花香2号的3.43U·grain−1·min−1高1.72倍,差异达极显著(P<0.01),且在正常大气CO2浓度和高浓度CO2条件下,该酶活性峰值品种间差异分别为2.04倍和1.48倍。同时,开花后5d和14d(盛花期和齐穗期)观测的松粳9号籽粒中可溶性淀粉合成酶活性均极显著(P<0.01)高于稻花香2号,而开花后41d(完熟期)观测的松粳9号籽粒中该酶活性极显著(P<0.01)低于稻花香2号。可见,籽粒灌浆过程中,稻花香2号籽粒中可溶性淀粉合成酶活性受CO2浓度增高的影响更大,另外,齐穗期之前,松粳9号比稻花香2号活性高,且峰值也高于稻花香2号,但到成熟期,松粳9号活性下降较快。
2.2.2 颗粒型淀粉合成酶活性
颗粒型淀粉合成酶,通过表面结合或被淀粉粒包裹形式而与淀粉粒结合存在,与可溶性淀粉合成酶在淀粉体中存在的状态不同,是另一种类型的淀粉合成酶。由图3可见,在两种CO2浓度条件下,松粳9号和稻花香2号籽粒颗粒型淀粉合成酶活性随灌浆过程呈先升高后降低的趋势,开花后14d(齐穗期)活性达最高值,CO2处理与品种对籽粒颗粒型淀粉合成酶活性的影响存在差异。
图3显示,开花后23~32d(乳熟期−蜡熟期)观测时,FACE圈(CO2浓度增高)内两个水稻品种籽粒中颗粒型淀粉合成酶活性均极显著高于对照圈(P<0.01),其中,开花后32d(蜡熟期)两种CO2处理差异最大,FACE圈松粳9号籽粒中该酶活性比对照圈内高25.00%、稻花香2号籽粒中该酶活性比对照圈内高34.35%。可见,对两个水稻品种而言,乳熟−蜡熟期,CO2浓度增高促进籽粒中颗粒型淀粉合成酶活性的表达。
比较两个水稻品种籽粒中颗粒型淀粉合成酶活性可见,在两种CO2浓度条件下,抽穗开花后各发育期,稻花香2号籽粒中颗粒型淀粉合成酶活性均高于松粳9号,且该品种受CO2浓度增高的影响更大,增幅差异最明显的是开花后14d(齐穗期)的观测结果,稻花香2号比松粳9号胚乳中颗粒型淀粉合成酶活性峰值(平均为4.26U·grain−1·min−1)比松粳9号(平均为3.29U·grain−1·min−1)高22.78%,差异达极显著水平(P<0.01),且在正常大气CO2浓度和高浓度CO2条件下,该酶活性峰值品种间差异分别为13.53%和30.19%。可见,籽粒灌浆过程中,稻花香2号比松粳9号籽粒中颗粒型淀粉合成酶活性更高,且受CO2增高的影响更大,其活性峰值也高于松粳9号,在CO2浓度增高条件下两个品种水稻的颗粒型淀粉合成酶活性峰值差异更明显。

图3 两种CO2浓度处理下两个水稻品种开花后籽粒中颗粒型淀粉合成酶活性变化过程的比较
2.3 CO2浓度增高对水稻籽粒淀粉分支酶活性的影响
直链淀粉可在淀粉分支酶作用下最终形成支链淀粉。由图4可见,在两种CO2条件下,松粳9号和稻花香2号籽粒淀粉分支酶活性在抽穗开花后均呈先升高后降低的趋势,开花后14d(齐穗期)活性达高峰,CO2处理与品种对该酶活性的影响存在差异。
图4显示,在开花后5、32、41d(盛花期、蜡熟期、完熟期)观测时,FACE圈(CO2浓度增高)内两个水稻品种籽粒中淀粉分支酶活性均极显著高于对照圈(P<0.01),其中开花后32d(蜡熟期)两种CO2浓度处理差异最大,FACE圈松粳9号籽粒中淀粉分支酶活性比对照高25.15%,稻花香2号比对照高12.09%;但在开花后23d(乳熟期)观测时,FACE圈内两水稻品种籽粒中淀粉分支酶活性极显著低于对照(P<0.01),松粳9号和稻花香2号降幅分别为9.96%和5.19%。可见,对两个水稻品种而言,在盛花期、蜡熟期和完熟期,CO2浓度增高有利于籽粒中淀粉分支酶活性的表达,但阻碍了乳熟期籽粒中淀粉分支酶活性的表达。
比较两个水稻品种籽粒中淀粉分支酶的活性可见,在两种CO2条件下,抽穗开花后各发育期,观测的稻花香2号籽粒中淀粉分支酶活性均高于松粳9号,且稻花香2号胚乳中该酶活性峰值(平均为0.72U·grain−1·min−1)比松粳9号(平均为0.63U· grain−1·min−1)高11.71%,二者差异达极显著水平(P<0.01),且在正常大气CO2浓度和高浓度CO2条件下,胚乳中该酶活性峰值品种间差异分别为15.95%和7.27%。同时,开花后23d和32d(乳熟期和蜡熟期)观测的籽粒中该酶活性松粳9号比稻花香2号受CO2浓度增高影响较大,而开花后5d、14d、41d(盛花期、齐穗期和完熟期)两个品种均受CO2浓度增高影响较大。可见,籽粒灌浆过程,稻花香2号比松粳9号籽粒中淀粉分支酶活性更高,且活性峰值也高于松粳9号;另外,随着灌浆进程的变化,两个水稻品种籽粒中淀粉分支酶活性受CO2增高影响程度有较大差异。
3 结论与讨论
3.1 讨论
CO2作为卡尔文循环的底物在籽粒碳代谢中起重要作用,碳以CO2的形态进入并以糖的形态离开卡尔文循环,整个循环是以ATP作为能量来源在一系列酶的催化作用下来制造糖[26]。本研究表明,CO2增高使淀粉代谢相关酶的活性发生了一系列变化,说明CO2增高对淀粉合成相关酶的活性有明显影响,且不同程度地提高淀粉合成过程中各酶活性的峰值,而活性峰值的大小可决定酶活性的最强表达能力。
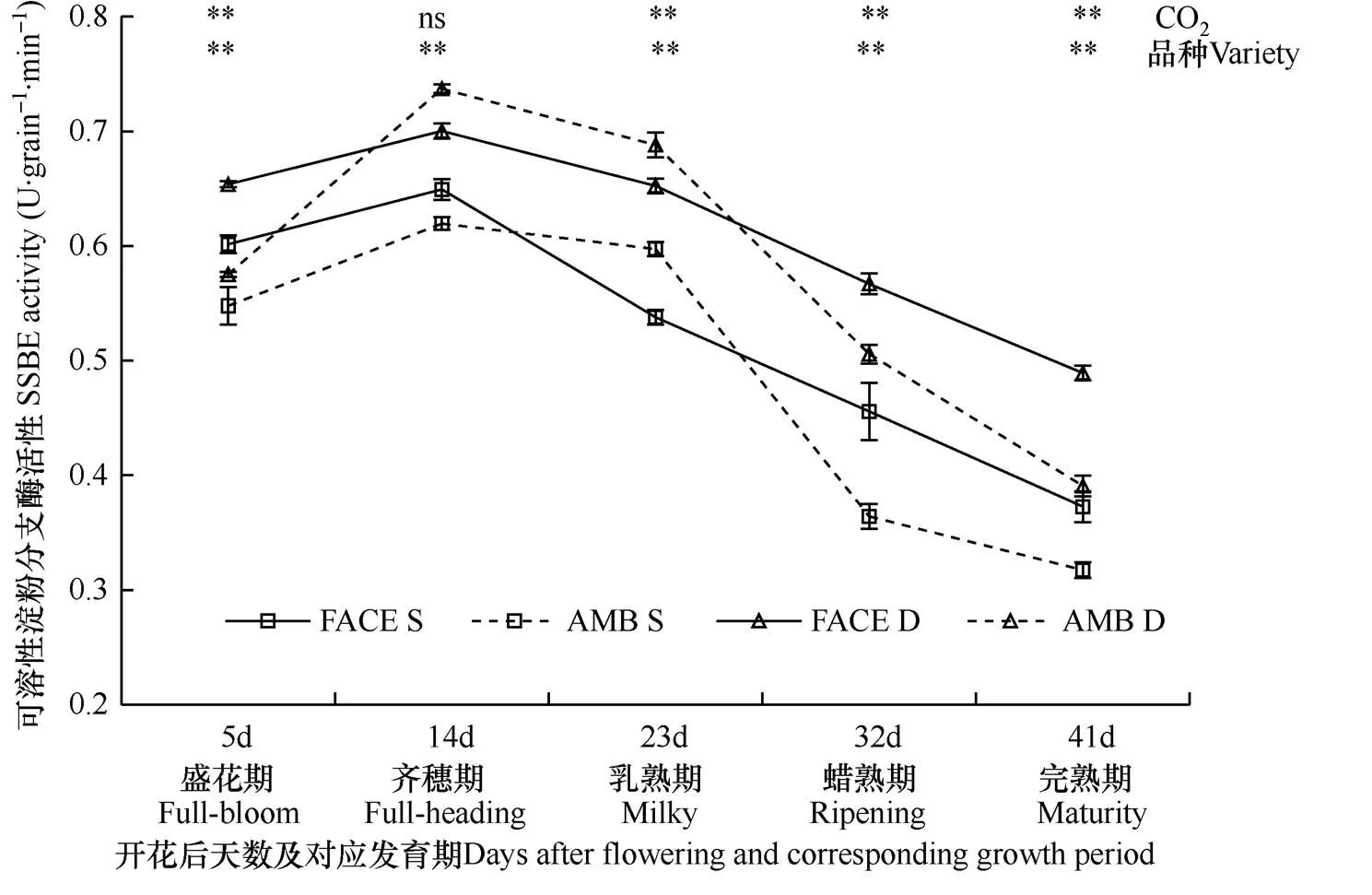
图4 两种CO2浓度处理下两个水稻品种开花后籽粒中淀粉分支酶活性变化过程的比较
ADPG焦磷酸化酶是淀粉合成代谢过程中涉及的第一个限速酶[27−28],通过消耗ATP催化葡萄糖供体ADPG的合成,乳熟期活性达最高,说明乳熟期是两个水稻品种ADPG合成量差异的关键阶段,且CO2浓度增高使该酶活性峰值有所提高,有利于合成更多的ADPG供给后期淀粉合成,且松粳9号的反应较稻花香2号更敏感,说明CO2浓度增高对高产稳产型品种松粳9号的影响相比优质型品种稻花香2号更明显,可能较大程度地增强高产品种的ADPG焦磷酸化酶活性。虽然CO2浓度增高降低了齐穗期籽粒ADPG焦磷酸化酶活性,对此期酶活性的表达有抑制作用,但到了乳熟期和完熟期该酶活性均有所提高,且乳熟期增幅最大,说明CO2浓度增高对乳熟期ADPG焦磷酸化酶活性提高的促进作用更显著,原因可能是高浓度CO2促进卡尔文循环活化更多的CO2分子,在CO2浓度增加条件下,植物充分利用环境资源,增加对CO2的固定作用,需要通过提高初始酶活性来满足碳同化时的需求。淀粉合成酶催化合成直链淀粉,CO2增高显著提高乳熟−完熟期两个水稻品种的可溶性和颗粒型淀粉合成酶活性,且稻花香2号增幅较大,乳熟期是影响直链淀粉合成的关键阶段,乳熟期ADPG焦磷酸化酶活性的提高会产生更多的ADPG,部分进入三羧酸循环促进ATP含量增加,进而促进淀粉合成酶活性的表达,说明高浓度CO2可能一定程度上促进直链淀粉的合成,且稻花香2号直链淀粉合成能力显著高于松粳9号。淀粉分支酶主要催化合成支链淀粉,盛花期、蜡熟期和完熟期,CO2浓度增高显著提高籽粒淀粉分支酶活性,原因可能是气孔萎缩减少光呼吸对能源ATP的利用,植物通过提高酶活性增加对底物的利用,该酶活性的提高还有利于ADPG焦磷酸化酶和淀粉合成酶的催化反应;CO2增高仅降低乳熟期该酶的活性,高浓度CO2可能抑制该时期的呼吸活性,从而降低淀粉分支酶对支链淀粉合成的催化作用。
另外,籽粒灌浆过程中,品种间淀粉合成相关酶活性差异较大,稻花香2号颗粒型淀粉合成酶和淀粉分支酶活性较高,说明该品种催化支链淀粉合成能力更强,松粳9号ADPG焦磷酸化酶和可溶性淀粉合成酶活性较高,说明该品种催化直链淀粉合成能力更强。
3.2 结论
灌浆期是籽粒淀粉形成的关键时期,本研究发现,随着灌浆进程的推进,松粳9号和稻花香2号两水稻淀粉合成相关酶活性均呈现先升高后降低的变化趋势,酶活性达峰值时间略有差异,其中颗粒型淀粉合成酶和淀粉分支酶活性峰值出现在齐穗期,ADPG焦磷酸化酶和可溶性淀粉合成酶活性在乳熟期达最大值,稻花香2号略偏晚。这与以往对水稻籽粒淀粉合成关键酶活性研究的趋势性结论一致[28−30]。本研究结果显示,对两水稻品种而言,CO2浓度增高对不同灌浆进程中酶活性的影响程度有显著差异,其中ADPG焦磷酸化酶、可溶性和颗粒型淀粉合成酶,在乳熟期之后有利于酶活性的表达;而对于淀粉分支酶,CO2浓度增高阻碍了乳熟期籽粒中该酶活性的表达,但在盛花期、蜡熟期和完熟期,促进了淀粉分支酶活性的表达。
籽粒灌浆过程中,淀粉合成相关酶活性亦存在品种间差异,颗粒型淀粉合成酶和淀粉分支酶活性稻花香2号比松粳9号高,且活性峰值也高于松粳9号,而ADPG焦磷酸化酶活性则表现为松粳9号比稻花香2号高,且峰值也高于稻花香2号,可溶性淀粉合成酶活性仅在齐穗期之前松粳9号比稻花香2号活性高。CO2浓度增高对两个水稻品种籽粒中酶活性影响亦有显著差异,松粳9号籽粒中ADPG焦磷酸化酶活性对CO2浓度增高的反应较敏感,而稻花香2号可溶性淀粉合成酶和颗粒型淀粉合成酶活性受CO2浓度增高的影响更大,淀粉分支酶活性随灌浆进程的变化,两个水稻品种籽粒中该酶活性受CO2浓度增高影响程度有一定差异。
[1] 王连喜,任景全,李琪.未来气候变化情景下江苏水稻高温热害模拟研究Ⅱ:孕穗−抽穗期水稻对高温热害的适应性分析[J].中国农业气象,2014,35(2):206-213.
Wang L X,Ren J Q,Li Q.Simulation of the heat injury on rice production in Jiangsu Province under the climate change scenariosⅡ:adaptability analysis of the rice to heat injury from booting to heading stage[J].Chinese Journal of Agrometeorology,2014,35(2):206-213.(in Chinese)
[2] IPCC.Intergovernmental panel on climate change:the physical science basis.In:Contribution of working groupⅠto the fourth annual assessment report of the IPCC[R].Cambridge UK: Cambridge University Press,2007:996.
[3] IPCC.Intergovernmental panel on climate change:the physical science basis.In:Contribution of working groupⅠto the fifth annual assessment report of the IPCC[R].Cambridge UK: Cambridge University Press,2013:29.
[4] NOAA.Trends in atmospheric carbon dioxide[OL].http:// www.esrl.noaa.gov/gmd/ccgg/trends/global. Html,2014-12-30.
[5] IRRI.Rice almanac:source book for the most important economic activity on earth(3rd eds)[M].Oxon,UK: CABI Publishing,2002.
[6] 刘硕,王松鹤,游松财,等.温度和CO2浓度同时升高对水稻幼苗的综合影响[J].中国农业气象,2015,36(5):578-585.
Liu S,Wang S H,You S C,et al.Comprehensive effects of CO2concentration and temperature increasing on rice seedling[J]. Chinese Journal of Agrometeorology,2015,36(5):578-585.(in Chinese)
[7] 赖上坤,庄时腾,吴艳珍,等.大气CO2浓度和温度升高对超级稻生长发育的影响[J].生态学杂志,2015,34(5):1253-1262.
Lai S K,Zhuang S T,Wu Y Z,et al.Impact of elevated atmospheric CO2concentration and temperature on growth and development of super rice[J].Chinese Journal of Ecology, 2015,34(5):1253-1262. (in Chinese)
[8] 王惠贞,赵洪亮,冯永祥,等.北方水稻生育后期剑叶可溶性物质含量及植株生产力对CO2浓度增高的响应[J].作物学报,2014,40(2):320-328.
Wang H Z,Zhao H L,Feng Y X,et al.Response of soluble substances content in flag leaves during late growth stage and plant productivity of rice to elevated CO2in North China[J]. Acta Agronomica Sinica,2014,40(2):320-328.(in Chinese)
[9] James M G,Denyer K,Myers A M.Starch synthesis in the cereal endosperm[J].Curr Opin Plant Biol,2003,6(3):215-222.
[10] 夏斌,郭涛,王慧,等.水稻淀粉合成关键酶的研究进展[J].中国农学通报,2009,25(22):47-51.
Xia B,Guo T,Wang H,et al.Progress in key enzymes of starch synthesis in rice[J].Chinese Agricultural Science Bulletin, 2009,25(22):47-51.(in Chinese)
[11] Smith A M.Making starch[J].Curr Opin Plant Biol,1999,2(3): 223-229.
[12] Jeon J S,Ryoo N,Hahn T R,et al.Starch biosynthesis in cereal endosperm[J].Plant Physiol Biochem,2010,48(6):383-392.
[13] Kato T.Change of sucrose synthase activity in developing endosperm of rice cultivars[J].Crop Sci,1995,35:827-839.
[14] Kuipers A G J,Jacobsen E,Visser R G F.Formation and deposition of amylose in the potato tuber starch granule are affected by the reduction of granule-bound starch synthase gene expression[J].The Plant Cell,1994,6(1):43-52.
[15] Macdonald F D,Preiss J.Partial purification and characterization of granule-bound starch synthases from normal and waxy maize[J].Plant Physiology,1985,78(4): 849-52.
[16] Smith A M,Denyer K.The synthesis of starch granule[J]. Annu Rev Plant Physiol Plant Mol Biol,1997,48(1):67-87.
[17] Myers A M,Morell M K,James M G,et al.Recent progress toward understanding biosynthesis of the amylopectin crystal[J].Plant Physiol,2000,122(4):989-997.
[18] Smith A M,Denyer K,Martin C R.What controls the amount and structure of starch in storage organs[J].Plant Physiol 1995,107:673-677.
[19] 王贺正,马均,李旭毅,等.水分胁迫对水稻籽粒灌浆及淀粉合成有关酶活性的影响[J].中国农业科学,2009,42(5): 1550-1558.
Wang H Z,Ma J,Li X Y,et al.Effects of water stress on grain filling and activities of enzymes involved in starch synthesis in rice[J].Scientia Agricultura Sinica,2009,42(5):1550-1558. (in Chinese)
[20] 金正勋,杨静,钱春荣,等.灌浆成熟期温度对水稻籽粒淀粉合成关键酶活性及品质的影响[J].中国水稻科学,2005, 19(4):377-380.
Jin Z X,Yang J,Qian C R,et al.Effect s of temperature during grain filling period on activities of key enzymes for starch synthesis and rice grain quality[J].Chinese J Rice Sci,2005, 19(4):377-380.(in Chinese)
[21] 李木英,石庆华,胡志红,等.高温胁迫对不同早稻品种胚乳淀粉合成酶类活性的影响[J].中国农业科学,2007,40(8): 1622-1629.
Li M Y,Shi Q H,Hu Z H,et al.Effects of high temperature stress on activity of amylosynthease in endosperm of earlyrice varieties[J].Scientia Agricultura Sinica,2007, 40(8):1622-1629.(in Chinese)
[22] 李天,大杉立,山岸,等.灌浆结实期弱光对水稻籽粒淀粉积累及相关酶活性的影响[J].中国水稻科学,2005,19(6): 545-550.
Li T,Da S L,Shan A,et al.Effects of weak light on rice starch accumulation and starch synthesis enzyme activities at grain filling stage[J].Chinese J Rice Sci,2005,19(6):545-550.(in Chinese)
[23] Nakamura Y,Yuki K,Park S Y,et al.Carbohydrate metabolism in the developing endosperm of rice grains[J].Plant Cell Physiology,1989,30:833-839.
[24] Okita T W.Is there an alternative pathway for starch synthesis [J].Plant Physiol,1992,100:560.
[25] 曲莹,金正勋,刘海英,等.粳稻杂种后代胚乳可溶性淀粉合成酶及同工型基因表达特性分析[J].中国水稻科学,2014, 28(1):23-31.
Qu Y,Jin Z X,Liu H Y,et al.Analysis of expression characters of soluble starch synthase and isoform genes involved in japonica hybrid progeny[J].Chinese J Rice Sci,2014,28(1): 23-31.(in Chinese)
[26] 梁建生,曹显祖,徐生,等.水稻籽粒库强与其淀粉积累之间关系的研究[J].作物学报,1994,20(6):685-691.
Liang J S,Cao X Z,Xu S,et al.Studies on relationship between the grain sink sthength and It’s starch accumulation in rice()[J].Acta Agronomica Sinica,1994,20(6): 685-691.(in Chinese)
[27] Okita T W.Is there an alternative pathway for starch synthesis [J].Plant Physiol,1992,100:560-564.
[28] 杨建昌,彭少兵,顾世梁,等.水稻灌浆期籽粒中3个与淀粉合成有关的酶活性变化[J].作物学报,2001,27(2):157-164.
Yang J C,Peng S B,Gu S L,et al.Changes in activities of three enzymes associated with starch synthesis in rice grains during grain filling[J].Acta Agronomica Sinica,2001,27(2): 157-164.(in Chinese)
[29] 钟连进,程方民.水稻籽粒灌浆过程直链淀粉的积累及其相关酶的品种类型间差异[J].作物学报,2003,29(3):452-456.
Zhong L J,Cheng F M.Varietal differences in amylose accumulation and activities of major enzymes associated with starch synthesis during grain filling in rice[J].Acta Agronomica Sinica,2003,29(3):452-456.(in Chinese)
[30] 沈鹏,金正勋,罗秋香,等.水稻灌浆过程中籽粒淀粉合成关键酶活性与蒸煮食味品质的关系[J].中国水稻科学,2006, 20(1):58-64.
Shen P,Jin Z X,Luo Q X,et al.Relationship between activity of key starch synthetic enzymes during grain filling and quality of eating and cooking in rice[J].Chinese J Rice Sci,2006,20(1):58-64.(in Chinese)
Effect of Elevated CO2to Starch Metabolizing Enzyme Activities in Grains of Rice
WANG Hui-zhen1, WU Rong-sheng1, LIN Ru-gang2, HAN Xue3
(1. Inner Mongolia Ecological and Agricultural Meteorological Center, Hohhot 010051, China; 2. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081; 3. Inner Mongolia Meteorological Bureau, Hohhot 010051)
Free-air CO2Enrichment (FACE) experimental system was conducted to find out the change trend of relevant enzymes activity about grain starch synthesis in atmospheric CO2concentration, using high yield and good qualityvarieties Songjing 9 and Daohuaxiang 2. It was treated with two atmospheric CO2concentrations: elevated carbon dioxide(600±60μmol·mol−1) and ambient carbon dioxide(400±40μmol·mol−1). The ADPG pyrophosphorylase enzyme activity, starch synthase enzyme activity and starch branching enzyme activity in grains of two rice varieties were measured after flowering. The results showed that the effect of elevated CO2on the enzyme activity during different grain-filling processes was significantly different, which obviously promoted the expression of ADPG pyrophosphorylase enzyme, soluble and granular starch synthase enzyme activity after the milky stage, but only hindered the expression of starch branching enzyme activity in the grain endosperm at milky stage. Meanwhile, response of starch metabolizing enzyme to elevated CO2had the genotypic difference with different rice varieties. For the activity of ADPG pyrophosphorylase enzyme, Songjing9 was more affected by elevated CO2, while Daohuaxiang2 was more affected by elevated CO2for the activity of starch synthase enzyme. The conclusion showed that there was an obvious time characteristics about the influence degree of elevated CO2to expression of the key enzyme activity during the starch biosynthetic pathway, with the advancement of grouting process. Response degree of different varieties rice on elevated CO2existed significant differences. Overall, atmospheric CO2concentration could promote the synthesis of starch in a certain extent.
Elevated CO2;Free-air carbon dioxide enrichment(FACE); Rice; ADPG pyrophosphorylase enzyme; Starch synthase enzyme; Starch branching enzyme
10.3969/j.issn.1000-6362.2019.04.004
2018−10−15
中国气象局气候变化专项(CSF201606);国家自然科学基金(41505100)
王惠贞(1988-),女,工程师,研究方向为农业气象。E-mail: whz0301@163.com
王惠贞,武荣盛,蔺汝罡,等.CO2浓度增高对水稻籽粒淀粉代谢相关酶活性的影响[J].中国农业气象,2019,40(4):230-239

