纳他霉素的大孔树脂原位吸附动力学研究
郑迎莹 王大红,2 徐 鹏 沈文浩 张 颖
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.河南省食品微生物工程技术研究中心,河南 洛阳 471023)
食品在贮存中容易引起腐败变质,添加食品防腐剂是食品保藏的有效手段,近年来,天然防腐剂的研究与使用逐渐吸引了人们的注意力,并已成为食品保藏研究的热点[1-2]。纳他霉素是由纳塔尔链霉菌等链霉菌发酵产生的一种二十六元多烯大环内酯类物质,对几乎所有的霉菌和酵母菌都具有抗性,并能抑制真菌毒素的产生[3],具备高效、安全、稳定性高等优良性质,有着巨大的应用前景和生产价值,到目前为止已被全球大多数国家批准作为食品防腐剂使用[4]。纳他霉素的生产主要采用发酵法,由于纳他霉素的产量较低,工业化生产进展缓慢,导致价格较高,目前其主要集中应用于高附加值的产品中[5]。
纳他霉素是胞内产物,在其生物合成过程中,由于菌体细胞和胞内的酶都受到高浓度产物纳他霉素的反馈抑制作用,使得生物细胞及酶的潜力不能充分发挥,导致纳他霉素的产率和原料的转化率难以提高。目前,有关纳他霉素的研究[6-7]多集中在采用菌株选育、发酵条件和工艺优化、代谢调控等方式提高发酵产量上,而在发酵产物分离和产物抑制等方面研究较少。原位分离技术是一种将生物合成与目标代谢产物分离相耦合的技术,已受到中国研究者的重视,该技术可选择性地从发酵液中连续分离有抑制性或者有毒性的代谢产物,不仅能够减弱终产物的反馈抑制作用,同时还能提高产物的回收率,减少有机溶剂的使用,其中采用大孔吸附树脂的原位分离技术应用较为广泛[8]。大孔吸附树脂是一种不溶于酸、碱及有机溶剂的有机高分子聚合物,是一种新型分离材料,已广泛应用到天然产物的提取分离、药物、环境保护等方面[9]。目前,大孔吸附树脂已被用于纳他霉素的纯化中,如魏宝东等[10]采用甲醇做溶剂,从发酵液中提取纳他霉素,然后采用D101大孔吸附树脂进一步纯化,回收率为82.12%,纯度为 91.2%;但到目前为止,还未见采用大孔树脂原位吸附的方法弱化或移除发酵过程中纳他霉素的反馈来提高纳他霉素产量的报道。该技术在其他微生物源代谢产物的发酵过程中已被广泛使用,如:在普那霉素发酵过程中添加JD-1大孔树脂能吸附发酵液中90%的普那霉素,使普那霉素的发酵产量从0.29 g/L提高到1.03 g/L[11];在琥珀酸发酵过程中加入40 g/L D301R 树脂,至发酵终点琥珀酸产量达到49.46 g/L,相比普通发酵过程,底物转化率提高了21%[12]。试验采用StreptomycesnatalensisHW-2为纳他霉素生产菌株,以建立纳他霉素的发酵和分离耦合体系为目的,通过筛选对纳他霉素具有良好吸附效果的大孔吸附树脂,探讨大孔吸附树脂原位分离技术发酵纳他霉素的可行性,并对这一过程的静态吸附动力学行为进行研究,获得最佳工艺参数,为纳他霉素的生产和分离提供新的思路。
1 材料与方法
1.1 材料
纳塔尔链霉菌(Streptomycesnatalensis)HW2:实验室保藏;
HPD100、HPD300、HPD450和HPD600大孔树脂:沧州宝恩公司;
D101大孔树脂:海光化工有限公司;
AB-8大孔树脂:天津南大树脂科技有限公司;
XAD-16HP大孔树脂:美国罗门哈斯公司;
NKA和HZ816大孔树脂:郑州和成新材料科技有限公司;
斜面培养基:葡萄糖10 g/L,麦芽浸粉3 g/L,蛋白胨5 g/L,酵母粉3 g/L,琼脂20 g/L,pH 7.2;
种子培养基:葡萄糖10 g/L,胰蛋白胨5 g/L,麦芽浸粉5 g/L,氯化钠10 g/L,pH 7.2;
发酵培养基:葡萄糖30 g/L,酵母浸膏2 g/L,牛肉膏10 g/L,pH 7.2;
甲醇:分析纯,天津德恩化学试剂有限公司;
甲醇:色谱纯,西陇科学股份有限公司;
葡萄糖:分析纯,天津科密欧化学试剂有限公司;
分析天平:ME104E /02型,梅特勒—托利多国际贸易(上海)有限公司;
高效液相色谱仪:Agilent 1260型,美国安捷伦科技有限公司。
1.2 方法
1.2.1 培养方法 斜面上生长成熟的孢子制成孢子悬液,按照体积分数2%的比例接种于种子培养基中,于28 ℃、180 r/min振荡培养48 h;将培养好的种子液按体积分数6%的比例接入发酵培养基中,28 ℃、200 r/min振荡培养120 h。
1.2.2 纳他霉素的提取 取发酵液与甲醇按体积比1∶9比例混合,28 ℃、180 r/min振荡解吸2 h,10 000 r/min离心10 min,吸取上清液,过0.22 μm微孔滤膜,得待测液;取出树脂,洗涤过滤,晾干,放入发酵液等体积的甲醇中,解吸(方法同上),10 000 r/min离心10 min,得到待测样品。
1.2.3 纳他霉素含量的测定 采用高效液相色谱法,液相条件为:YMC-Pack ODS C18柱(250 mm×4.6 mm,粒径5 μm),流动相为甲醇—水(体积比75∶25),进样量10 μL,流速0.8 mL/min,检测波长304 nm。
1.2.4 大孔树脂预处理 参照文献[13]。
1.2.5 大孔树脂含水量测定 试验用树脂为干树脂,称取预处理过的大孔树脂10 g,60 ℃烘至恒重,并按照文献[13]的方法计算各树脂的含水量。不同树脂的物理性质及含水量见表1。
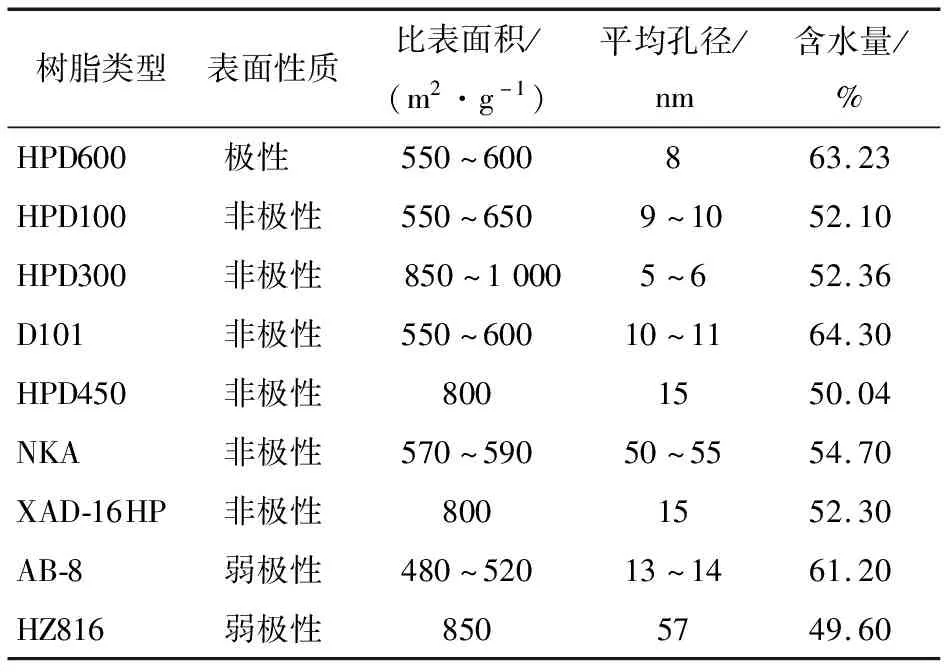
表1 不同树脂的性质和含水量
1.2.6 静态吸附试验 根据文献[14]修改如下:取预处理过的干树脂各2 g,分别加入装有30 mL 50 mg/L纳他霉素水溶液的三角瓶中,28 ℃、180 r/min振荡吸附12 h。取0.2 mL上清液加1.8 mL甲醇,0.22 μm微孔滤膜过滤,测定纳他霉素的含量,分别根据式(1)、(2)计算树脂吸附量及吸附率。
(1)
(2)
式中:
Q——吸附量,mg/g干树脂;
C0——纳他霉素初始质量浓度,g/L;
C1——吸附后溶液中纳他霉素质量浓度,g/L;
V——溶液体积,mL;
m——大孔树脂质量,g;
η——吸附率,%。
1.2.7 静态解吸试验 根据文献[15]修改如下:选用甲醇作为纳他霉素的解吸剂,将充分吸附的大孔树脂过滤,用去蒸馏水冲洗后滤干置于装有30 mL甲醇的150 mL三角瓶中,28 ℃、180 r/min振荡12 h,取样并测定解吸液中纳他霉素含量,根据式(3)计算解吸率。
(3)
式中:
W——解吸液中纳他霉素质量浓度,mg/L;
Q——吸附总量,mg;
V——解吸液总体积,L;
η′——解吸率,%。
1.2.8 静态吸附等温曲线的测定 根据文献[16]修改如下:配置浓度为30,50,70,90,110,130,150 mg/L的纳他霉素溶液各30 mL,分别置于装有2 g大孔树脂的250 mL 三角瓶中,25 ℃、120 r/min振荡吸附2 h。取出充分吸附的大孔树脂置于装有30 mL甲醇的250 mL三角瓶中180 r/min、25 ℃解吸2 h,测定纳他霉素含量,以初始浓度(mg/L)对平衡后吸附量(mg/g干树脂)做图,可得到纳他霉素的吸附等温线。
1.2.9 大孔树脂原位发酵工艺的优化 根据以上优化得到的最佳大孔吸附树脂,固定发酵条件,选择树脂添加量和添加时间作为影响纳他霉素产量的主要因素,进行纳他霉素发酵和大孔树脂原位吸附过程耦合,根据大孔树脂中纳他霉素的质量浓度选取最佳工艺条件。
(1)树脂添加量:按照初始发酵条件,将培养好的种子液按体积分数6%的比例接入发酵培养基中,28 ℃、200 r/min振荡培养120 h,树脂添加量分别设为0.5,1.0,2.0,3.0,4.0,5.0 g/30 mL,树脂在发酵开始时加入,进行发酵,发酵结束后,取出大孔树脂,将大孔树脂解吸12 h,测定纳他霉素质量浓度。
(2)树脂添加时间:按照初始发酵条件,将培养好的种子液按体积分数6%的比例接入发酵培养基中,28 ℃、200 r/min振荡培养120 h,选用最佳树脂添加量,树脂添加时间分别设为24,36,48,60,72 h进行发酵,发酵结束后,取出大孔树脂,将大孔树脂解吸12 h,测定纳他霉素质量浓度。
1.3 数据处理
数据分析和图表绘制均采用 Origin 2017 软件处理。
2 结果与分析
2.1 树脂的静态吸附与解吸
大孔吸附树脂主要靠其大孔网状结构和较大的比表面积对溶液中的溶质进行吸附。在模拟发酵过程,对9种大孔吸附树脂进行模拟原位吸附分离,通过测定树脂吸附和解吸前后溶液中纳他霉素的浓度,计算各树脂的吸附量、吸附率和解吸率。如表2所示,9种树脂对纳他霉素均具有吸附作用,其中HPD600、HZ816和AB-8对纳他霉素的吸附量、吸附率和解吸率较低;HPD100、HPD450和XAD-16HP树脂对纳他霉素的吸附量均达到了0.71 mg/g干树脂以上,但HPD100和XAD-16HP树脂的解吸率相对较低;弱极性树脂HPD300吸附率较HPD450低,但解吸率最高达到了95.22%,说明HPD300和HPD450树脂与纳他霉素的极性相似。综合考虑树脂的吸附率、解吸率和吸附量,选用HPD300和HPD450两种树脂进行下一步研究。
表2 不同树脂对纳他霉素的吸附率、解吸率及吸附量
Table 2 Adsorption rate, desorption rate and adsorption capacity of natamycin by different resins
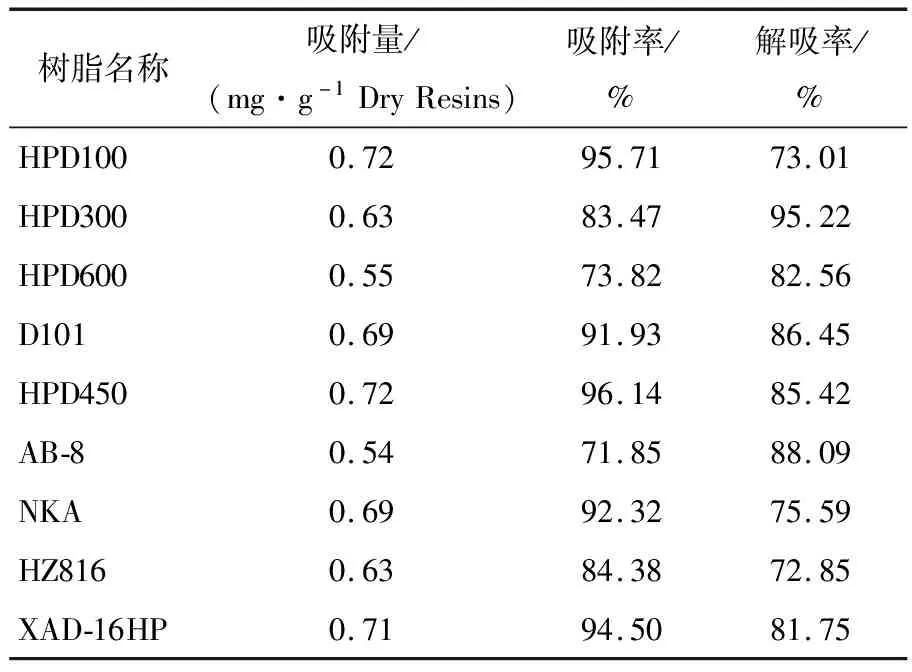
树脂名称吸附量/(mg·g-1DryResins)吸附率/%解吸率/%HPD1000.7295.7173.01HPD3000.6383.4795.22HPD6000.5573.8282.56D1010.6991.9386.45HPD4500.7296.1485.42AB-80.5471.8588.09NKA0.6992.3275.59HZ8160.6384.3872.85XAD-16HP0.7194.5081.75
2.2 树脂的静态吸附动力学曲线
以吸附率为纵坐标,吸附时间为横坐标作图,得到HPD300和HPD450两种树脂的静态吸附动力学曲线。从图1可以看出,HPD300和HPD450两种树脂在0.5~2.0 h时吸附率逐渐增大,2 h后树脂对溶液中纳他霉素的吸附率变化不大,4 h以后吸附率随时间变化基本上达到吸附平衡,HPD450型树脂吸附率较大,达到了96.14%,而HPD300树脂吸附率为85.42%,表明这两种树脂对纳他霉素的吸附是快速平衡型。
2.3 树脂的静态解吸动力学曲线
采用甲醇对上述两种达到吸附平衡的树脂进行解吸,每20 min测定解吸液中纳他霉素的浓度,连续测定160 min,以树脂的解吸率为纵坐标,解析时间为横坐标,得到HPD300和HPD450树脂的静态解吸动力学曲线。从图2中可以看出,HPD300和HPD450树脂都在起始阶段对纳他霉素的解吸率变化幅度较大,2.0 h后解析率变化幅度较小,HPD450树脂在4.5 h时达到最大87.25%,而HPD300树脂在5.0 h时达到最大95.36%,解吸液中纳他霉素的质量浓度基本不变,但是由于树脂物理性质各方面的差异,HPD300树脂解吸率比HPD450树脂高出8.11%。综合以上研究结果,HPD450树脂的吸附率和解吸附率的整体效果比HPD300更佳,为最优选择树脂,进行后续研究。
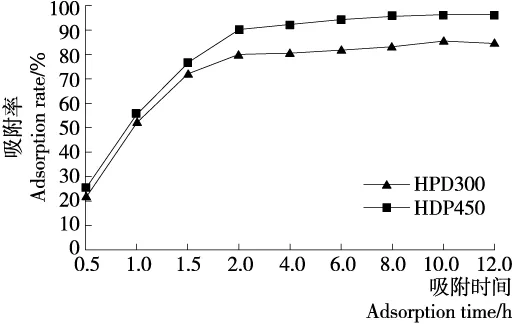
图1 静态吸附动力学曲线

图2 静态解吸动力学曲线
2.4 树脂的静态吸附等温线
以HPD450树脂为研究对象,以纳他霉素的起始质量浓度对平衡后的吸附量作图,可得到纳他霉素的质量浓度<150 mg/L时的吸附等温线。如图3所示,温度为25 ℃时,随着纳他霉素初始浓度的增加,HPD450树脂的吸附量也随之增加。吸附过程是溶质分子在吸附剂与溶剂两相界面上进行分配的过程,在一定温度下,当吸附过程达到平衡时,溶质分子在液相和固相中的浓度关系可用吸附等温方程式来表示,常用的是Langmuir模型和Freundlich模型。Langmuir模型是假设大孔树脂表面为单层吸附、被吸附物质均匀分布、物质在大孔树脂的表面没有分子相互作用;Freundlich模型为非理想状态的吸附模型,该模型为单分子层吸附和非单层吸附行为,被用于化学吸附和物理吸附的过程中[17]。HPD450树脂的静态吸附等温线的Langmuir和Freundlich拟合曲线中相关系数(R2)的值分别为0.996和0.957,两者R2差别不大,但是Freundlich曲线的吸附强度<<1,说明HPD450树脂的吸附更符合Langmuir模型,是单分子层吸附,最大吸附量为10.03 mg/g干树脂。
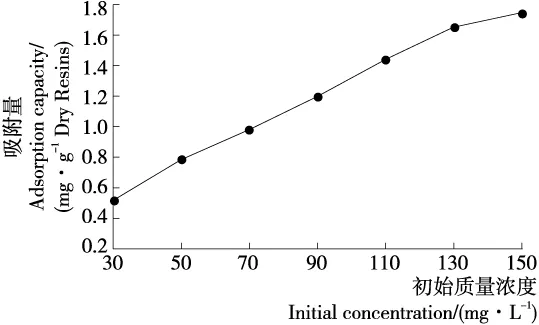
图3 HPD450树脂的吸附等温线
2.5 原位分离条件优化
2.5.1 树脂的添加量 比较了不同树脂添加量的发酵—分离耦合工艺,HPD450树脂在发酵开始时加入发酵液中,结果如图4所示。在树脂添加量为0.5~4.0 g/30 mL时,纳他霉素的产量随着树脂添加量的增加而提高,当树脂的添加量为4.0 g/30 mL时,纳他霉素的产量最高达1.15 g/L,比对照(0.83 g/L)提高了38.56%,随着树脂添加量的进一步增加到5.0 g/30 mL时,而纳他霉素的产量却没有明显变化。从结果可以看出,在发酵—吸附分离耦合过程中,HPD450树脂的添加可以有效提高纳他霉素的发酵水平,并且使菌体内的纳他霉素维持在较低水平,降低了纳他霉素的产物抑制作用,为底物的高效转化提供了良好的基础。王卫等[18]报道在赤霉素发酵过程中,最佳D100树脂的加入量为2%,过多的树脂加入后,会影响菌丝生长,导致目标产物的产量下降。
2.5.2 树脂添加时间 在HPD450树脂添加量为4 g/30 mL的条件下,考察加入时间对纳他霉素原位吸附的影响。由图5可知,在发酵后48 h添加时,纳他霉素的发酵产量最高,达到1.38 g/L,与初始添加的相比,纳他霉素的产量提高了27.78%,比不添加树脂时提高了66.27%;发酵后60,72 h添加时,纳他霉素的产量却在下降。分析原因,在发酵前期以菌体生长为主,大孔树脂的过早加入可能对纳塔尔链霉菌的生长有一定的影响,进而影响纳他霉素的产生;加入过晚,产物抑制已经形成,而且发酵液中的其他成分可能被大孔树脂吸附,使其吸附容量变小,从而减少了纳他霉素产量。徐浩等[19]报道在Nisin发酵过程中,D113树脂加入过早在一定程度上影响细胞生长;而加入过晚,产物抑制已经在一定程度上形成,从而导致Nisin产率也偏低。
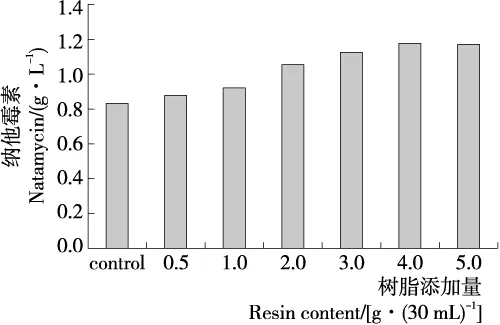
图4 发酵液中树脂添加量对纳他霉素合成的影响
Figure 4 Effect of resin addition content in fermentation broth on synthesis of natamycin
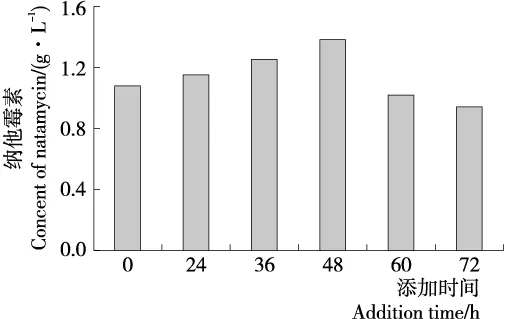
图5 添加时间对纳他霉素合成的影响
3 结论
研究结果表明,HPD450型大孔树脂为纳他霉素的最佳吸附剂,采用该大孔树脂原位吸附分离耦合纳他霉素的发酵,纳他霉素产量提高明显,优化后比不添加树脂时提高了66.27%,该结果也证实在纳他霉素的发酵过程中存在产物反馈抑制现象;利用该大孔树脂优良的富集和解吸性能,可以大量减少在纳他霉素提取过程中甲醇的使用,简化发酵液预处理流程,从而提高纳他霉素的得率。但目前纳他霉素的发酵与树脂吸附的耦合技术仅处于摇瓶试验阶段,而且StreptomycesnatalensisHW-2在发酵过程中菌丝容易缠绕形成小球,导致大孔树脂与菌丝无法有效分离,同时,HPD450型大孔树脂还存在非特异性吸附现象,从而影响纳他霉素的发酵和树脂的使用效率,进而导致该方法在纳他霉素工业化应用困难。因此,如何减少发酵过程中菌丝球的形成和开发易于从发酵体系中回收的新型大孔树脂,提高耦合发酵中大孔树脂的利用率,将是纳他霉素生物合成与树脂分离相耦合技术的进一步研究方向。

