灵芝孢子粉蜂胶复合物对小鼠免疫功能的影响
,,
(中山大学生命科学学院,广东广州 510275)
灵芝属于担子菌纲多孔菌科(Polyproraceae)灵芝属(Ganoderma)真菌,是赤芝(G.lucidumKarst)和紫芝(G.JaponicumLloyd)的总称[1],是一种重要的药食用真菌,素有“仙草”和“瑞草”的美称。灵芝孢子是子实体成熟后从菌盖子实层内喷射出来的粉末状的生殖细胞,其所含的营养物质是灵芝子实体的数十倍[2],主要活性成分有糖肽类、氨基酸类、三萜类、核苷类、脂肪酸类、呋喃类衍生物、甾醇类、生物碱类和微量元素等[3-4],具有抗肿瘤、抗氧化、抗辐射、抗衰老、调节免疫、保肝护肝、降血糖血脂等多种生理活性[5-8]。
蜂胶(propolis)是蜜蜂从植物芽孢或树干破皮伤口处采集来的树脂(树胶),并混入蜜蜂上颚腺的分泌物,与少量花粉、蜂蜡等加工而成的一种具有芳香气味的固体胶状粘性物质[9],有“紫色黄金”之称。目前已从蜂胶中分离出300多种化学成分,主要有效成分包括黄酮类、酚酸类、酯类、多糖、氨基酸、挥发性物质、萜类等[10-12],具有抗病毒、抑菌、抗肿瘤、增强免疫、抗氧化、肝保护、调节血糖血脂等多种生理活性[13-16]。
现今市场上出现了许多灵芝孢子和蜂胶的复合产品,但关于此复方生理作用的研究多为降脂[17]、抑制胃溃疡[18]等方面,而在免疫调节方面的研究极少。王丽妮[19]证明由灵芝、蜂胶、精氨酸、蛋氨酸、β-胡萝卜素、富硒酵母组成的“寿百星”胶囊具有增强非特异性免疫和特异性细胞免疫的作用,但是关于灵芝孢子和蜂胶组成的复方对非特异性免疫、细胞免疫以及体液免疫的研究尚未见文献报道。本实验以灵芝孢子粉和蜂胶组成的复合物为原料,研究其对小鼠非特异性免疫、细胞免疫以及体液免疫的作用,期待为此类复合功能产品的开发应用提供科学依据。
1 材料与方法
1.1 材料与仪器
灵芝孢子粉蜂胶复合物 由广州市众享生物科技有限公司提供,复合物由灵芝孢子粉和蜂胶按质量1∶1组成,其中灵芝孢子粉来源于广西百色地区,蜂胶来源于大别山,灵芝孢子粉采用低温破壁,天然蜂胶冻干后研磨成细粉,将两者混合搅拌均匀,所得复合物为棕褐色粉末,在蒸馏水中呈深棕色混悬液,实验时用蒸馏水配成所需浓度;SPF级昆明种雌性小鼠 共160只,4~5周龄,体重为18~22 g,由中山大学实验动物中心提供,实验动物生产许可证号为SCXK(粤)2016-0029,饲养于中山大学(生命科学大学院中药与海洋药物研究所),试验单位使用许可证编号为SYXK(粤)2014-0020;无菌脱纤维鸡血、无菌脱纤维羊血、补体、小牛血清 广州鸿泉生物科技有限公司;Drabkin’s Reagent(都氏试剂)、L-谷氨酰胺 美国sigma公司;印度墨水、SA缓冲液、四甲基偶氮唑蓝(MTT)、刀豆蛋白(ConA) 上海源叶生物科技有限公司;RPMI-1640细胞培养液 苏州赛默飞世尔仪器有限公司;hanks缓冲液、青霉素钠、硫酸链霉素、β-巯基乙醇 北京索莱宝生物科技有限公司;Gimsa染液 北京鼎国昌盛生物技术有限公司;磷酸盐缓冲液(PBS) 北京蓝景科信技术有限公司;24孔培养板、96孔培养板 美国康宁;实验过程中所用的化学试剂 均为国产分析纯。
754紫外可见分光光度计 上海公谱仪器有限公司;HERAcell 150i二氧化碳培养箱和Multiskan FC酶标仪 上海赛默飞世尔科技(中国)有限公司;HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;BA210型LED Digital Motic显微镜 麦克迪奥实业集团有限公司;LXJ-II C低速大容量离心机 上海安亭科学仪器厂;MIKRO 120小型台式高速离心机 德国Hettich。
1.2 实验方法
1.2.1 动物分组及灌胃 分组:将整个实验分成四个免疫组,每组小鼠40只,再将40只小鼠随机分成4组,即对照组、灵芝孢子粉蜂胶低、中、高剂量组。其中免疫一组进行免疫脏器质量测定和小鼠腹腔巨噬细胞吞噬鸡红细胞实验;免疫二组进行迟发型变态反应(DTH)和血清溶血素的测定;免疫三组进行小鼠单核-巨噬细胞碳粒廓清实验;免疫四组进行刀豆蛋白(Con A)诱导的脾淋巴细胞转化实验。实验方法参照国家卫生部《保健食品检验与评价技术规范》(2003年版)[20]中增强免疫力功能检测方法进行。
灌胃:参考张艳[21]实验方法中关于剂量的选取,实验设计了低、中、高剂量组,即75、150、450 mg/kg bw,分别相当于人体推荐剂量的5、10、30倍。将灵芝孢子粉蜂胶复合物粉末用蒸馏水配成所需浓度,以灌胃的方式对小鼠进行给药,灌胃剂量为0.1 mL/10 g bw,每天一次,连续30 d,对照组给予等体积的蒸馏水。
1.2.2 小鼠体重变化的测定 实验开始前称重并记录每只小鼠的重量,最后一次给药24 h后称重并记录其体重。
1.2.3 免疫脏器指数测定 小鼠最后一次给药24 h后,称重,颈椎脱臼法处死小鼠,解剖取胸腺和脾脏,用滤纸吸干表面血污后用电子天平分别称重,计算胸腺指数和脾脏指数。
1.2.4 小鼠腹腔巨噬细胞吞噬鸡红细胞实验(半体内法) 最后一次给药24 h后,腹腔注射1 mL 20%的鸡红细胞悬液,30 min后颈椎脱臼处死小鼠,将其腹部朝上固定在鼠板上,正中剪开腹壁皮肤,经腹腔注射2 mL生理盐水,用手轻轻按揉腹部30次。用吸管吸出腹腔洗液,平均分滴于两片载玻片上,放入垫有湿纱布的搪瓷盒中,放置在37 ℃孵箱中温育30 min。温育结束后在生理盐水中漂洗,除去未贴片细胞。取出晾干,以1∶1丙酮甲醇溶液固定5 min,然后以4%(体积分数)Giemsa-磷酸缓冲液染色3 min,用蒸馏水漂洗后取出晾干,在40倍显微镜下观察计数,按下式计算吞噬率和吞噬指数。


1.2.5 绵羊红细胞(SRBC)诱导小鼠迟发型变态反应(足趾增厚法) 实验结束前5 d,通过腹腔注射0.2 mL(约1×106个SRBC)2%(体积分数)的SRBC进行免疫。4 d后,测量左后足趾部厚度,然后在测量部位皮下注射20% SRBC,每只小鼠的注射剂量为20 μL(约1×102个SRBC),24 h后测量左后足趾部厚度。同一部位测量三次,两次测量厚度的平均值之差即可反映小鼠迟发型变态反应(DTH)的程度。
1.2.6 半数溶血值(HC50)的测定 实验结束前5 d,通过腹腔注射0.2 mL(约1×106个SRBC)2%的SRBC进行免疫。5 d后,摘除眼球取血置于离心管内,室温放置约1 h,用注射器针头将凝固血与管壁剥离,使血清充分析出,室温下2000 r/min离心10 min,收集血清。用SA缓冲液将血清稀释200倍,取稀释后的血清1 mL置试管内,依次加入10% SRBC 0.5 mL、补体1 mL(用SA缓冲液按1∶10稀释),另设不加血清的(以SA缓冲液代替)对照管。37 ℃恒温水浴锅中保温30 min后在冰浴上终止反应,2000 r/min离心10 min,取上清液1 mL于新试管中,加入3 mL都氏试剂;同时取0.25 mL 10% SRBC于另一只试管内,加入3.75 mL都氏试剂,充分摇匀,放置10 min后,以对照管作空白,540 nm处分别测定各管的光密度值,按下式计算半数溶血值。

1.2.7 小鼠单核-巨噬细胞碳粒廓清实验 最后一次给药24 h后,通过尾静脉注射用生理盐水稀释了4倍的印度墨汁,注射剂量为0.1 mL/10 g bw。注入墨汁后立即开始计时,于2 min(t1)、17 min(t2)时分别通过眼球内眦静脉丛取血20 μL,立即加入到2 mL 0.1% Na2CO3溶液中。以Na2CO3溶液作空白对照,用分光光度计测量600 nm处的光密度值(OD)。取血完后将小鼠脱颈椎处死,解剖取其脾脏和肝脏,用滤纸吸干表面的血污后称重。按下式计算吞噬指数a。
式中:k表示未校正的吞噬指数;a表示经校正的吞噬指数;OD1和OD2分别为2、17 min时的光密度值。
1.2.8 刀豆蛋白(Con A)诱导的脾淋巴细胞转化实验(MTT法) 最后一次给药24 h后,采用颈椎脱臼法处死小鼠,无菌取脾,置于盛有Hank’s液平皿中的200目无菌不锈钢网上,用注射器针芯轻轻研磨脾脏,制成单细胞悬液。用Hank’s液洗涤3次,每次1000 r/min离心10 min。然后将细胞悬浮于1 mL RPMI-1640完全培养液中,显微镜下进行细胞计数,并调整细胞浓度为2×106个/mL。将细胞悬液分两孔加入到24孔培养板中,每孔1 mL,其中一孔加入75 μL Con A液(终浓度为7.5 μg/mL),另一孔不加Con A液作为对照,置于二氧化碳培养箱中以5% CO237 ℃条件培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入不含小牛血清的RPMI-1640培养液0.7 mL,同时加入50 μL MTT(5 mg/mL),继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,吹打混匀,使紫色结晶完全溶解,然后分装到96孔培养板中,每孔作3个平行,用酶标仪测量570 nm波长下的光密度值。脾淋巴细胞的增殖能力可表示为加Con A液孔的光密度值减去不加Con A液孔的光密度值。
1.3 数据处理
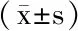
2 结果与分析
2.1 灵芝孢子粉蜂胶复合物对小鼠体重变化的影响
从表1可以看出,四个免疫组低、中、高剂量的灵芝孢子粉蜂胶复合物对小鼠体重的变化与对照组相比无显著统计学差异(p>0.05),说明该复合物对小鼠体重的变化无明显影响。但是同一剂量不同免疫组之间的体重变化存在一定差异,对照组小鼠中免疫一组的体重变化与其它三个免疫组相比具有显著统计学差异(p<0.05);给予低剂量受试物中免疫一组小鼠体重变化与其它三个免疫组相比有显著差异(p<0.05);给予中剂量受试物中免疫一组小鼠体重变化与免疫二组之间差异显著(p<0.05);给予高剂量受试物中免疫一组体重变化与免疫四组之间差异显著(p<0.05),说明小鼠的体重变化可能受外界条件及遗传特性等因素的影响。
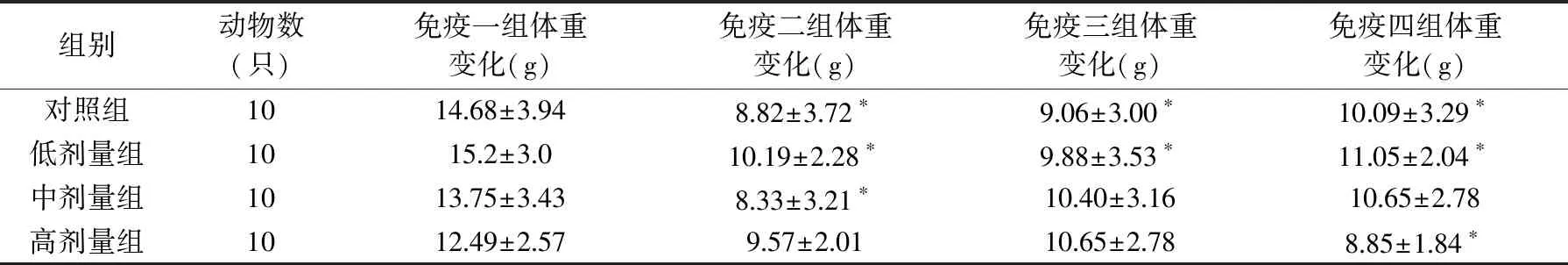
表1 灵芝孢子粉蜂胶复合物对小鼠体重的影响Table 1 Effect of Ganoderma lucidum spores and propolis complex on body weight of mice
2.2 灵芝孢子粉蜂胶复合物对小鼠免疫脏器指数的影响
脾脏和胸腺是免疫系统中重要的免疫器官,其质量在一定程度上可反映免疫功能的大小,从表2可知,低、中、高剂量灵芝孢子粉蜂胶处理组的小鼠脾脏指数和胸腺指数与对照组相比虽然都有所提高,但均无显著统计学差异(p>0.05),表明灵芝孢子粉蜂胶复合物对小鼠脾脏和胸腺的质量无明显影响,对免疫器官无刺激作用。
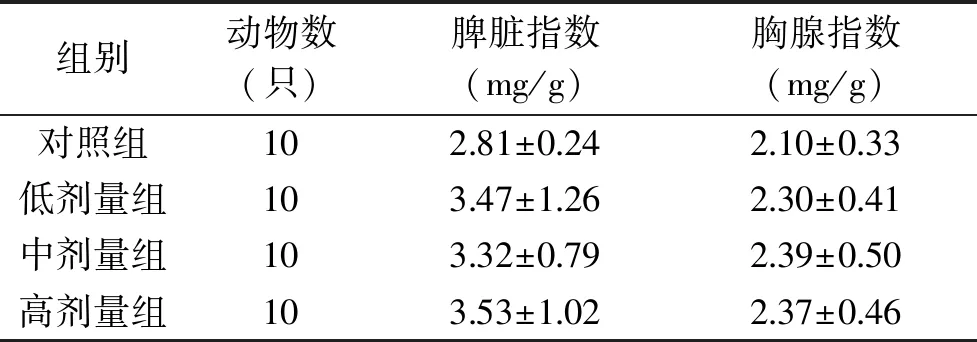
表2 灵芝孢子粉蜂胶复合物对小鼠免疫脏器指数的影响Table 2 Effect of Ganoderma lucidum spores propolis complex on immune organ index of mice
2.3 灵芝孢子粉蜂胶复合物对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
从表3中可以看出,中、高剂量灵芝孢子粉蜂胶复合物处理组的小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率和吞噬指数显著(p<0.05)高于对照组,而低剂量组小鼠腹腔巨噬细胞的吞噬率和吞噬指数与对照组相比无显著(p>0.05)差异。以上结果表明灵芝孢子粉蜂胶复合物能够显著增强小鼠腹腔巨噬细胞的吞噬能力。
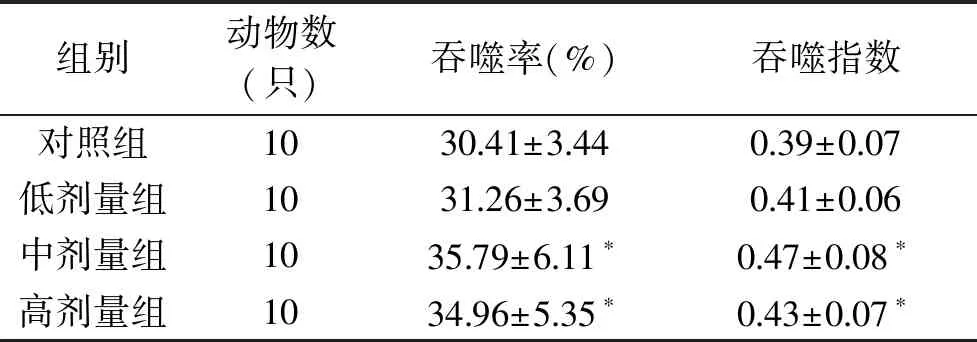
表3 灵芝孢子粉蜂胶复合物对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响Table 3 Effect of Ganoderma lucidum spores and propolis complex on peritoneal macrophage phagocytosis ability to chicken-red-blood cells of mice
2.4 灵芝孢子粉蜂胶复合物对小鼠迟发型变态反应(DTH)的影响
从表4可以看出,与对照组相比,中、高剂量处理组小鼠的足趾肿胀度极显著升高(p<0.01),而低剂量处理组小鼠的足趾肿胀度与对照组相比无显著差异(p>0.05),结果说明灵芝孢子粉蜂胶复合物具有促进小鼠迟发型变态反应的作用。

表4 灵芝孢子粉蜂胶复合物对小鼠迟发型变态反应的影响Table 4 Effect of Ganoderma lucidum spores and propolis complex on delayed-type hypersensitivity of mice
2.5 灵芝孢子粉蜂胶复合物对小鼠血清溶血素水平的影响
由表5可知,三个剂量组小鼠血清半数溶血值随灵芝孢子粉蜂胶复合物灌胃剂量的增加而升高,低剂量组与对照组相比具有显著统计学差异(p<0.05),中、高剂量组与对照组相比其统计学差异极显著(p<0.01)。以上结果表明,灵芝孢子粉蜂胶复合物能显著提高小鼠血清溶血素水平。

表5 灵芝孢子粉蜂胶复合物对小鼠血清溶血素水平的影响Table 5 Effect of Ganoderma lucidum spores and propolis complex on serum hemolysin capacity of mice
2.6 灵芝孢子粉蜂胶复合物对小鼠单核—巨噬细胞碳粒廓清能力的影响
由表6可知,三个剂量灵芝孢子粉蜂胶复合物处理组小鼠单核—巨噬细胞的碳廓清吞噬指数与对照组相比均无显著差异(p>0.05),说明该复合物对单核-巨噬细胞的碳粒廓清能力无明显的增强作用。胡怡秀等[22]通过实验证明1.101 g/kg bw的蜂胶能明显增强小鼠的碳粒廓清能力(p<0.05),张荣标等[23]通过灌胃给予ICR清洁小鼠125、250、750 mg/kg bw的破壁灵芝孢子粉30 d后进行免疫指标检测,结果显示250 mg/kg bw的灵芝孢子粉能够显著增强小鼠的碳粒廓清能力(p<0.05)。两位的研究结果与本实验结果不同,可能由于剂量效应导致,高剂量复合物中灵芝孢子粉和蜂胶的剂量均为225 mg/kg bw,未达到胡怡秀以及张荣标实验中引起碳廓清指数增强的剂量水平。

表6 灵芝孢子粉蜂胶复合物对小鼠碳粒廓清能力的影响Table 6 Effect of Ganoderma lucidum spores and propolis complex on carbon clearance ability of mice
2.7 灵芝孢子粉蜂胶复合物对小鼠脾淋巴细胞增殖能力的影响
从表7可得知,三个剂量组的脾淋巴细胞增能力均高于对照组,且随着剂量的加大其脾淋巴细胞的增殖能力也逐渐增加,但只有灵芝孢子粉蜂胶复合物中、高剂量处理组小鼠脾淋巴细胞增殖能力极显著高于(p<0.01)对照组,而低剂量组小鼠脾淋巴细胞增殖能力与对照组相比无显著差异(p>0.05)。结果说明灵芝孢子粉蜂胶复合物对脾淋巴细胞的增殖能力具有一定的促进作用。

表7 灵芝孢子粉蜂胶复合物对小鼠脾淋巴细胞增殖能力的影响Table 7 Effect of Ganoderma lucidum spores and propolis complex on spleen lymphocyte proliferation ability of mice
3 讨论与结论
本实验结果显示,与对照组相比,中、高剂量灵芝孢子粉复合物能够提高小鼠腹腔巨噬细胞吞噬鸡红细胞的能力,说明该复合物对单核-巨噬细胞的功能具有促进作用;中、高剂量灵芝孢子粉复合物能显著增强小鼠迟发型变态反应程度以及小鼠脾淋巴细胞增殖能力,说明该复合物对细胞免疫功能具有促进作用;低、中、高剂量灵芝孢子粉复合物能显著提高血清溶血素水平,说明该复合物对体液免疫功能具有促进作用;根据国家卫生部《保健食品检验与评价技术规范》(2003年版)中关于增强免疫力功能的结果判定标准,可认为灵芝孢子粉蜂胶复合物具有增强免疫力功能的作用。
本研究从非特异性免疫、体液免疫、细胞免疫三个方面证明了灵芝孢子粉蜂胶复合物能够促进机体的免疫功能,为此类复合产品作为保健产品的推广使用提供了可靠的理论支撑。但未深入探究灵芝孢子粉蜂胶复合物增强免疫功能的分子作用机制以及灵芝孢子粉和蜂胶间的作用效果是属于协同还是拮抗,有必要在今后对其相互作用效果及作用机制作进一步探讨,从而为此类复合物的应用研究提供更全面的参考信息。

