枯草芽孢杆菌固态发酵产脂肽培养基优化及脂肽的初步鉴定
, , ,
(中国海洋大学食品科学与工程学院,山东青岛 266003)
抗菌脂肽是由革兰氏阳性芽孢杆菌通过非核糖体合成途径产生的具有抗菌作用的脂肽类化合物,也叫脂肽类抗生素[1-2],主要分为表面活性素(surfactin)、伊枯草菌素(iturin)、芬荠素(fengcin)三大类[3]。其分子由一个碳脂肪酸链和一个含有7~10个氨基酸的肽链两部分组成,因此兼有亲水和亲油特性。氨基酸与烃链上的羟基或氨基以内酯或酰胺键结合形成环型脂肽[4]。抗菌脂肽具有抗菌和生物表面活性剂特性,在农业、医药、化妆品、食品、石油开采和环境治理等领域有重要的开发和应用前景[5],已引起广泛的关注。
不同枯草芽孢杆菌菌株产生脂肽类抗菌物的情况有很大的差异,即使同一菌株,改变外界(培养)条件也可以产生不同的环脂肽变异体[6-9]。因此研究特定菌株产生的脂肽抗菌物的性质为脂肽的分离纯化和利用奠定了基础。
目前脂肽的发酵方式研究以液态发酵为主,但液态发酵也存在诸多问题,例如对设备的高要求、高成本等,固态发酵具有发酵设备简单,单位基质浓度高,也可以避免液态发酵过程中脂肽的表面活性特点而出现起泡、跑料严重等问题[10]。本研究中利用的发酵氮源豆粕为大豆加工副产品[11],用低廉的原料来提高脂肽的生产效益,稻草和啤酒糟[12]等已被用作生产抗菌脂肽的发酵基质,Kim等[13]研究表明Bacillus polyfermenticus KJS-2(BP-KJS-2)菌株用大豆作为固态基质也可以固态发酵生产surfactin,也说明了以低廉原料产抗菌脂肽的固态发酵方式的巨大潜力,但是,目前对固态发酵的发酵过程中的显著工艺参数和因素水平缺乏系统性的描述,影响抗菌脂肽的生产效率。
本研究对固态发酵产生的抗菌脂肽组分进行分析基础上,利用Plackett-Burman对固态发酵过程的显著因子进行筛选,采用Box-Behenken得到显著因子的最佳水平和交互作用,确定了较优的培养基组分,为抗菌脂肽的大规模生产提供实验基础。
1 材料与方法
1.1 材料及主要设备
豆粕 购于青岛渤海实业有限公司;枯草芽孢杆菌N-2(BacillussubtilisN-2) 保存于中国海洋大学应用微生物实验室;指示菌:蜡状芽孢杆菌(Bacilluscereus) 保存于中国海洋大学应用微生物实验室;Surfactin(表面活性素)、Iturin(伊枯草菌素)标准品 购于美国Sigma公司;种子液培养基采用牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH7.0;固态发酵培养基:豆粕50 g,K2HPO41.28 g、葡萄糖0.85 g,KCl 0.17 g,MgSO40.21 g,谷氨酸钠0.85 g,FeSO40.13 g,MnSO40.26 g,CuSO40.13 g,蒸馏水35 mL,pH7.0 以上试剂均为分析纯,国药集团化学试剂有限公司。
HZQ-C型空气浴振荡培养箱 哈尔滨东明医疗仪器厂;LDZX-40BI型自动电压力蒸汽灭菌锅 上海申安医疗器械厂;DPR-9052型电热恒温培养箱 上海森信实验仪器有限公司;FD-1A冷冻干燥机 北京博医康实验仪器有限公司;Agilent 1260高效液相色谱系统 美国Agilent科技公司
1.2 实验方法
1.2.1 菌株培养及脂肽的制备 将保存在斜面上的枯草芽孢杆菌N-2接种于牛肉膏蛋白胨培养基中,37 ℃,150 r/min培养18 h,按照接种量10%接种于豆粕发酵培养基,于37 ℃培养48 h,将发酵的底物与蒸馏水1∶10 (w/v)通过在室温下搅拌1 h混合,以360×g离心10 min以除去不溶物质。向上清液中加入6 mol/L HCl至最终pH为2.0,并在4 ℃保存12 h以沉淀粗脂肽,通过在4 ℃以360×g离心20 min取沉淀并按照1∶5 (w/v)加入甲醇萃取5 h,使用旋转真空蒸发器干燥提取物。将残余物溶于蒸馏水中,低温冷冻干燥冻干成粉末状,将冻干得到的脂肽抑菌物用无菌水复溶,并用0.22 μm微孔滤膜过滤制得脂肽抑菌物待测液。
1.2.2 脂肽组分鉴定 对脂肽抑菌待测液采用质谱法(HPLC-MS)检测产物中抗菌脂肽的含量。HPLC条件:色谱柱为Zorbax SB-Aq C18分析柱(4.6×150 mm,5 μm,美国Agilent科技公司);流动相:乙腈(A)、水(含0.1%甲酸)(B);洗脱速率:0.4 mL/min;柱温25 ℃,检测波长210 nm;洗脱过程:0~9 min,45% A~55% A;9~20 min,55% A。质谱条件:在ESI正离子模式下,采用选择性离子扫描SIR模式,喷雾电压4.5 kV;鞘气压力40 arb;辅助气压力15 au;毛细管温度320 ℃,碰撞压0.2 Pa。
1.2.3 甲醇对脂肽聚集体的影响 在1%抗菌脂肽待测液中加入甲醇至终浓度为50%,然后用截留分子量为10 kDa的超滤管超滤,同时以不加甲醇的0.5%脂肽溶液在相同条件下进行超滤作为对照,以牛津杯法实验验证滤过液(B、D组)和截留液(A、C组)的拮抗活性。
1.2.4 培养基组分优化 以脂肽抑菌率作为响应指标,采用Design Expert 8.0.6软件,进行2步法优化。
1.2.4.1 培养基关键因子的筛选 选取发酵培养基的8个因子进行筛选,本试验所选取的8个考察因素及其代号、编码水平见表1,其响应值为抗菌脂肽抑菌率。
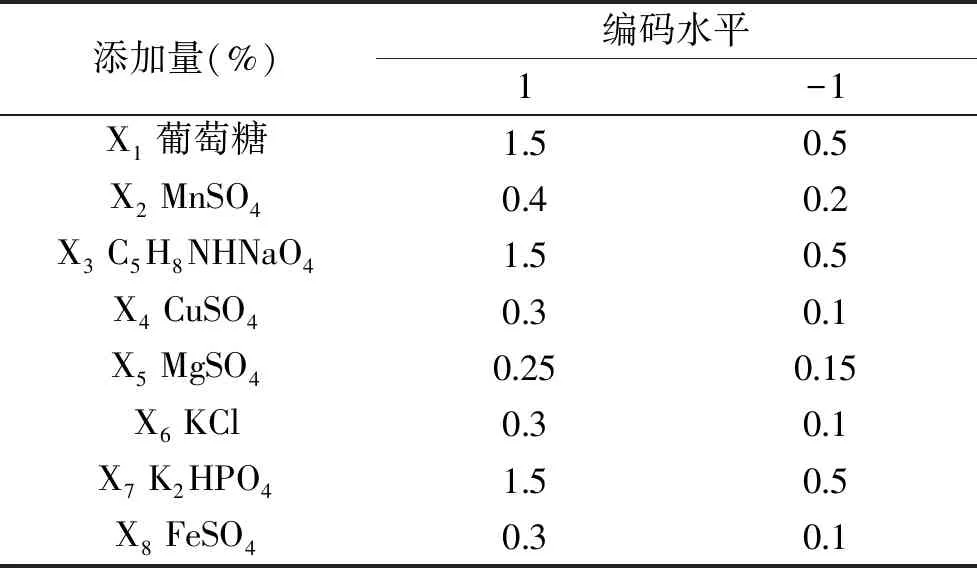
表1 Plackett-Burman试验因素水平及编码表Table 1 Factors level and codes table of PB design
1.2.4.2 响应曲面法(RSM)实验设计 根据Plackett-Burman的实验因素筛选结果,考虑因素的显著效应大小及在实验过程中的实际情况,选择下一步试验的中心点和高低水平,仍以抗菌脂肽抑菌率作为响应值,采用Box-Behnken(BBD)对这些因子进行响应曲面优化(见表2),其它培养基条件控制为豆粕50 g,葡萄糖0.85 g,KCl 0.17 g,谷氨酸钠0.85 g,MnSO40.26 g,CuSO40.13 g得出能使抑菌率达到最大值的培养基配方。并根据结果进行验证,分析响应面结果的可靠性。
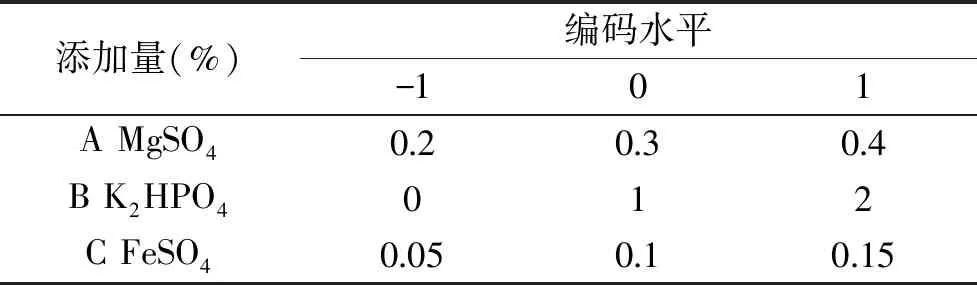
表2 Box-Behnken设计试验因素水平及编码表Table 2 Factors levels and codes table of Box-Behnken design
1.2.5 抑菌活性的测定
1.2.5.1 抑菌圈实验 采用牛津杯法。将牛肉膏蛋白胨培养基液体培养12 h的蜡状芽孢杆菌用牛肉膏蛋白胨培养基稀释至107cfu/mL,吸取0.1 mL涂牛肉膏蛋白胨平板,在其上放置高温灭菌后的牛津杯,再加入200 μL脂肽抑菌物于牛津杯,并设置无菌水对照组,37 ℃培养箱培养24 h,记录抑菌圈直径大小,平行实验3次。
1.2.5.2 抑菌率的测定 挑取保存在斜面的蜡状芽孢杆菌到种子液,37 ℃培养12 h,将种子液分别用牛肉膏蛋白胨培养基稀释至107cfu/mL,取菌液200 μL,加入到无菌的96孔板上,另外加入10 μL抗菌脂肽待测物,OD620下测定吸光度值(初始菌体密度),后放入37 ℃培养箱静置培养12 h,后在OD620下测定吸收值(培养后的菌体密度);同时设置空白组(200 μL指示菌液+10 μL甲醇),其计算公式为[14]:
抑菌率I(%)=(1-AE/AC)×100
其中:I:抗菌脂肽抑菌率(%);AE:样品组三次平行吸光值差的平均值;AC:空白组三次平行吸光值差的平均值。
1.3 数据处理
实验中每个处理重复三次,Plackett-Burman试验及响应曲面试验均利用Design Expert 8.0.6软件进行设计和分析。
2 结果与分析
2.1 脂肽组分鉴定
该抗菌脂肽的阳离子流图如图1所示。由图1可知,在此固态发酵工艺条件下所产的抗菌脂肽产物主要包含6种物质,其[M+H]+离子峰值分别m/z 1043.6、1057.5、1070.2、1084.0,其中[M+2H]2+离子峰值为m/z 717.4、734.7。对比相关抗菌脂肽的报道[15-16]及预实验中标品离子峰中Iturin的洗脱时间为3~6.5 min,Fongcin洗脱时间为7~10 min,得出此发酵产物中的抗菌脂肽主要为Iturin(伊枯草菌素)(m/z 1043.6、1057.5、1070.2以及1084.0);另外根据已有的报道[17],可确定还有少量的Fengcin(丰原素)(m/z 717.4、734.7)。
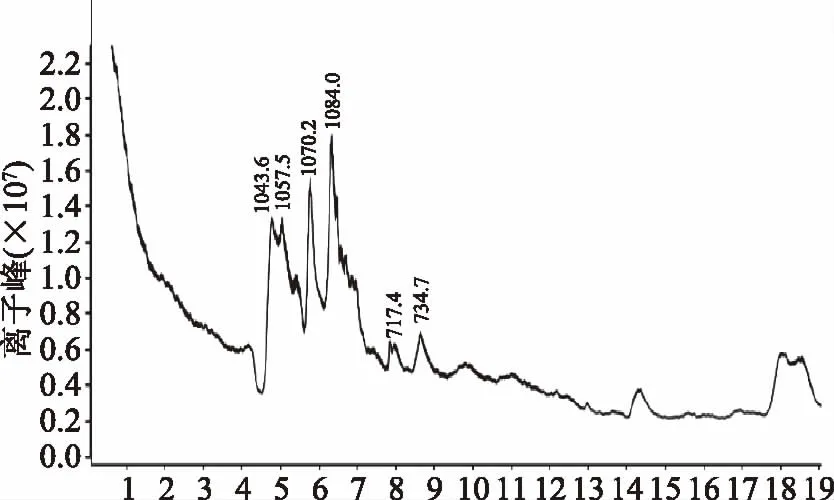
图1 产脂肽样品阳离子流图Fig.1 Positive ion current chromatogram of HPLC-MS for antimicrobial lipopeptide extract
2.2 甲醇对脂肽聚集体的影响
脂肽链通常由疏水的脂肪酸链和亲水的肽环组成,具有两亲特性,具有临界胶束浓度(CMC),当其在CMC以上时其单体聚集成分子质量比单体大2~3个数量级的胶束[18-22]。通过图2A~图2E图可以得出结论,不加甲醇组中滤过液(B)未产生抑菌圈,说明脂肽并不能通过截留量为10 kDa的超滤管,其聚集体分子量在10 kDa以上,但是在向脂肽溶液中加入甲醇后,滤过液(D)有活性,说明经过甲醇处理后脂肽能够通过10 kDa的超滤离心管,结果证明脂肽能够在溶液中形成聚集体胶束,而甲醇可以对聚集体进行打散,使胶束恢复成单体。
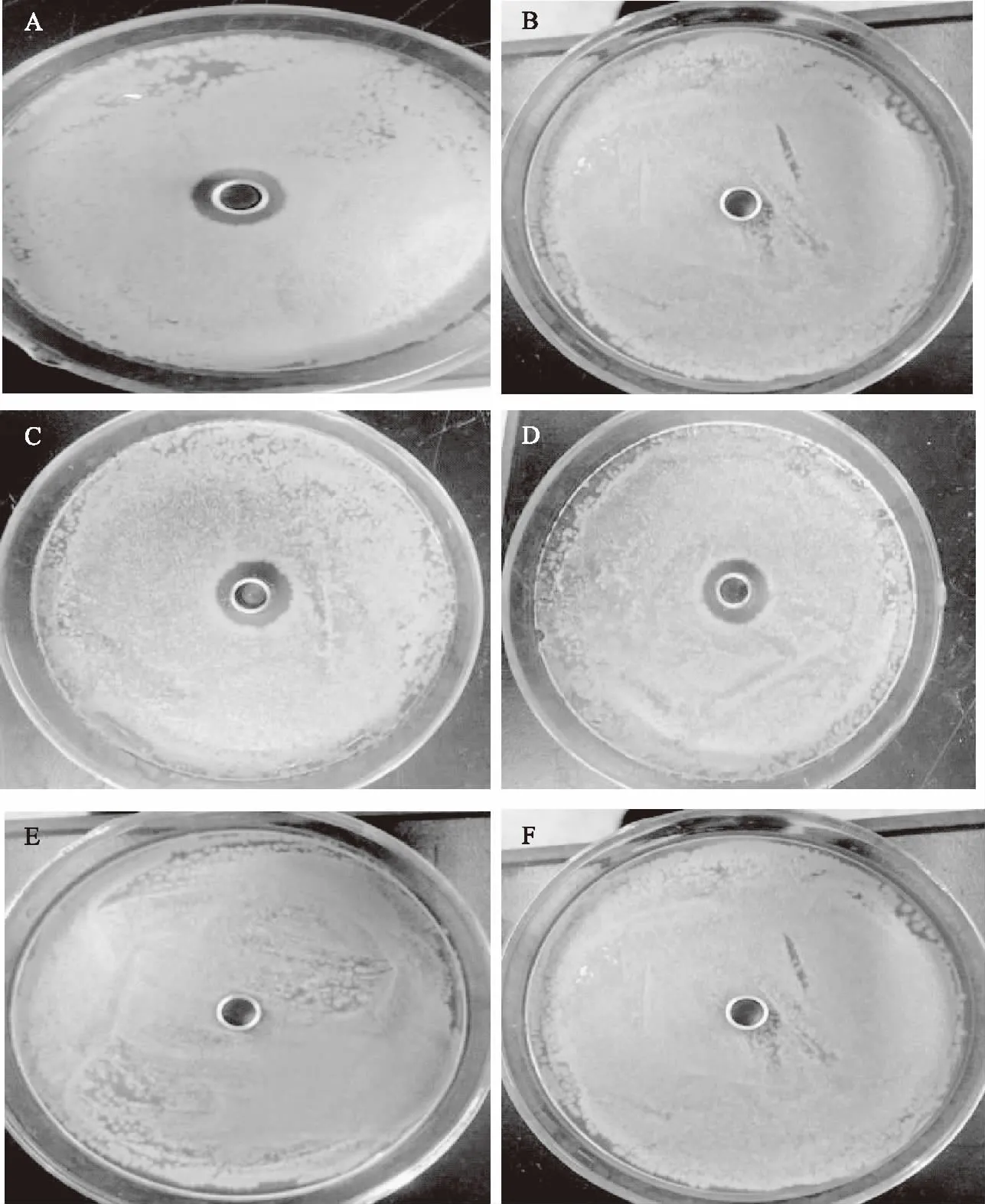
图2 甲醇处理前后截留液和滤过液抑菌活性对比Fig.2 Comparison of antibacterial activity of retentate and filtrate before and after methanol treatment注:A、B组为不加甲醇组,A为截留液,B为滤过液;C、D组为加入甲醇组,C为截留液,D为滤过液;E组为50%甲醇;F组为无菌水对照组。
2.3 培养基优化
2.3.1 培养基关键因子的筛选 采用二水平PB试验设计对培养基组份进行优化。本实验选择N=12的8因素(11个虚拟项因素)2水平的PB试验设计,结果见表3。
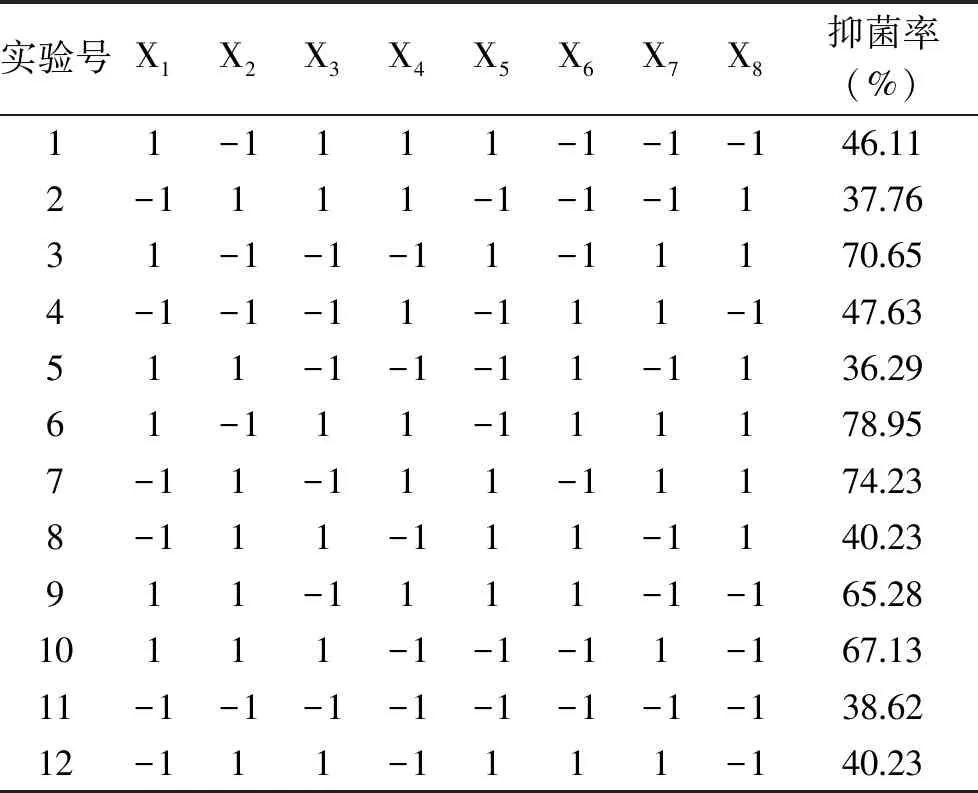
表3 PB试验设计及响应值Table 3 PB design and the antimicrobial rate
由表4可以得出结论,对实验结果进行方差分析,各个模型的显著水平是由p>|t|决定的,实验选取的8个因素有4个到达显著水平(p<0.05),因此选择MgSO4、FeSO4、K2HPO4、葡萄糖作为影响发酵过程产脂肽的关键因子。但从本实验的水平范围内看,MgSO4、K2HPO4、葡萄糖对脂肽的产生成正效应,FeSO4对脂肽的产生呈负效应,后续实验应考虑降低其水平点。有研究显示[23-24],Mg2+、K+、Mn2+和Fe2+等离子对抗菌脂肽的产量有影响,目前已观察到在B.subtilis中存在铁离子和锰离子的主动运输系统,二者在生物合成过程中参与了酶的合成。Wei等[25]研究了通过添加铁盐和锰盐提高B.subtilisATCC 21332产抗菌脂肽的量,硫酸亚铁(1.7 mmol/L)和硫酸锰的添加(0.01 mmol/L)使抗菌脂肽产量由0.33 g/L提高到2.6 g/L。此外,Kinsinger等[26]研究表明B.subtilis内用于激活抗菌脂肽合成的PCP区域的Sfp蛋白活性位点需要Mg2+作为辅助因子,因此Mg2+在抗菌脂肽合成中至关重要,另有研究表明K+可促进抗菌脂肽的分泌[27]。发酵过程中葡萄糖添加量过大会使发酵物过于粘稠,影响发酵物中抗菌脂肽的提取,因此后续优化中葡萄糖添加量不作为重要因子考虑。
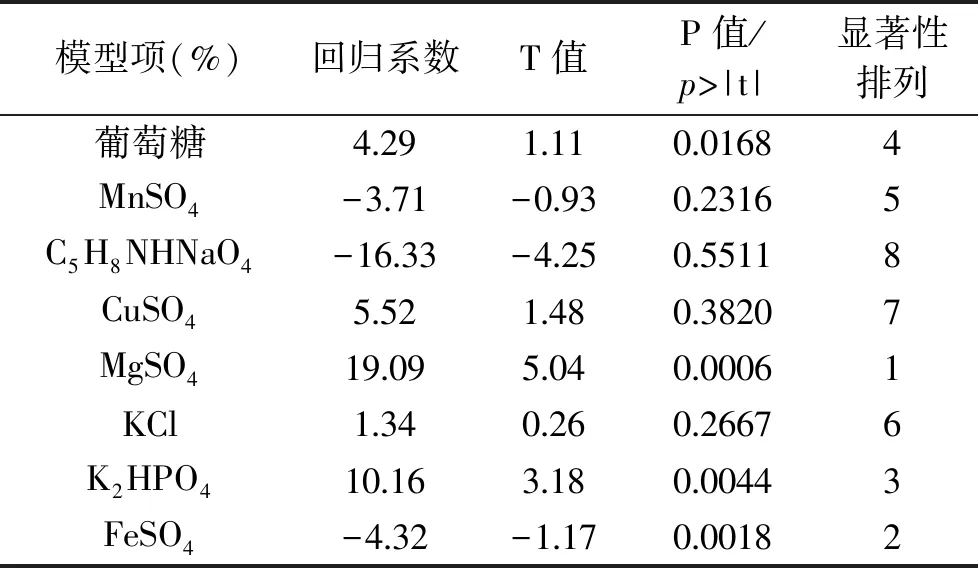
表4 抗菌脂肽回归方程系数显著性检验Table 4 Regression coefficients and their significance for antimicrobial lipopepitide
2.3.2 响应曲面法(RSM)实验设计优化发酵培养基
2.3.2.1 响应面预测模型的建立及回归分析检验 在PB试验的基础上利用Box-Behnken研究因子之间、因子与响应值之间的关系,本研究对显著的3个因子进行优化,试验响应值与预测值见表5。利用Design Expert软件对响应值与水平进行多元拟合,回归方程:
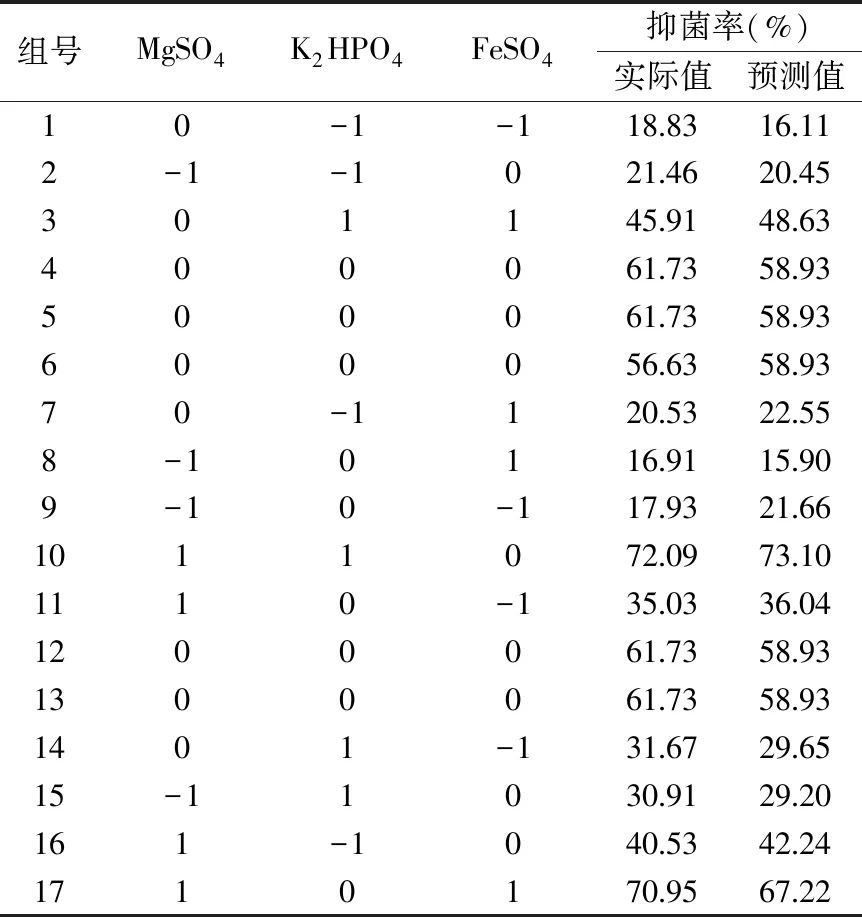
表5 Box-Behnken方案及抑菌率的实际值和预测值Table 5 BBD along with the actual and predicted values of antimicrobial rate
Y=60.73+16.42A+9.9B+6.36C+5.53AB+9.24AC+3.13BC-6.76A2-12.73B2-18.77C2
式中:Y为抑菌率的预测值,A、B、C分别代表MgSO4、K2HPO4、FeSO4的编码值。
根据变异系数对二次方程的显著性进行分析,结果见表6。
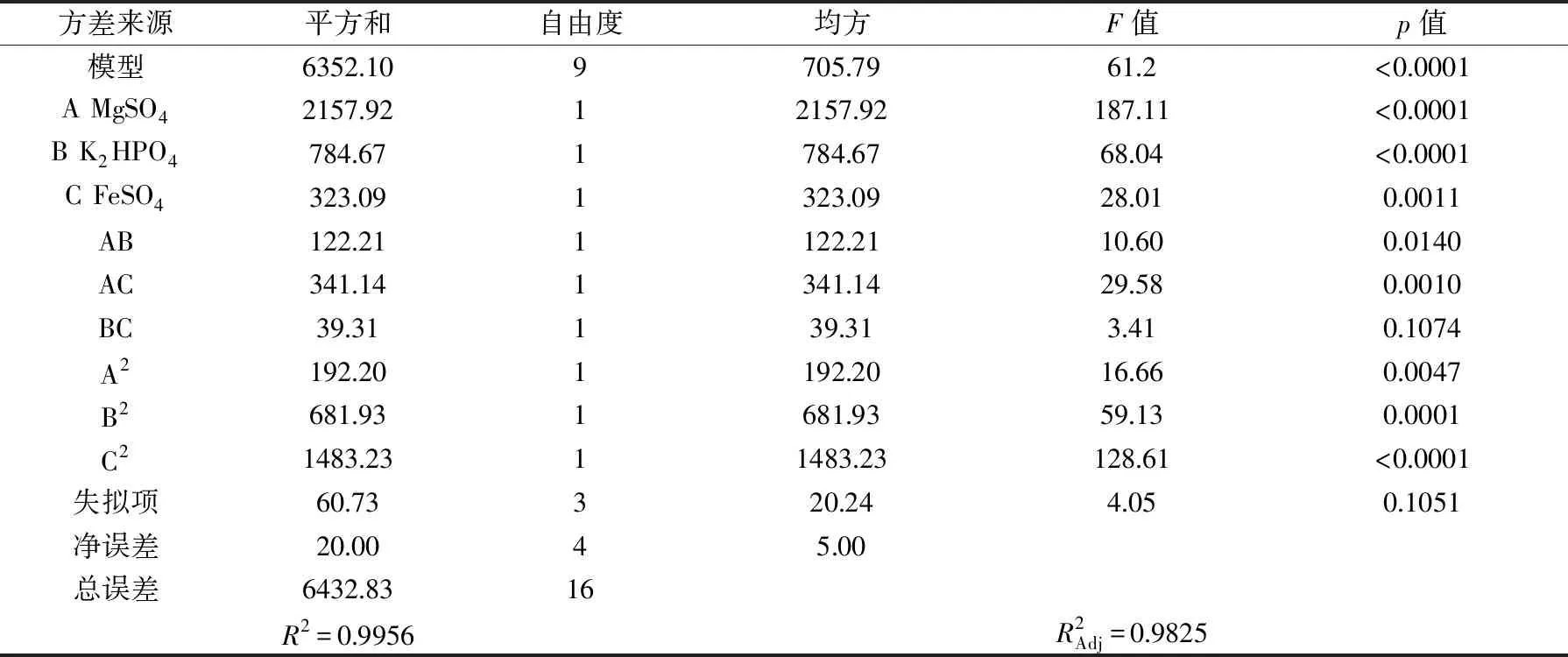
表6 抑菌率回归方程方差分析及其显著性检验Table 6 ANOVA for the regression equation and their significance of antimicrobial rate
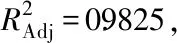
2.3.2.2 抑菌率响应面结果分析与验证 通过脂肽抑菌率回归方程所作的响应曲面图及等高线图可见图3~图5,对影响脂肽抑菌率的显著因子之间两两交互效应进行评价并确定每个因子的最佳水平范围。
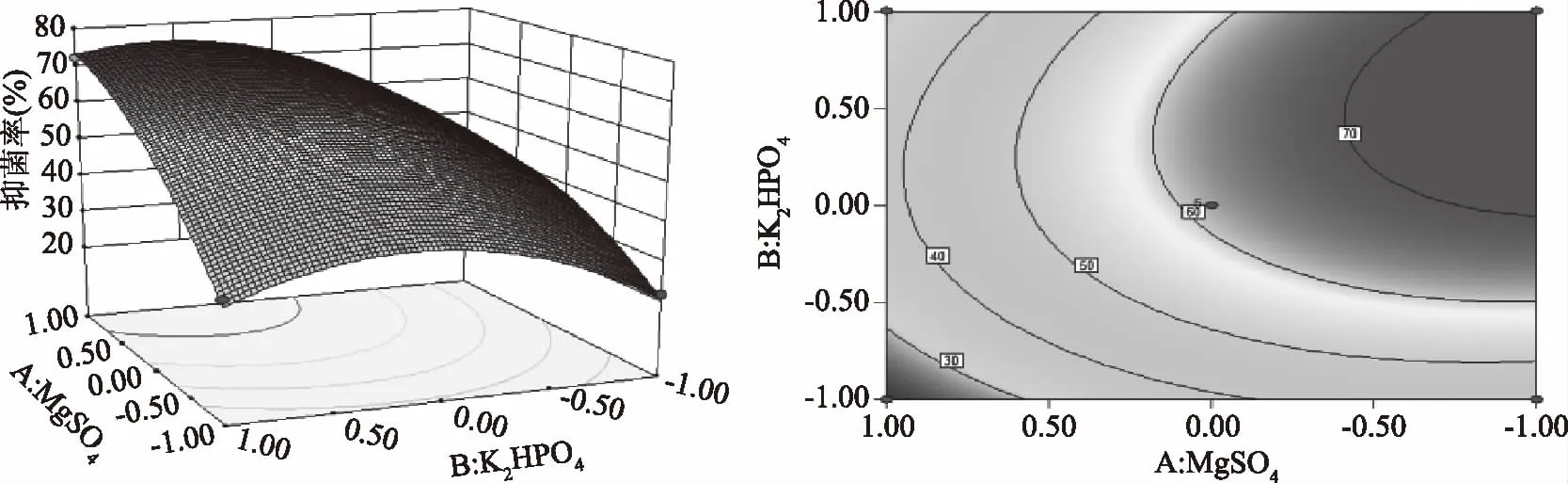
图3 MgSO4和K2HPO4交互影响抗菌脂肽抑菌率的曲面图和等高线图Fig.3 Response surface plot and its contour plot of the antimicrobial rate antibiotics versus MgSO4 and K2HPO4 concentrations
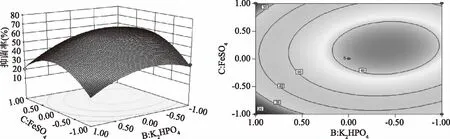
图5 MgSO4和FeSO4交互影响抗菌脂肽抑菌率的曲面图和等高线图Fig.5 Response surface plot and its contour plot of the antimicrobial rate antibiotics versus MgSO4 and FeSO4 concentrations
图3显示了 FeSO4处于最佳值0.13%时,MgSO4和K2HPO4对脂肽抑菌率的交互影响效应。由图3可以直观地看出此两因素的交互作用对抑菌率影响显著(p<0.01),坡面及等高线的形状可以反映出交互效应的强弱大小,坡面陡峭,椭圆形表示两因素交互作用显著;而坡面平缓,圆形则与之相反;图4显示了K2HPO4处于最佳值1.7%时,MgSO4和FeSO4对抑菌率的交互影响显著(p<0.05)。当MgSO4的浓度为0.39%时,在0.05%~0.13%范围内,抑菌率随着FeSO4浓度增加而增加,但超过此范围,抑菌率呈现负增加;图5显示了MgSO4处于最佳值0.39%时,响应面三维图有凸起的高点,FeSO4和K2HPO4对脂肽的交互影响较为显著。
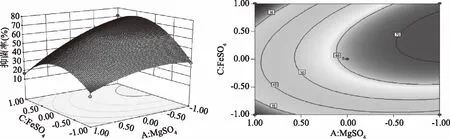
图4 MgSO4和FeSO4交互影响抗菌脂肽抑菌率的曲面图和等高线图Fig.4 Response surface plot and its contour plot of the antimicrobial rate antibiotics versus MgSO4 and FeSO4 concentrations
各因素的响应面及等高线(图3~图5)结合二次回归方程显示,曲面的极值点即抗菌脂肽抑菌率的最大预测值为77.75%,其对应的条件则为:MgSO40.39%、K2HPO41.70%、FeSO40.13%。
在得到最优条件的基础上,选取3组相近的发酵条件进行验证试验,结果见表7,从表中的数据结果可以得出,在最优条件下,抗菌脂肽的抑菌率能够达到的实际值为75.62%±0.36%,较优化前条件下抑菌率的53.24%±0.23%,提升了近二分之一。
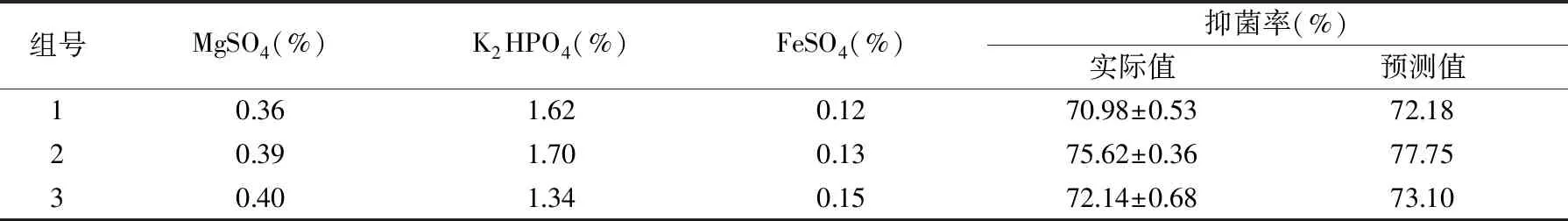
表7 抗菌脂肽抑菌率模型验证试验Table 7 Antimicrobial rates of lipopeptidemodel validation experiments
3 结论
本研究采用成本低廉的固态发酵法产生脂肽类抗生素,其组分包括伊枯草菌素(m/z 1043.60、1057.50;1070.20、1084.00),丰原素(m/z 717.40、734.70),并确定了甲醇等有机溶剂能够对脂肽胶束聚集体产生影响并将其打散形成单体,为后续脂肽的分离纯化等应用提供参考;通过Plackett-Burman和Box-Behnken试验筛选出影响发酵过程的三个显著因子MgSO4、K2HPO4、FeSO4,并在MgSO40.39%、K2HPO41.70%、FeSO40.13%的条件下,抗菌脂肽的抑菌率能够达到75.62%±0.36%,较优化前条件下抑菌率的53.24%±0.23%,提升了近二分之一,也说明了响应面法优化枯草芽孢杆菌发酵条件方便快捷,是行之有效的一种方法,试验结果也为后续的工业化生产提供可靠的理论参数。

