云芝与槐耳抗氧化活性评价及低极性组分GC-MS成分分析
,,,
(西南科技大学生命科学与工程学院,四川绵阳 621010)
多孔菌科隶属高等担子菌非褶菌目,是有重要经济价值的真菌类群[1]。该科真菌代谢产物结构多样,有多糖[2]、萜类[3]、甾体[4]、生物碱、脂肪酸和苯醌类等多种结构类型。这些代谢产物多具有抗肿瘤、抗炎和抗病毒等[5-6]生物活性。因此,该科中可用于医药保健的药食类真菌一直都受到广泛关注,如灵芝(Ganodermalucidum),茯苓(Wolfiporiacocos)和猪苓(Polyporusumbellatus)等。
近年来,该科栓菌属的云芝(Coriolusversicolor)和槐耳(Trametesrobiniophila)在医药保健品开发中逐渐进入公众视野,现已证实这两种真菌在抗肿瘤和调节免疫等方面均具有一定功效。Wei等[7]曾报道槐耳对人肾脏786-O肿瘤细胞的存活率,侵袭和迁移有明显的抑制;Wang等[8]发现槐耳可通过促进自噬溶酶体途径达到治疗炎症的目的;而Saleh等[9]报道云芝对多种免疫细胞具有促进作用。现市场上已有根据以上功效开发的医药保健产品,如槐耳颗粒[10]和云芝肝泰颗粒,前者能有效抑制肿瘤细胞的生长与繁殖;后者是一种免疫调节剂,可治疗慢性肝炎。
除抗肿瘤和免疫功效外,抗菌和抗氧化活性近期也成为研究热点,特别是天然来源产品,日益成为食品工业的重要添加剂和医药工业原料[11-12]。但目前云芝和槐耳的活性研究却较少涉及此方面,成分研究也集中于多糖及糖肽等大分子极性化合物[13]。根据文献报道,栓菌属多种真菌多具有较好的抗菌、抗氧化活性[14]。因此,本文探究云芝、槐耳两种真菌的抗菌及其抗氧化活性,并用GC-MS(Gas chromatography-mass spectrometry)分析其低极性部位化合物组成,为扩大开发两种菌的食医药用功效提供参考。
1 材料与方法
1.1 材料与仪器
野生云芝(Coriolusversicolor)、槐耳(Trametesrobiniophila)子实体 于2017年9月采自四川绵阳市北川县,由西南科技大学生命科学与工程学院菌物学教授贺新生鉴定;大肠埃希菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus) 由广东微生物研究所提供;DPPH(1,1-二苯-2-苦肼自由基) 梯希爱(上海)化成工业发展有限公司;正构烷烃(C1~C31)标准溶液(10 g·L-1) 美国Sigma-Supelco公司;维生素C 上海阿拉丁公司;无水乙醇、石油醚、乙酸乙酯等 成都市科龙化工试剂厂。以上试剂均为分析纯;纯水 为实验室自制(电阻率为18.2 MΩ·cm)。
7890A/5975C气相色谱-质谱联用仪 美国安捷伦公司;BS223S型电子精密天平 德国赛多利斯;KQ-200KDE型超声波清洗机 昆山市超声仪器有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;UV7200型可见分光光度计 龙尼柯(上海)仪器有限公司;MGC-250型光照培养箱 上海一恒科技有限公司;CR22G Ⅲ型高速冷冻离心机 日本日立。
1.2 实验方法
1.2.1 云芝及槐耳子实体的预处理 将采得的云芝及槐耳子实体经自然风干并于50 ℃烘干后粉碎,过100目筛并于4 ℃保存待用,以下所有实验在3周内完成。
1.2.2 溶剂提取物制备 采用索氏抽提法,用85%乙醇按固液比1∶5 (g/mL)回流提取两种菌体干燥粉末各50 g,2 h后过滤取上清液,滤渣继续加相同量溶剂提取,重复3次后合并上清液并旋干,得乙醇提取浸膏。
参考王静等方案[15]稍作修改,按照极性从小到大顺序分别采用石油醚、乙酸乙酯、正丁醇和水对乙醇浸膏进行再提取。按照浸膏和提取溶剂质量体积比1∶5进行超声浸提,每次超声20 min,过滤取上清液,反复3次后合并上清液,旋干得各种溶剂提取浸膏并称量计算得率,公式如下:
各组分得率(%)=各溶剂部位提取浸膏质量×100/乙醇提取浸膏质量
1.2.3 抗氧化活性评价 抗氧化活性测定包括DPPH、羟基自由基、超氧阴离子自由基、总还原力和铁螯合能力测定等多种方法,在预实验中笔者发现以上方法结果具有一致性。为方便试验中活性的快速跟踪,本试验选用了较为简便的DPPH自由基清除率实验来进行抗氧化活性判定。
准确称取1.2.1步所得各溶剂浸膏10 mg,用乙醇超声溶解定容至10 mL,得浓度为1.0 g·L-1的母液。利用移液枪进行稀释,配制成0.2、0.4、0.6、0.8和1.0 g·L-1五个等间隔梯度测试用样品液。
参考Elbadrawy等方法[16]稍作修改,在517 nm处测定吸光度值,以无水乙醇参比调零,测定0.0025 g·L-1的DPPH溶液吸光度值A0。然后分别将0.2~1.0 g·L-1五个梯度样液以及0.2 g·L-1的VC溶液(阳性对照)与0.0025 g·L-1的DPPH溶液按体积比(1∶1)混合后,避光反应20 min后测量其吸光度值,定为Ai。记录下各个浓度样品的吸光度值数据,利用如下公式计算得出各提取部位的自由基清除率,从而对其抗氧化活性进行评价。本试验每种溶液抗氧化活性平行测定3次,结果以平均值表示,清除率计算公式如下:
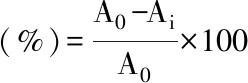
1.2.4 抗细菌活性评价 参考De等方法[17]稍作修改。分别取云芝和槐耳各溶剂提取部位的浸膏,以10%的DMSO配制成浓度梯度为5 g·L-1的样品溶液备用,用时稀释到0.5 g·L-1。
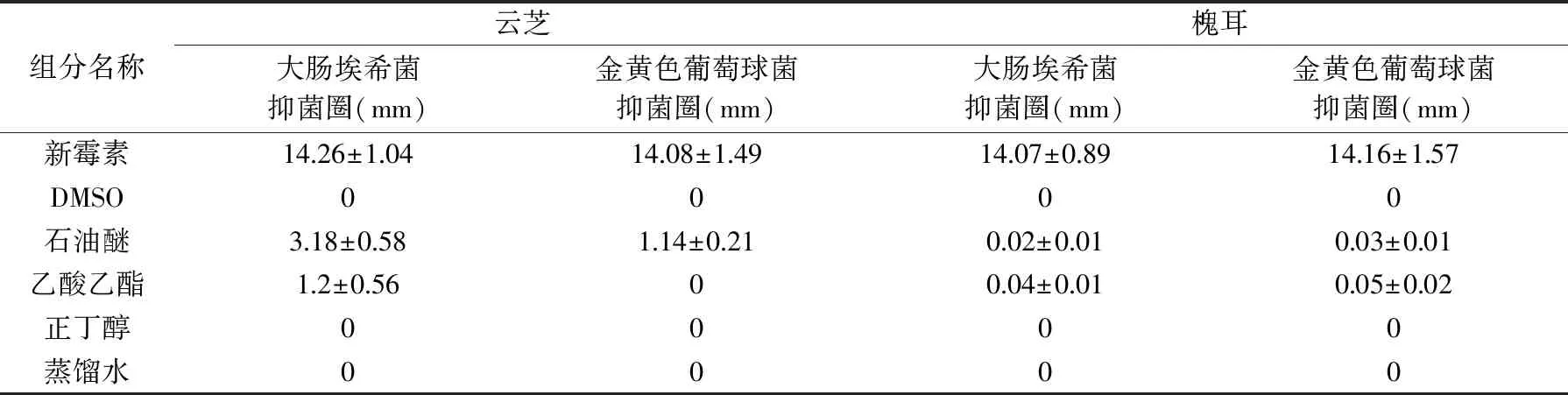
以大肠埃希菌(Escherichiacoli)和金黄色葡萄球菌(Staphylococcusaureus)为测试用菌,采用平板打孔法分别测定四种溶剂提取物的抗菌活性。具体操作方法如下:将所配制好的平板均分为两组,一组用打孔器在每个平板上打六个均匀大小的孔,分别加入阳性对照样品(新霉素)、阴性对照样品(10% DMSO溶剂)以及相同浓度梯度下的四种萃取物样品溶液各50 μL。每个样品接种3个平板做重复,最后将接种好的培养基放入光照培养箱中进行培养,24 h后观察各样品溶液是否能产生抑菌圈并用游标卡尺测定抑菌圈大小,单位为mm。
1.2.5 石油醚提取物GS-MS分析 甲酯化:采用1%硫酸-甲醇加热回流酯化法[18],称取两种菌体石油醚提取浸膏50 mg加入锥形瓶中。将1%硫酸和甲醇溶液按照体积比(1∶9)配制好后,用移液管移取2 mL加入。在80 ℃水浴条件下,将装有反应物的锥形瓶持续水浴加热反应80 min。完毕后取出锥形瓶冷却至室温后,加入2 mL正己烷,再加入蒸馏水5 mL,10000 r·min-1高速离心后吸出上清液,重复3次,合并上清液供GC-MS备检。
GC分析条件:柱箱温度:40.0 ℃,进样温度:290.00 ℃,压力:49.5 kPa,总流量:14.0 mL·min-1,柱流量:1.00 mL·min-1,线速度:36.1 cm·s-1,吹扫流量:3.0 mL·min-1,分流比:10.0。其中温控程序如表1。
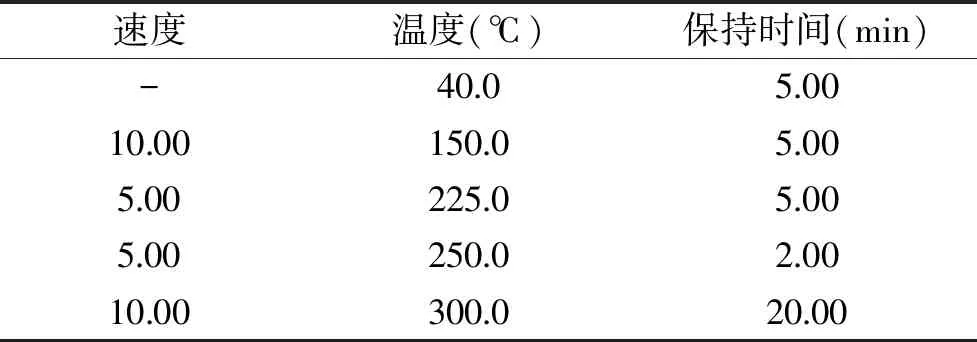
表1 GC-MS温控程序表Table 1 GC-MS temperature control program
保留指数(Kovats Index,KI)值测定:取正构烷烃标准品按照与样品相同的条件分析,记录每个正构烷烃标准品出峰的保留时间,数据代入线性升温公式[19]计算各组分的KI值
KI=100n+100(tx-tn)/(tn+1-tn)
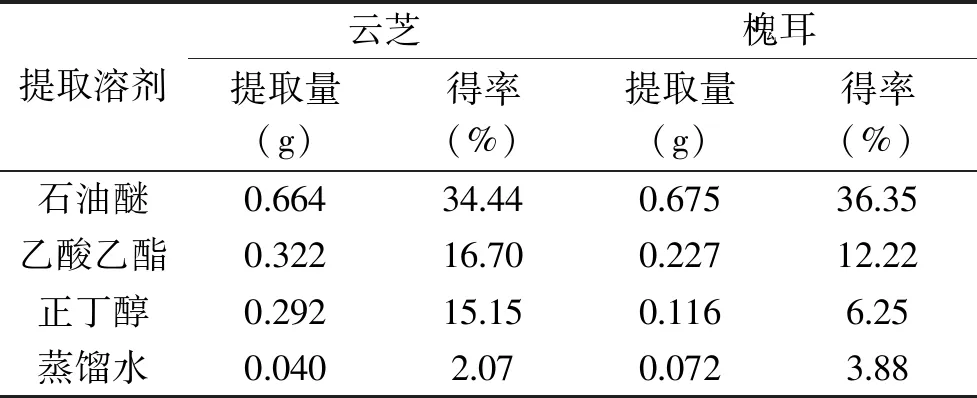
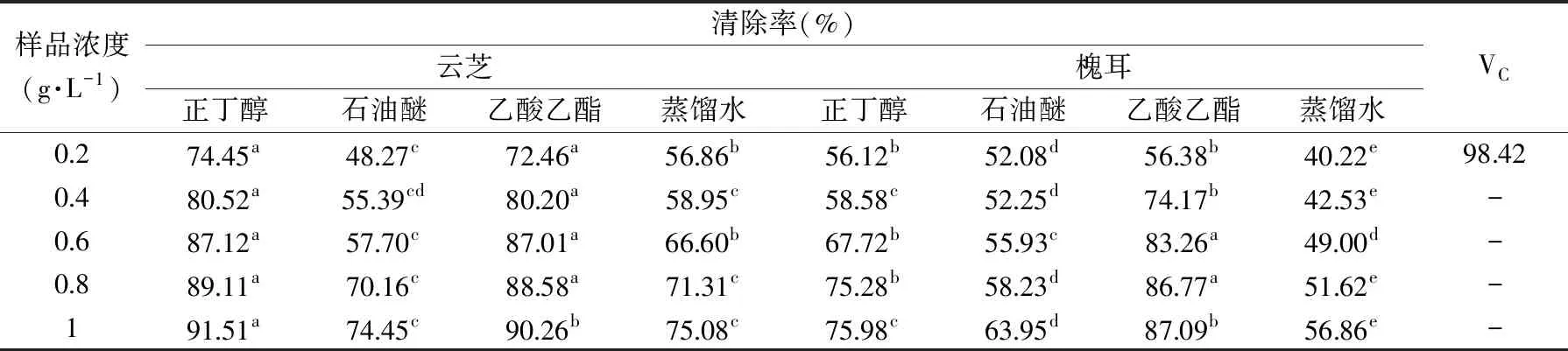
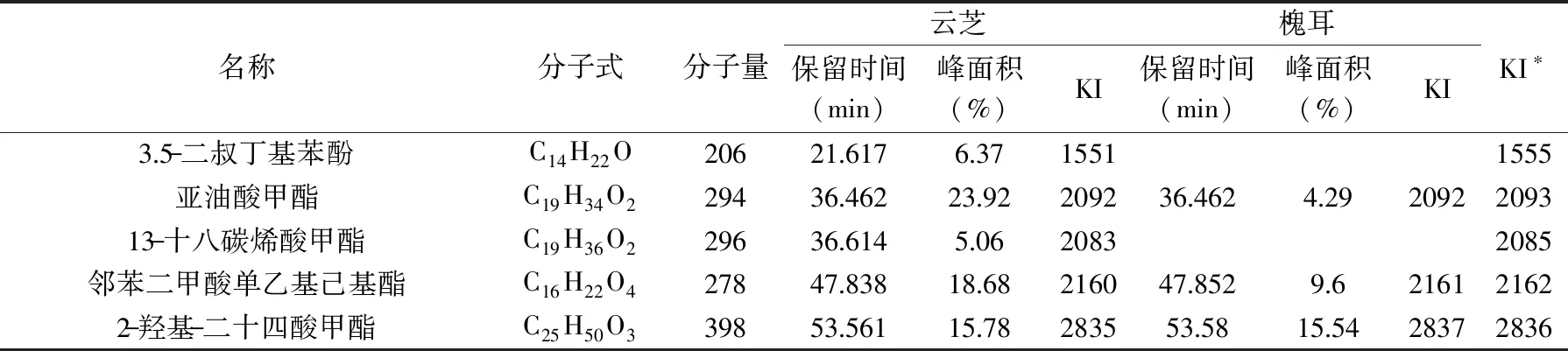
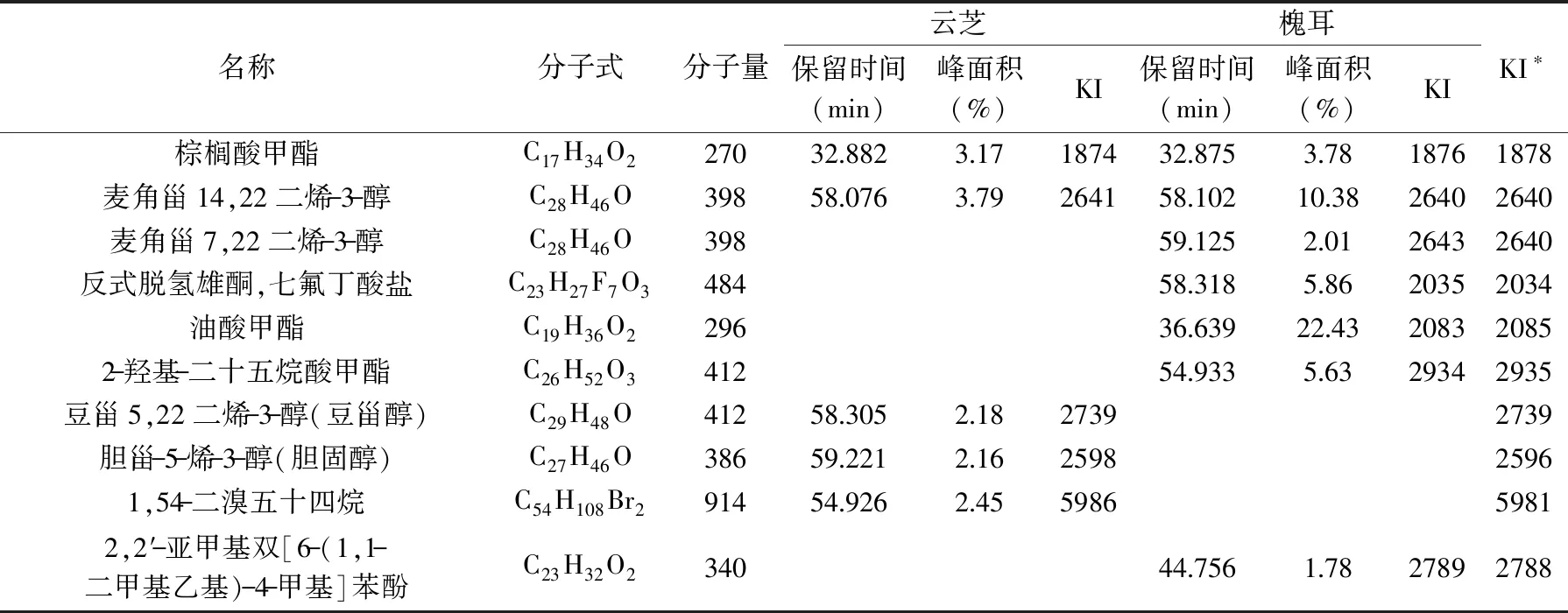
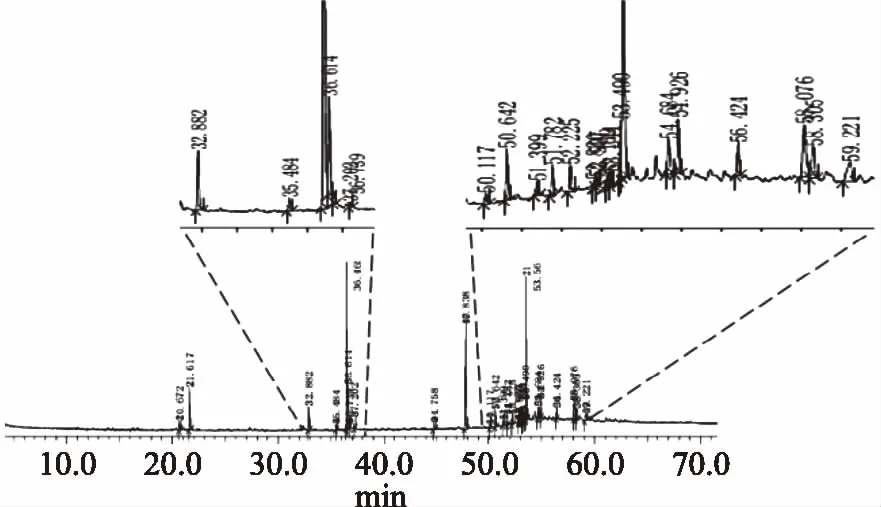
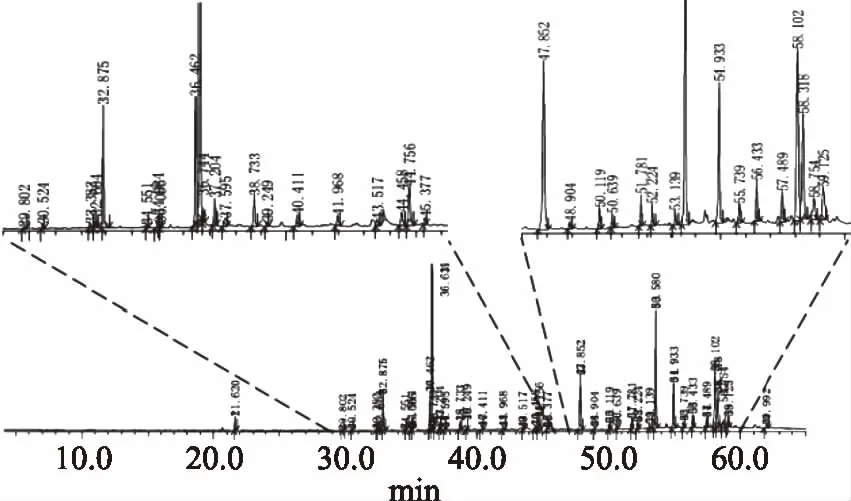
其中:tx、tn和tn+1分别为被测组分和碳原子数n和(n+1)的正构烷烃(tn MS程序:离子源温度200.00 ℃,接口温度220.00 ℃,溶剂延迟时间3.80 min,MS记录时间:开始时间4.00 min,结束时间73.00 min,扫描速度:1428,开始m/z:33.00,结束m/z:700.00,样品进样单元:GC。 采用SPSS 20.0统计软件对数据进行处理,实验结果以平均值±标准差(x±s)表示,组间比较采用单因素方差分析,两组均数之间采用Duncan检验,检验结果用字母法表示,实验重复3次,结果取平均值。 利用85%乙醇对云芝和槐耳(各50 g)进行索氏抽提后分别得到云芝浸膏1.928 g和槐耳浸膏1.857 g。用石油醚、乙酸乙酯、正丁醇和蒸馏水依次对以上两种真菌的醇提浸膏进行超声再浸提,各部分得率见表2,两种菌体石油醚部分得率均最高,说明均含有较多的低级性化合物。 表2 各溶剂提取得率Table 2 The extraction yield of various solvent 从云芝和槐耳的四种溶剂提取物的DPPH自由基清除率数据(见表3)可知,清除率均随样品浓度的增加而增加,呈现出良好的量效关系。云芝不同提取部位的抗氧化活性顺序为正丁醇>乙酸乙酯>蒸馏水>石油醚;而槐耳不同提取部位抗氧化活性顺序为乙酸乙酯>正丁醇>石油醚>蒸馏水。在0.2 g·L-1浓度时,所有样品抗氧化活性均低于同浓度下的阳性对照抗坏血酸(VC),云芝各部位均高于槐耳,特别是乙酸乙酯和正丁醇部分抗氧化活性较高,可重点在这两个部位中开发抗氧化活性物质。 表3 四个萃取部位的DPPH自由基清除率Table 3 DPPH free radical scavenging rate of four extraction fractions 以新霉素为阳性对照,DMSO为阴性对照测试两种菌的抗菌活性。在不同浓度下各提取部分对大肠埃希菌、金黄色葡萄球菌的抑制情况见表4。 表4 两种菌不同组分的抗菌活性Table 4 Antibacterial activity of different components from two mushrooms 由表4可知,云芝除石油醚组分有较弱的抑菌活性外其余组分均无明显效果,槐耳的各个组分均无较强抑菌效果。两种菌在抗细菌活性表现上均较差,不具抗菌开发价值。该实验结果和Matijasevic等[20]报道略有不同,Matijasevic报道云芝甲醇提取物对大肠埃希菌的半数抑制浓度为20 mg/mL,而本文未测试出明显的抑菌活性。经文献对比,确定可能有两方面原因,一是所测试组分为醇提组分的再萃取产物;二是测定浓度较低,仅为0.5 mg/mL,以上两原因造成实际测试浓度远低于文献报道,这就造成了活性偏低。 根据2.2~2.3活性测评结果,两种真菌各组分抗菌活性均不高,但抗氧化活性表现较好。因GC-MS多用于测定低极性化合物,遂对云芝与槐耳石油醚部分进行GC-MS分析,后续试验将采用HPLC-MS对中等极性和强极性部位的乙酸乙酯和正丁醇组分进行分析。 通过GC-MS分析经甲酯化后的石油醚萃取部分,得到两菌的离子流谱图(图1和图2)和质谱数据,发现云芝石油醚组分中含有27种化合物,槐耳则含有39种化合物。分别选取含量前10的化合物,结合KI值和质谱数据库对比分析,得到表5化合物。 表5 两种真菌石油醚组分GC-MS分析结果表Table 5 GC-MS analysis results of petroleum ether components from two mushrooms 续表 图1 云芝石油醚部分GC-MS图谱Fig.1 GC-MS spectra of petroleum ether components from Coriolus versicolor 图2 槐耳石油醚部分GC-MS图谱Fig.2 GC-MS spectra of petroleum ether components from Trametes robiniophila 两种真菌石油醚组分成分差异不大,主要是脂肪酸或固醇类物质。云芝中含量最高为亚油酸甲酯(23.92%),它可以直接作用于呼吸道上皮细胞,调节黏液的基因表达、生产和分泌[21]。其衍生物亚油酸具有抗癌、抑制动脉粥样硬化,减少体脂,同时改善瘦体重,调节免疫和炎症反应等活性[22-23]。槐耳中含量最高的物质为油酸甲酯(22.43%),它增加雄激素敏感组织的重量和血浆睾酮水平[24]。共同含有的化合物有亚油酸甲酯、邻苯二甲酸单乙基己基酯、棕榈酸甲酯、2-羟基-二十四酸甲酯和麦角甾14,22二烯-3-醇。其中,棕榈酸甲酯对心脏、肝脏、肺都具有保护作用[25-26],而且还具有抗炎活性[27]。 通过实验可知,云芝各组分抗氧化活性均高于槐耳,特别是其乙酸乙酯部位对DPPH自由基的抑制率达到了91.51%,而正丁醇部位也达到了90.24%,是可开发的良好原料。有文献报道云芝中多糖具有抗氧化活性[28],但多糖属于大分子,水溶性很强,较少存在于以上部位,因此可推断这两部分应存在小分子活性单体化合物,还需后续研究进行证实。 GC-MS结果显示两种多孔菌科真菌的低极性部位化学成分比较相似,以多不饱和脂肪为主,主要包括亚油酸甲酯(云芝23.92%,槐耳4.29%),邻苯二甲酸单乙基己基酯(云芝18.68%,槐耳9.60%)和2-羟基-二十四酸甲酯(云芝15.78%,槐耳15.54%)等。根据Peng[29]等报道人体多不饱和脂肪酸在宿主防御和免疫中发挥了多重关键作用,包括抗癌、抗炎、抗氧化活性,以及肠道致病菌的竞争。因此,虽然该部位抗氧化和抗菌活性较低,但两种菌的低极性部位任可作为抗癌、抗炎等药物生产的原料以备开发。1.3 数据处理
2 结果与分析
2.1 提取得率
2.2 抗氧化活性评价
2.3 抗细菌活性评价
2.4 两种菌石油醚萃取部分GC-MS结果分析
3 结论及讨论

