苹果根皮苷-2-O-糖基转移酶基因克隆与表达模式分析
冉军舰,梁新红,陈晓静,李向阳,焦凌霞,赵瑞香,*
(1.河南科技学院食品学院,河南省高校重点实验室培育基地,新乡市农产品加工工程技术研究中心,河南 新乡 453003;2.河南科技学院新科学院,河南 新乡 453003;3.新乡职业技术学院后勤管理处,河南 新乡 453003)
根皮苷是苹果中的特征酚类物质,是苹果多酚中最具有代表性的一种多酚,属于植物黄酮类中的二氢查耳酮苷,在不同品种中差异较大[1],对苹果的风味和色泽有重要的作用[2-4],根皮苷也是功能活性最显著的多酚[5],已经证明根皮苷具有多种生物活性,如可调节血压、降低血糖、清除体内自由基、保护心脏、预防和治疗糖尿病等[6-8]。根皮苷可以作为苹果幼芽和成熟芽之间转变的多酚指示物[9]。苹果根渗出液中的根皮苷可以作为能引起苹果再植病害的微生物的一个宿主识别信号[10]。作为一个糖类运输的竞争性抑制剂,根皮苷能降低葡萄糖、3-O-甲基葡萄糖、蔗糖的摄取量[11]。
关于根皮苷的功能研究内容已经很多,作用机理也比较清楚。但是对于根皮苷在苹果果实内的合成中,催化物质之间转化的酶类研究较少,远没有达到像花青素[12-15]那样的深度和广度。根皮苷生物合成过程分别是对香豆酰辅酶A通过脱氢酶催化生成4-羟基二氢肉桂酰辅酶A,然候再由查耳酮合酶催化合成根皮素,最后通过糖基转移酶作用在其上2′位上糖基化形成根皮苷,而糖基转移酶是合成根皮苷的最后一步关键酶。目前关于查尔酮类和黄酮类物质的体内合成和代谢已经在基因和酶的水平上做了大量的研究[16],其合成和代谢机理已经清楚,另外研究表明植物中含有多种糖基转移酶,前期有学者对草莓、葡萄、玉米、茄子、金鱼草、大豆等植物中的糖基转移酶进行了分子生物学特性研究[17-22],由于糖基转移酶具有底物特异性,也有关于人参皂苷糖基转移酶、查尔酮糖基转移酶、花青素糖基转移酶、葛根素糖基转移酶、甜叶菊苷糖基转移酶等的研究[23-28]。但苹果中二氢查尔酮类物质的生物合成过程中关键酶(糖基转移酶)编码基因仍然不甚清晰,该酶在苹果生长发育过程中的表达模式也未涉及。
本研究以苹果为材料,在本课题组前期测序基础上,筛选一条与查尔酮糖基转移酶亲缘关系最近的根皮苷-2-O-糖基转移酶(phloridzin 2′-O-glycosyltransferase,P2′-GT)的基因序列进行研究。提取苹果RNA反转录合成cDNA作为模板,利用聚合酶链式反应(polymerase chain reaction,PCR)技术克隆P2′-GT cDNA并测序获得全长序列,进行该基因的生物信息学分析,并将基因编码产物与其他物种糖基转移酶序列进行同源性分析,再利用实时荧光定量PCR(real-time fl uorescence quantitative polymerase chain reaction,RTFQ-PCR)技术分析P2′-GT基因在苹果不同部位和不同品种苹果中的时空表达模式,为P2′-GT基因在调控根皮苷合成过程中的功能研究提供理论基础,为培育高品质苹果品种提供基因资源。
1 材料与方法
1.1 材料与试剂
苹果样品采自陕西白水苹果试验站,选择富士(Fuji)、澳洲青苹(Granny Smith)、嘎啦(Gala)为材料,2017年6—10月采集3 个品种成熟期的根、叶、果实,每个样品采集3 个重复,采集土壤下10 cm处的树根和没有破损的树叶,果实采集后用小刀取果皮切成小片,果肉切成小块,所有样品用锡箔纸包装放入液氮速冻后快速置于-80 ℃冰箱中备用[29]。嘎啦品种从花后1 周采集生长初期样品,生长5 周采集生长中期样品,生长10 周采集成熟期样品;富士和澳洲青苹品种从花后1 周采集生长初期样品,生长10 周采集生长中期样品,生长20 周采集成熟期样品。每个样品设置3 个重复。
pMD-19T载体、感受态大肠杆菌DH5α、植物RNA抽提试剂盒、胶回收试剂盒、质粒抽提试剂盒 生工生物工程(上海)股份有限公司;PrimScript®带基因组DNA清除酶反转录试剂盒、荧光定量试剂盒、TaqDNA聚合酶、氨苄青霉素、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,DNTP) 大连TaKaRa生物有限公司。
LB培养基用于感受态大肠杆菌DH5α的培养。
1.2 仪器与设备
QuantStudio 3 RTFQ-PCR 美国Thermo Fisher公司;T100TMPCR仪、Powerpac通用电泳仪 美国Bio-Rad公司;RP1000910059可见分光光度计 尤尼柯上海仪器有限公司;Tanon 4200凝胶成像仪 上海天能科技有限公司;SW-CJ-1D单人单面垂直净化工作台 苏州净化仪器有限公司;CMS-20A磁力搅拌器 郑州长城仪器有限公司;SHP-250型生化培养箱 上海三发科学仪器有限公司;ZHWY-211C恒温培养振荡器 上海智诚分析仪器制作有限公司;立式压力蒸汽灭菌器 上海博讯医疗生物仪器股份有限公司;JA2003电子天平 上海浦春计量仪器有限公司。
1.3 方法
1.3.1 苹果总RNA提取
采用生工生物工程(上海)股份有限公司的植物RNA快速抽提试剂盒(Plant Total RNA Isolation Kit)分别从3 个苹果品种的皮、根、叶提取总RNA,采用反转录试剂盒(Reverse Transcriptase reagent Kit with gDNA Eraser)反转录合成cDNA。P2′-GT基因的PCR合成引物参考文献[30],引物由武汉金凯瑞公司合成,扩增P2′-GT基因引物序列如下:P2′-GT-F(5′-ATGGGAGACGTCATTGTACTG-3′);P2′-GT-R(5′-TTATGTAATGCTACTAACAAAGTTG-3′)。
1.3.2P2′-GT基因cDNA克隆
以反转录合成的cDNA作为PCR模板,对P2′-GT基因进行PCR扩增。反应体系为25 μL(ExTaq2 μL,cDNA模板2 μL,10×PCR缓冲液2.5 μL,dNTP 2 μL,Mg2+1.5 μL,上游引物P2′-GT-F 1 μL,下游引物P2′-GT-R 1 μL,ddH2O补至25 μL)。P2′-GT基因的PCR扩增程序如下:94 ℃、5 min;94 ℃、30 s,53 ℃、40 s,72 ℃、90 s,循环35 次;72 ℃、10 min。扩增结束后从PCR产物中吸取5 μL进行核酸电泳检测(1%琼脂糖凝胶,电压120 V,时间30 min,溴化乙锭染色时间15 min),然后通过凝胶成像系统检测。将PCR产物纯化后连接到pMD-19T克隆载体上,转入E. coliDH-5α感受态细胞,挑选阳性克隆PCR鉴定,将正确的单菌落测序(测序由生工生物工程(上海)股份有限公司完成)。
1.3.3P2′-GT基因生物信息学分析
将测序结果在NCBI网站利用BLAST程序与GenBank数据库中的基因序列进行同源性比对,并构建系统发育树。P2′-GT基因生物信息学分析所用在线软件如表1所示。

表1 相关在线软件网址Table 1 Online software used in this study
1.3.4P2′-GT基因的时空表达模式分析
根据设计的PCR引物选取Actin为内参基因[31],以3 个苹果品种的皮、叶、根和不同发育时期皮(初期、中期、成熟期)cDNA为模板,进行RTFQ-PCR,采用SYBRRPremix EXTaqTMII试剂盒,在RTFQPCR仪上检测基因的相对表达量。反应体系20 μL,其中SYBR®Premix EXTaqTMII 10 μL,上游引物P2′-GT-F 1 μL,下游引物P2′-GT-R 1 μL,cDNA模板1 μL,ddH2O补至20 μL。P2′-GT基因的RTFQ-PCR扩增条件:预热温度94 ℃、时间4 min;解链温度94 ℃、时间15 s,退火温度53 ℃、时间40 s,循环45 次。每个样品设置3 个重复。
1.4 数据统计分析
用SPSS 18.0和Origin 8.0软件进行数据处理和图形绘制。
2 结果与分析
2.1 P2′-GT基因全长cDNA克隆
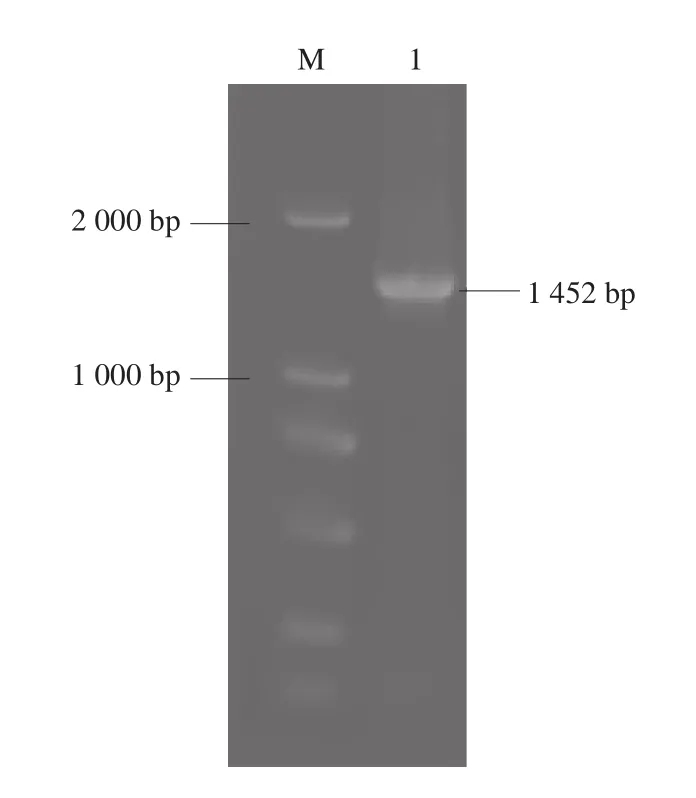
图1 P2′-GT cDNA PCR扩增Fig. 1 Electropherogram of PCR-ampli fi ed P2′-GT cDNA
以苹果组织cDNA为模板PCR扩增P2′-GT基因,与克隆载体pMD-19T连接并转化感受态,挑选阳性克隆提取质粒进行验证,后测序获得一条1 452 bp的基因片段(图1)。
2.2 P2′-GT序列分析
利用在线工具ProtParam分析P2′-GT氨基酸序列结果表明,P2′-GT编码483 个氨基酸,理论分子质量为53.6 kDa,等电点5.76,不稳定指数42.6,根据不稳定系数大于40即不稳定蛋白的标准[32],该蛋白属于不稳定蛋白。TMHMM分析结果见图2a,P2′-GT基因编码产物氨基酸跨膜螺旋中的氨基酸残基数是11.73,前60 个氨基酸残基数是10.53,跨膜蛋白判定的相关标准显示[33],如果预测蛋白前60 个氨基酸中跨膜螺旋中有数个氨基酸残基数,预测跨膜螺旋中的氨基酸残基数大于18,则氨基酸很有可能存在跨膜序列,并且蛋白的N端可能存在信号肽,由此可以说明P2′-GT基因编码产物不具有明显的跨膜结构,而且N端不存在信号肽。InterProScan分析结果(图2b)显示P2′-GT基因编码产物有糖基转移酶的家族特征结构域,位于第359~402个氨基酸之间。SOPM分析结果(图2c)显示P2′-GT基因编码产物存在α-螺旋、伸展链、β-转角和无规卷曲。其有166 个氨基酸形成α-螺旋,占所有氨基酸的34.37%,100 个氨基酸形成伸展链,占所有氨基酸的20.7%,171 个氨基酸形成无规卷曲,占所有氨基酸的35.4%。Swiss-Model软件进行同源建模得到P2′-GT基因编码产物的三级结构图(图2d),P2′-GT蛋白模型与对苯二酚葡萄糖基转移酶最高(41.32%)。
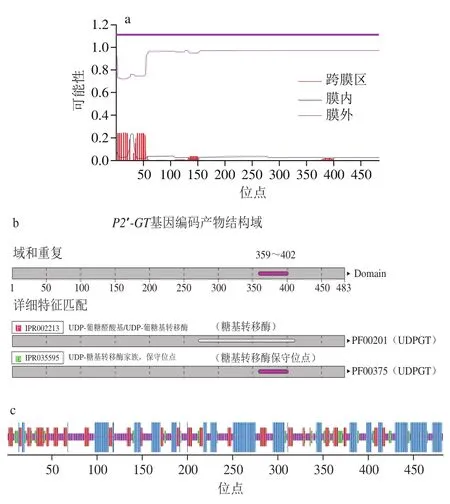
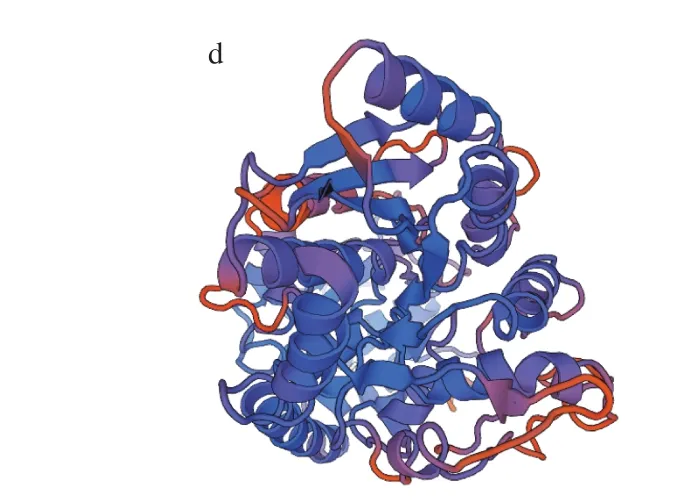
图2 P2′-GT基因编码产物生物信息学分析Fig. 2 Bioinformatic analysis of the protein encoded by P2′-GT gene
2.3 P2′-GT氨基酸序列同源性分析
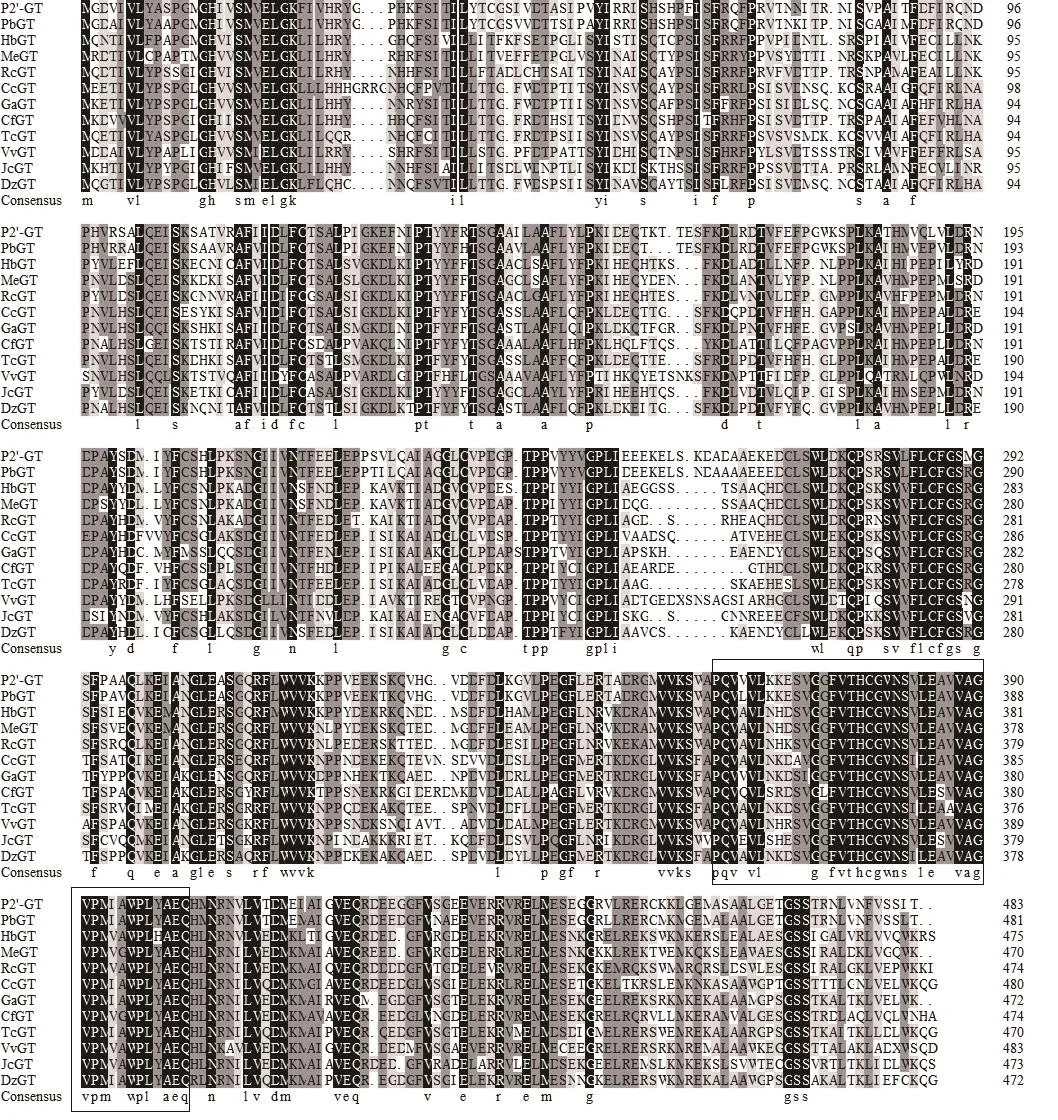
图3 P2′-GT基因编码氨基酸与其他植物糖基转移酶氨基酸序列比对Fig. 3 Alignment of amino acid sequence encoded by P2′-GT gene with those in other plants
将氨基酸序列进行BLASTp比对分析,用DNAMAN将苹果P2′-GT与其他物种的糖基转移酶进行同源性比对,结果如图3所示,对比结果发现P2′-GT与其他物种糖基转移酶类似,在C末包含44 个氨基酸的糖基转移酶保守序列(359~402),是一个酶超家族,该序列参与催化葡萄糖基连接到疏水基的过程,这表明P2′-GT是葡萄糖基转移酶的一种,推测其与其他植物的GT具有相同的功能。
用MEGA5.0软件采用邻位相接法(Neighbor-Joining)构建苹果P2′-GT的系统发育树(图4)。结果表明从苹果中扩增的P2′-GT基因的氨基酸序列与白梨(P. bretschneideriXP_009362434.1)中糖基转移酶的同源性最近,与木薯(M. esculentaOAY23754.1)糖基转移酶、橡胶树(H. brasiliensisXP_021650427.1)糖基转移酶、蓖麻(R. communisXP_015576377.1)糖基转移酶的同源性最远,表明P2′-GT基因的氨基酸序列在同蔷薇科中具有较高的保守性,亲缘关系较近。
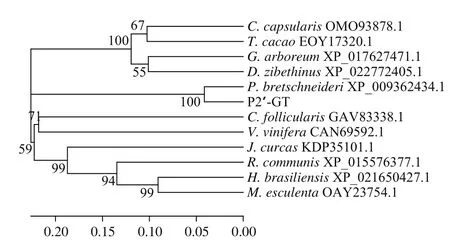
图4 P2′-GT基因编码产物系统进化树Fig. 4 Phylogenetic tree of P2′-GT gene encoded product
2.4 P2′-GT基因表达模式
以富士、澳洲青苹和嘎啦3 种苹果的果肉、皮、根、叶的cDNA为模板,利用RTQF-PCR检测P2′-GT基因在不同苹果品种的不同组织中的表达情况,结果如图5所示,P2′-GT基因在3 种苹果的皮中均高效表达,在叶、根中微量表达,在果肉中不表达,说明P2′-GT基因在苹果中为皮特异表达模式;P2′-GT基因在不同苹果品种皮中表达量有显著性差异(P<0.05),澳洲青苹皮中的表达量最高,在嘎啦皮中的表达量最低。以富士、澳洲青苹和嘎啦3 种苹果3 个不同发育时期皮cDNA为模板,利用RTQF-PCR检测P2′-GT基因在不同苹果品种的不同发育时期的表达情况,结果如图6所示,在3 个品种苹果中,P2′-GT在果实发育初期皮中几乎不表达,在果实发育中期表达量迅速增加到最高值,在果实成熟期表达量降至最高值的50%,表达量有显著性差异(P<0.05),与前期测定根皮苷在苹果不同生长时期的含量变化呈正相关。
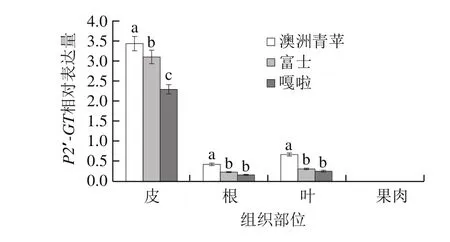
图5 P2′-GT在不同品种不同组织的表达模式分析Fig. 5 Expression patterns of P2′-GT in different apple varieties and different organs
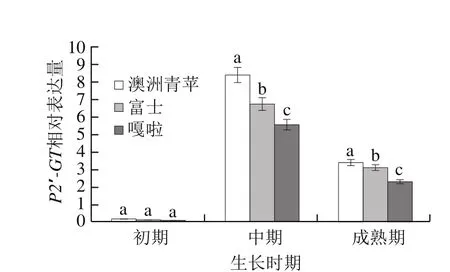
图6 P2′-GT在不同品种不同发育时期的表达模式分析Fig. 6 Expression patterns of P2′-GT in different apple varieties and different growth periods
3 讨论与结论
在苹果根皮苷合成途径中,P2′-GT是根皮苷合成途径中的最后一个关键酶,在该酶的催化下根皮素在2′位上连接一分子的β-D-吡喃葡萄糖形成根皮苷,由于根皮苷具有多种生理功能且只存在于苹果和多穗柯甜茶中,所以根皮苷的生物合成关键酶的基因克隆成为了研究热点,这对于苹果分子育种具有重要的意义。本课题组在前期研究的基础上利用分子技术成功克隆出一条P2′-GT基因的cDNA全长序列,分析发现在P2′-GT氨基酸C端有糖基转移酶的保守序列,位于第359~402个氨基酸,与其他植物糖基转移酶有相同或相似的保守序列,推测其与其他植物的糖基转移酶具有相同的功能。通过构建系统发育树发现苹果根皮苷P2′-GT与白梨亲缘关系最近,同属于蔷薇科植物,说明P2′-GT具有较高的保守性。P2′-GT基因表达活性与根皮苷的累积呈正相关的关系,在苹果发育初期P2′-GT表达量低,根皮苷含量相应较低,在苹果发育中期P2′-GT表达量达到最高,根皮苷含量也达到最高,在苹果成熟期P2′-GT表达量有所下降,根皮苷含量也随之下降;相比于根、叶、果肉,P2′-GT在苹果皮中高效表达,根皮苷含量也是最高,在其他组织中微量表达或者不表达,根皮苷含量也随之降低;此外,P2′-GT在不同苹果品种中转录表达不同,在澳洲青苹中高效表达,在嘎啦中微量表达,这与前期根皮苷含量测定结果相对应[34],在P2′-GT高效表达的时期、苹果部位和苹果品种时,根皮苷的含量也相应增加,两者之间呈正相关的关系。本研究通过对P2′-GT基因的氨基酸序列分析以及P2′-GT在不同苹果品种、不同苹果组织和不同苹果生长时期的转录表达分析,为进一步研究P2′-GT在根皮苷合成过程中的功能及其分子育种方面提供了理论支持。

