白花夹竹桃内生真菌NR3次生代谢产物的分离鉴定及抗菌活性研究
孔 阳, 马养民*, 关 磊, 周 行, 杜树荣
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 712100; 2.云南省林业调查规划院, 云南 昆明 650051)
0 引言
白花夹竹桃(NeriumindicumMill.CvPaihua)为夹竹桃科夹竹桃属植物[1].夹竹桃属于强心类中药,味苦、性寒、有毒,归心经.主要功能为强心利尿、祛痰定喘、镇痛、祛瘀.近代临床运用该药治疗心力衰竭、喘息咳嗽、癫痫、跌打损伤等症[2,3].植物内生真菌是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各组织和器官内部或细胞间隙而没有引起宿主明显病害症状的真菌.植物内生真菌能够产生结构新颖、功能特殊的次生代谢产物,作为新的医药资源正受到广泛的关注[4,5].
目前,关于白花夹竹桃内生真菌的研究鲜有报道,NR3是分离自白花夹竹桃的一株内生真菌,前期研究发现其具有较好的抗菌活性,因此本研究对NR3的次生代谢产物及其抗菌活性进行了研究,以期为发现新的先导化合物和抗菌活性物质提供理论依据.
1 材料与方法
1.1 菌株
从秦岭地区的白花夹竹桃(NeriumindicumMill.CvPaihua)根中分离得到内生真菌NR3,在4 ℃下用PDA培养基保存备用.
活性测试菌:细菌有革兰氏阳性菌金黄色葡萄球菌(Staphylococcusaureus)、乳链球菌(Streptococcusagalactiae),革兰氏阴性菌用大肠杆菌(Enterococcuscoli)和铜绿假单胞菌(Pseudomonasaeruginosa),以上菌种均由陕西省微生物研究所提供.植物病原真菌有苹果腐烂菌(Cytosporasp.)、白菜黑斑病菌(Alternariabrassicae)、芍药炭疽病菌(Peonylongipes)、辣椒疫霉病菌(Phytophthoracapsic),以上菌种由陕西科技大学微生物实验室提供.
1.2 材料与仪器
1.2.1 仪器及试剂
(1)主要仪器:SW-CJ-1FD 超净工作台(上海博迅);YX280B 手提式压力蒸汽灭菌锅(上海三申);DH5000B 电热恒温培养箱(天津市泰斯特);电子天平(北京赛多利斯);HZQ-Q型全温数显振荡器(金坛瑞华).
(2)主要试剂:琼脂粉、蛋白胨、牛肉膏(北京奥博星);葡萄糖、蔗糖(上海化学试剂公司);DMSO、硝酸钠、氯化钾、硫酸亚铁、氯化钠、七水硫酸镁、磷酸氢二钾(天津博迪化工);其余试剂均为分析纯.
1.2.2 培养基
(1)PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 000 mL,pH自然.
(2)牛肉膏蛋白胨培养基:牛肉膏5 g,蛋白胨10 g,食用盐5 g,琼脂20 g,H2O 1 000 mL pH自然.
(3)察氏液体培养基:蔗糖30 g,NaNO32 g,KCl 0.5 g,Mg SO4·7H2O 0.5 g,FeSO40.01 g,K2HPO41 g ,水1 000 mL,pH自然[6].
(4)大米固体培养基:每100 g大米加入120 mL无糖察氏液体培养基.
1.3 夹竹桃内生真菌NR3的鉴定
将菌株NR3接种于PDA斜面培养基,在28 ℃下培养3 d至孢子成熟,利用CTAB法[7]提取菌丝体基因组DNA.以提取到的基因组DNA为模板,通过引物ITS1F和ITS4R扩增目标菌株的ITS区.将测序获得的ITS序列通过与NCBI数据库进行同源性分析,利用MEGA6.06软件采用Neighbour-joining方法构建系统发育进化树,再结合形态学方法对菌株NR3进行鉴定[8].
1.4 次生代谢产物的分离纯化
1.4.1 内生真菌NR3的发酵
将菌株NR3种子液接种于大米固体培养基(100 g大米,120 mL无糖察氏培养基)中,28 ℃培养20天后,将发酵产物阴干粉碎,用95%乙醇回流提取3次,回收溶剂得次生代谢产物粗提物430 g,置于无菌瓶中2 ℃低温保存.
1.4.2 代谢产物的分离纯化
将NR3乙醇提取物430 g溶解于甲醇中,再与等量硅胶混和均匀,待溶剂完全挥干之后,进行硅胶柱层析,以石油醚、石油醚/乙酸乙酯=1∶1、石油醚/乙酸乙酯=1∶2、乙酸乙酯、乙酸乙酯/甲醇=1∶1、乙酸乙酯/甲醇=1∶2、甲醇为溶剂进行梯度洗脱,混合溶剂系统和乙酸乙酯:甲醇混合溶剂系统进行梯度洗脱,得到Fr.1~7共七相,Fr3再进行Flash中压液相色谱、Sephadex LH-20柱色谱分离,再经过重结晶纯化,得到化合物1(14 mg)、化合物2(13 mg),Fr.4再进行Flash中压液相色谱、Sephadex LH-20柱色谱分离,再经过重结晶纯化,分别得到化合物3(20 mg)、化合物4(21 mg).Fr.5和等量硅胶混合进行Sephadex LH-20柱色谱分离,得到化合物5(16 mg)、化合物6(11 mg)和化合物7(26 mg).
所有化合物用核磁共振仪测定其1HNMR、13CNMR、HSQC和HMBC数据鉴定结构.
1.5 样品最小抑菌浓度(MIC)测定
采用二倍稀释法[9],将各样品溶解于DMSO溶剂中,配制成质量浓度为0.25 mg/mL的样品溶液.将灭菌的培养基用微量移液器吸取100μL到96孔板的每孔中,再向第1孔中加入配制好的样品溶液100μL,混合均匀后从第1孔中吸取100μL加入到第2孔中,混合均匀后再从第2孔中吸取100μL加入到第3孔中,按照此法连续稀释至第10孔,然后从第10孔中吸取100μL弃去,第11孔和第12孔作为培养基和DMSO溶剂空白对照.96孔板上的第1~10孔的样品浓度分别为125μg/mL、62.5μg/mL、31.25μg/mL、15.63μg/mL、7.82μg/mL、3.91μg/mL、1.96μg/mL、0.98μg/mL、0.49μg/mL和0.25μg/mL.
用培养基配制浓度为106CFU/mL的指示菌菌悬液(细菌用平板菌落计数法,真菌采用孢子计
数法[10]),分别向每孔中加入100μL的菌悬液.其中选用对革兰氏阳性菌和革兰氏阴性菌都有较好抑制作用的头孢呋辛钠作为阳性对照,选用多菌灵(酮康唑)作为植物病原真菌的阳性对照,DMSO试剂作为阴性对照,每组实验做3次平行.将细菌实验组的96孔板置于37 ℃恒温培养箱培养24 h,植物病原真菌实验组的96孔板置于28 ℃培养48 h后置于黑色背景下观察溶液是否有沉淀或浑浊,当某一混合溶液透明澄清,则说明化合物在此浓度可以抑制该菌生长,该浓度即为样品的最小抑菌浓度MIC,并记录样品的最小抑菌浓度.
2 结果与讨论
2.1 NR3基因序列结果
内生真菌NR3通过ITS测序并与NCBI数据库进行同源性分析,利用MEGA6.06软件采用Neighbour-joining方法构建系统发育进化树(见图1),再结合形态学方法对菌株NR3进行鉴定[8],初步确定菌株NR3为烟曲霉(Aspergillusfumigatus).

图1 基于ITS序列的NR3系统发育树
2.2 化合物结构鉴定结果
采用核磁共振光谱1HNMR、13CNMR及二维核磁HSQC、HMBC数据,结合理化性质鉴定单体化合物结构,最终确定7个化合物,结构式见图2所示.
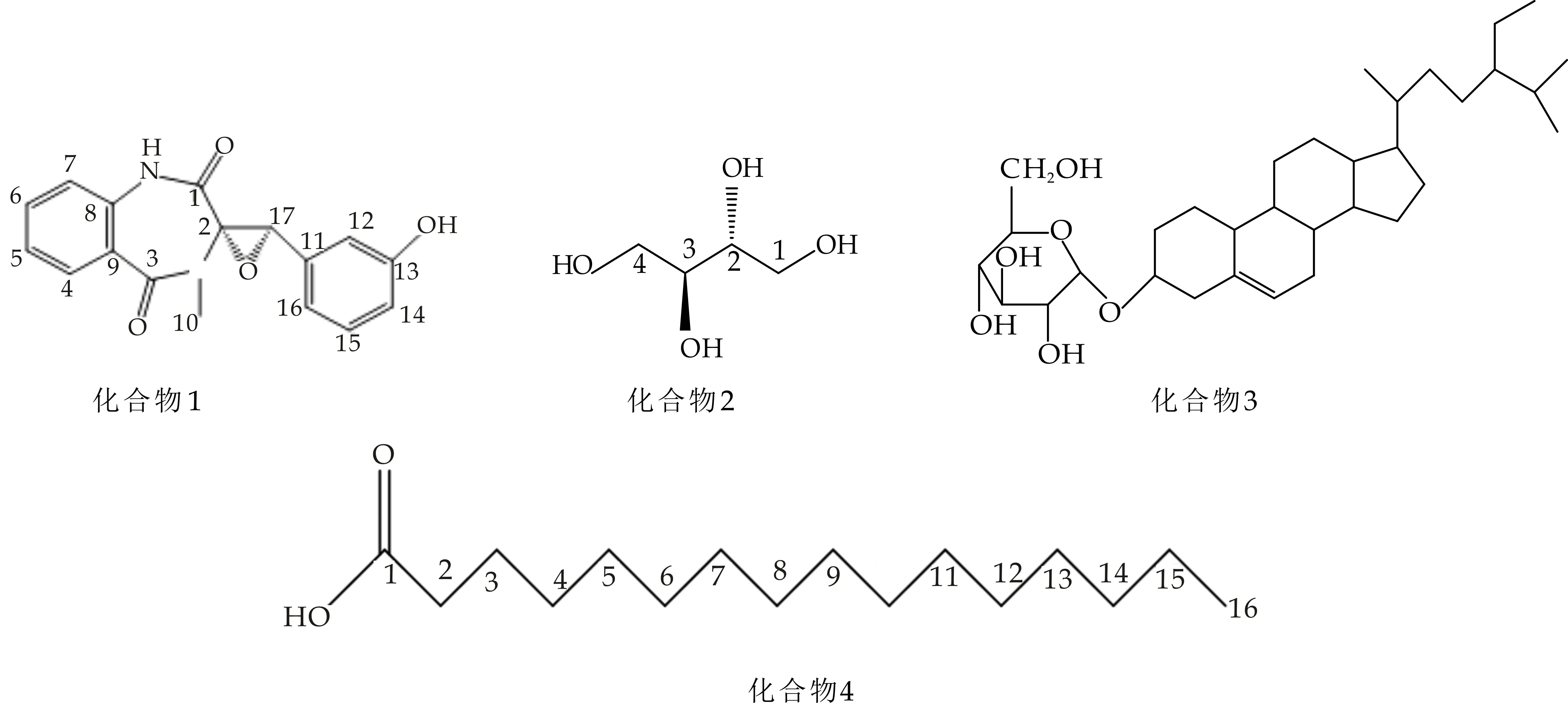
化合物1:白色粉末,易溶于甲醇,365 nm紫外光下显蓝色荧光,用5%的浓硫酸乙醇显色呈浅黄色.1HNMR(400 MHz,DMSO-d6)δ:9.44(s,1H)为NH氢的吸收峰;7.02(dd,J=8.0 Hz,1H,4-H),7.56(1H,td,J=16 Hz,5-H),7.12(td,1H,J=12 Hz,6-H),7.16(1H,dd,J=16 Hz,7-H),3.07(s,3H,10-H),6.12(t,1H,J=4.0 Hz,12-H),6.68(dt,1H,J=4.0 Hz,14-H),6.98(t,1H,J=8.0 Hz,15-H),6.01(d,1H,J=8.0 Hz,16-H),4.25(s,1H,17-H).13CNMR (100 MHz,DMSO)显示出17个碳信号,δ:165.92(C-1),70.08(C-2),165.31(C-3),130.48(C-4),132.28(C-5),124.19(C-6),121.02(C-7),135.04(C-8),126.42(C-9),30.81(C-10),132.32(C-11),112.7(C-12),156.85(C-13),115.64(C-14),128.86(C-15),116.92(C-16),63.68(C-17).核磁数据与文献[11]一致,确定化合物1为圆弧菌醇(eyelopenol),结构式见图2.
化合物2:白色片状结晶,mp.125 ℃~126 ℃,微溶甲醇,溶于DMSO.1H-NMR (400 MHz,DMSO-d6) ,δ:4.49 (2H,d,J=4.0 Hz,1,4-OH),4.36(2H,t,J=8.0,4.0 Hz,2,3-OH)是4个羟基氢信号,δ:3.6~3.8 间的多重峰为连氧的CH2和CH的氢信号.13C-NMR(100 MHz,DMSO) 显示有2个连氧碳信号δ:73.49(C-2,3),63.21(C-1,4).综上所述并与文献[12]的核磁数据对照,确定化合物2为赤藓醇 (erythritol),结构式见图2.
化合物3:白色粉末,mp.290 ℃~291 ℃,溶于DMSO,用5%的浓硫酸乙醇显色呈现紫红色.1HNMR (400 MHz,DMSO-d6) 氢谱提示含有甾体母核,Molish反应阳性,提示该化合物可能含有糖.δ:0.66 ( 3H,s,J=6 Hz,H-18),0.79(3H,d,J=8 Hz,H-27),0.81(3H,t,J=8 Hz,H-29),0.83(3H,d,J=8 Hz,H-26),0.9(3H,d,J=4 Hz,H-19),0.96(3H,d,J=10 Hz,H-21)为6个甲基信号峰,4.21~4.89之间有6个氢质子信号,推测分子中含有糖,5.33(1H,s,H-6),4.45(1H,s,H-3).13CNMR(100 MHz,DMSO)显示出35个碳信号,δ:140.74(C-5),121.39(C-6)显示低场区有2个烯碳信号; 19.68(C-27),19.07(C-19),18.90(C-21),18.58(C-26) ,11.75(C-29),11.64(C-18)显示高场区有6个甲基信号.综上所述并与文献[13]数据对照,确定化合物3为胡萝卜苷(Daucosterol),结构式见图2.
化合物4:白色蜡状,mp.63 ℃~64 ℃.易溶于氯仿,用5%的浓硫酸反应显紫红色.1H-NMR (400 MHz,CDCl3) ,δ: 0.88(3H,t,J=8.0 Hz,H-2)是末端甲基的信号,2.35(2H,t,J=8.0 Hz,H-16)是一连接羰基的亚甲基,显示了脂肪酸的特征峰.13C-NMR (100 MHz,CDCl3),δ:179.84(C-1)显示低场有一个羧酸羰基碳, 以及15个饱和碳原子33.57(C-2),32.15(C-3),29.20~28.55(C-4~13),24.16(C-14),22.2(C-15),13.64(C-16).综上所述并与文献[14]对照,确定化合物4为十六烷酸(palmiticacid),结构式见图2.
化合物5:白色粉末,mp.139 ℃~141 ℃,易溶于氯仿,用5%的浓硫酸乙醇显色呈现紫红色,冷却褪色后为灰绿色.1HNMR(400 MHz,CDCl3),δ:5.36(1H,m,H-6)显示低场有一个烯氢吸收峰;3.53(1H,m,3-OH)是连在羟基碳上的吸收峰;1.01(3H,s,H-19),0.92(3H,d,J=8 Hz,H-21),0.84(3H,s,H-27),0.82(3H,s,H-26),0.80(3H,s,H-29),0.68(3H,d,J=8 Hz,H-18)显示高场有6个甲基信号.13CNMR (100 MHz,CDCl3)显示出29个碳信号,δ:140.26(C-5),121.24(C-6)显示低场有2个烯碳信号;19.54(C-19),18.92(C-26),18.54(C-27),18.29(C-21),11.49(C-18),11.37(C-29)是6个甲基碳峰.综上所述与文献[15]数据对照,化合物5鉴定为β-谷甾醇(β-sitostero),结构式见图2.
化合物6 :白色针状结晶,易溶于甲醇、乙醇,mp.163 ℃~165 ℃.1HNMR(400 MHz,DMSO-d6),δ:4.42(2H,d,J=5.4 Hz,2,5-OH),4.32(2H,t,J=5.6 Hz,1,6-OH),4.16(2H,d,J=7.2 Hz,3,4-OH),3.48(2H,m,2,5-H);13CNMR(100 MHz,DMSO d6)δ:71.2(C-3,4),69.6(C-2,5),63.7(C-1,6).与文献[16]数据对照,确定化合物6为甘露醇(mannitol),结构式见图2.
化合物7:白色针状结晶,易溶于乙酸乙酯、甲醇,5%硫酸-乙醇溶液反应显紫红色.1HNMR(400 MHz,DMSO-d6),δ:10.34(1H,S),10.91(1H,S),11.77(1H,S)是3个羟基氢信号,2.7(3H,S,H-7′)是一个甲基氢信号.13CNMR(100 MHz,DMSO-d6)δ:138.07(C-1),97.36(C-2),164.02(C-3),100.81(C-4),165.35(C-5),104.25(C-6),164.65(C-7),108.91(C-1′),152.56(C-2′),101.55(C-3′),158.36(C-4′),117.47(C-5′),138.27(C-6′),25.19(C-7′).核磁数据与文献[17]的核磁数据基本一致,确定化合物7为交链孢酚(Alternariol),结构式见图2.
2.3 样品的抑菌活性研究结果
2.3.1 样品对细菌的MIC测定结果
利用二倍稀释法对样品抗细菌的能力进行测定,指示菌有革兰氏阳性菌金黄色葡萄球菌(S.aureus)和乳链球菌(S.agalactiae),革兰氏阴性菌大肠杆菌(E.coli)和铜绿假单胞菌(P.aeruginosa),实验结果如表1所示.
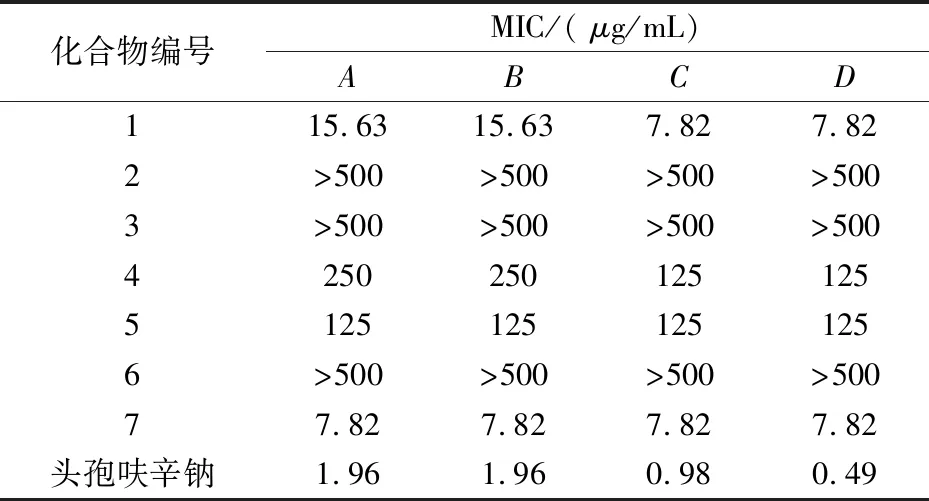
表1 样品对不同细菌的最小抑菌浓度
注:A金色葡萄球菌;B乳链球菌;C大肠杆菌;D铜绿假单胞菌
化合物1对革兰氏阴性菌具有强抑制作用MIC为7.82μg/mL,对革兰氏阳性菌也有较强的抑制作用MIC为15.63μg/mL.化合物7对供试的四种细菌都具有很强的抑制作用,MIC均为7.82μg/mL.化合物4、5对供试细菌有一定的抑制作用,而化合物2、3、6几乎没有抑菌效果.
由此可见,以苯二氮类化合物为基本母核的化合物1和以香豆素为母核的化合物7对革兰氏阳性菌以及革兰氏阴性菌都具有很好的抑制作用,可以对二者抑制其它细菌的活性做进一步研究.相反,化合物2和6对供试细菌基本无作用,二者都是多羟基醇,易溶于水有一定甜味,此类化合物对细菌基本没有抑制作用.化合物3是甾体皂苷类化合物,对供试细菌没有生理活性或许与其水溶性很差有关.
2.3.2 样品对植物病原真菌的MIC测定结果
利用二倍稀释法对样品抑制植物病原真菌的能力进行测定,指示菌为苹果腐烂菌(Cytosporasp.),白菜黑斑病菌(A.brassicae),芍药炭疽病菌(P.longipes),辣椒疫霉病菌(P.thoracapsic),样品对植物病原菌的最小抑菌浓度结果如表2所示.
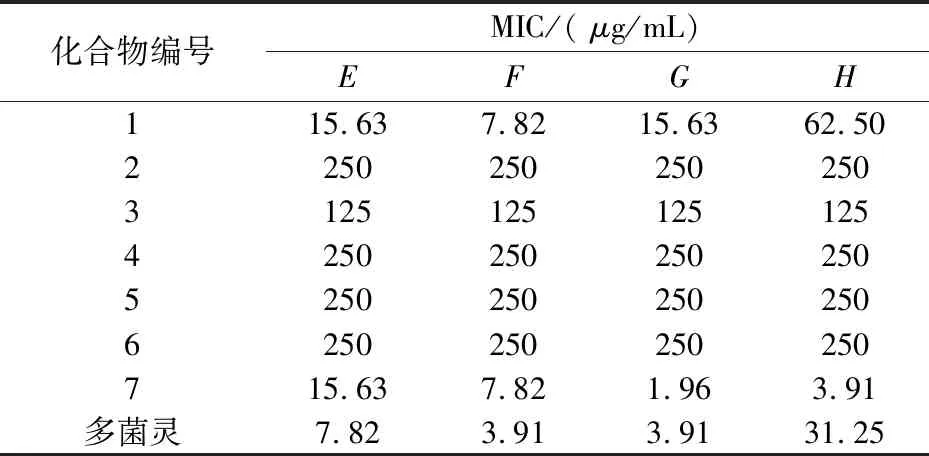
表2 样品对植物病原真菌的最小抑菌浓度
注:E苹果腐烂病菌;F白菜黑斑病菌;G芍药炭疽病菌;H辣椒疫霉病菌
从表2的结果可以看出,化合物7对供试的四种植物病原菌都有很强的抑制作用,对于芍药炭疽病菌和辣椒疫霉菌的抑制活性甚至超过了阳性对照多菌灵,MIC分别为1.96μg/mL和3.91μg/mL.化合物1与7对供试的白菜黑斑菌也具有较好的抑制作用,MIC为7.82μg/mL,对苹果腐烂菌的抑制作用也较强,MIC为15.63μg/mL.
综上所述,以苯二氮类化合物为基本母核的化合物1和以香豆素为母核的化合物7不仅对细菌有很好的抑制作用,对供试的植物病原菌抑制作用也非常明显.尤其是化合物7,抑菌作用与多菌灵相比效果更好,可以进一步作为天然抑菌剂进行研究开发.
3 结论
从白花夹竹桃内生真菌NR3的发酵产物中分离得到7个化合物,分别为一个苯二氮类化合物(圆弧菌醇)、两个多元醇(赤藓醇和甘露醇),两个甾体类化合物(胡萝卜苷和β-谷甾醇)、一个脂肪酸(十六烷酸)和一个香豆素类化合物(交链孢酚),以上7种化合物在白花夹竹桃的内生真菌中均为首次分离得到.抑菌活性结果显示,NR3能产生具有很强广谱抗菌活性的化合物.由此可见,夹竹桃内生真菌NR3的次级代谢产物丰富,后期可以继续进行系统的研究,期望能得到更多抑菌效果较好、结构新颖的次生代谢产物.

