重金属胁迫下河蚬内脏中GST mRNA表达及酶活性分析
郑双艳,刘清,张霞丽,谢彦海*
1. 南昌大学实验动物科学中心,江西 南昌 330006;2. 江西省科技型中小企业创新基金管理中心,江西 南昌 330007
重金属污染水体现象日渐严重,主要包括非必需金属离子和必需金属离子。非必需金属离子包括Cd2+、Pb2+和Hg2+等,必需金属离子包括Cu2+和 Zn2+等,它们对水生生物和人类均有很强的毒性(Anrew et al.,2003;Pretto et al.,2010),当这些离子浓度较低时,对生物体内酶的活性起重要的诱导作用,但其浓度过高时,对生物体具有一定毒性(Blanco-penedo et al.,2006)。这些重金属离子能长期存在自然水体中,水生生物遭受重金属污染后,通过食物链危害人体的健康(Chale,2002)。
近些年,通过检测鱼(Lu et al.,2015)、软体动物(Rossi et al.,2016)、甲壳动物(Harms et al.,2014)和藻类(Lauritano et al.,2016)等水生生物体内相关应激蛋白的mRNA表达程度和酶活性,可以对早期水体环境污染起到直接指示作用。谷胱甘肽-S-转移酶(glutathione S-transferase,GST)是一类多基因家族编码的二聚体可溶性蛋白的超家族酶系,是生物体内相关应急蛋白之一,具有消除体内过氧化物及解毒的双重功能(李雅琴等,2013;Chemale et al.,2010),主要功能是对异源有毒物质进行解毒,保护细胞免受氧化损伤和对激素、内及外源化合物进行细胞间运输。解毒的作用机理是促进还原型谷胱甘肽(Glutathione,GSH)的活性基团——巯基与毒素结合形成亲电子试剂(程炜轩等,2009),使亲电子的疏水化合物变成亲水物质,易于从胆汁或尿液中排出。GST通过催化过氧化氢的氧化还原反应,清除体内自由代谢反应产生的氧化自由基和过氧化物,参与体内免疫反应(罗凯娅等,2012),保护细胞免受外界胁迫造成的损伤(张永国等,2006)。研究重金属污染过程中贝类肝胰腺中GST基因表达特性和GST活性变化特征,有助于深入认识贝类在受到重金属胁迫时产生的分子应激反应及解毒机理。
河蚬(Corbicula fluminea),双壳类软体动物,栖息于淡水的江河、湖泊等,是数量较大的重要底栖生物,是江河水库等淡水生态系统的优势物种,影响着水生生态系统的物质循环。河蚬生活史较长,个体较大,以浮游绿藻为食,能直接反映水体和沉积物的污染(Xie,2017)。目前,河蚬作为指示生物已被用于评价或监测由重金属、矿山开采排放物、生活污水等引起的水体污染状况(曾丽璇等,2004)。
本研究以河蚬为对象,采用RACE方法克隆其GST基因cDNA全长;在外源重金属Cd2+、Cu2+、Pb2+单一胁迫下,观察不同时间段GST mRNA表达量和酶活性变化,分析它们与重金属胁迫的时间关系,并由此判明河蚬GST mRNA表达和酶活性是否具有作为水体重金属污染的潜在生物标志物特征,为河蚬内脏GST mRNA和酶生物标志物评价指标的建立提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物与试剂
河蚬采集于鄱阳湖地区。CdCl2、CuSO4·5H2O、Pb(CHOO)2均购自国药集团化学试剂有限公司,用双蒸馏水将其配制成浓度分别 750、150、4500 μg·mL-1的母液。GST活性测试盒和考马斯亮兰均购自南京建成生物工程研究所。SMARTTMRACE Amplificatuin Kit,Trizol Reagent,PrimeScriptTMRT reagent Kit,SYBR® Premix Ex TaqTMII购于 TaKaRa公司。
1.1.2 主要仪器
iMark酶标仪(美国BIO-RAD公司);UV 752B紫外可见分光光度计(天津市普锐斯仪器有限公司);Eppendorf Centrifuge 5804R离心机(德国Eppendorf公司);SSW-600-2S型电热恒温水槽(上海博讯实业有限公司医疗设备厂);ISO-9001电子天平(北京赛多利斯仪器系统有限公司);SZ-93A自动双重纯水蒸馏器(杭州汇尔仪器设备有限公司);NanoPhotometer Pearl蛋白核酸分析仪(德国Implen公司);7500 Real Time PCR System(美国ABI公司)等。
1.2 河蚬GST基因克隆
1.2.1 总RNA的提取以及cDNA合成
采用Trizol法从河蚬的肝胰腺中提取总RNA。RNA的完整性和质量分别用1%琼脂糖凝胶电泳和蛋白核酸分析仪进行检测。完整的 RNA用SMARTTMRACE Amplificatuin Kit(Takara 公司)试剂盒反转录成cDNA,-20 ℃保存备用。按照试剂盒的使用说明,合成用于3′, 5′RACE扩增的cDNA。反转录产物于-40 ℃冰箱中保存备用。
1.2.2 GST基因全长克隆及测序
从NCBI基因文库里获得河蚬GST基因序列片段(GenBank登陆号:KF218346.1),利用Primer Premier 5.0软件设计 3′RACE 和 5′RACE 特异性引物(表1),按照SMARTTMRACE Amplification Kit试剂盒操作说明进行扩增。3′RACE扩增条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72℃ 80 s,30 个循环;72 ℃ 10 min。5′RACE 扩增条件:94 ℃30 s,72 ℃ 3 min,5 个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5 个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,20个循环。将扩增产物连接到克隆载体pMD18-T Vecter(TaKaRa公司)转化感受态细胞,筛选出阳性基因进行克隆后交上海生物工程技术有限公司进行测序分析。

表1 河蚬GST基因克隆及表达分析引物Table 1 Primer sequences for GST cloning and expression analysis in C. fluminea
1.2.3 GST基因生物信息学分析
应用NCBI中的Blast等工具对GST基因进行同源性分析,并用DNAMAN 6.0软件进行序列比对;采用 Smart服务器分析保守域和功能位点;SignalIP 4.0工具对该基因的信号肽进行预测分析;运用软件MEGA 5.0绘制系统进化树。
1.3 重金属对河蚬的急性胁迫
1.3.1 河蚬处理
采用半静态暴露试验,模拟重金属(Cd2+、Cu2+、Pb2+)对河蚬的急性胁迫试验。供试河蚬体长为 3-5 cm,试验前将其暂养在长宽高为 30 cm×20 cm×20 cm水族箱中,1周后开始实验。河蚬被随机分成4组,分别为:Cd2+胁迫组、Cu2+胁迫组、Pb2+胁迫组和对照组,每组 50-60只。Cd2+、Cu2+和Pb2+3个实验组中金属胁迫的浓度均为10 μg·L-1,对照组中不添加任何重金属离子。胁迫0、6、12、24、48和72 h,分别在每个胁迫时间点随机选取6只河蚬,解剖取适量的肝胰腺组织,用于提取总RNA和酶活性测定实验。
1.3.2 总RNA的提取及cDNA的合成
总RNA提取方法同1.2.1反转录方法参考试剂盒(PrimeScript™ RT reagent Kit)说明书进行。
1.3.3 Real-time PCR检测GST mRNA的表达
根据本实验室克隆的河蚬 GST基因的 cDNA序列(Genebank:KX211963),以β-actin作为内参基因(Genebank:EF446608.1),设计特异性荧光定量引物(见表1)PCR反应体系为20 μL,分别含有 2×SYBRPremix ExTaqTM10 μL,ROX II 0.4 μL,GST mRNA及β-actin的上下游引物各(10 U)0.8 μL,1∶10 稀释的 RNA 逆转录得到的 cDNA2 μL和 RNase free H2O 6 μL。扩增条件为 95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,40 个循环;72 ℃ 5 min。每个样本均做 3个平行样。用7500 system SDS Software v 2.2自动进行融解曲线分析和GST mRNA基因相对表达含量分析。本实验GST基因相对表达量利用GST基因mRNA水平比内参基因mRNA水平的相对倍数来表示,即采用 2-ΔΔCt法进行计算。
1.3.4 GST活性测定
GST活力的测定采用南京建成生物工程研究所的GST测试盒测定。
1.3.5 数据处理
数据采用SPSS 20.0统计软件进行t检验分析,实验数据用平均值±标准差(Mean±SD)表示,P<0.05认为差异具有统计学意义。
2 实验结果与分析
2.1 GST基因的全长cDNA序列分析及系统进化树分析
利用 RACE技术克隆了河蚬 GST基因(GenBank登录号:KX211963),全长952 bp,其中5′非编码区为30 bp,3′非编码区为268 bp,开放阅读框为654 bp,编码一个由217个氨基酸组成的多肽,预测理论等电点PI为5.98,分子量为25.169 kD,氨基酸序列中含有GST基因家族特有的GST-N结构域和GST-C结构域(图1阴影部分),SignalP 4.1程序分析表明该 GST蛋白不存在信号肽,TMHMM软件分析表明该蛋白不存在跨膜结构。
应用Bioedit软件对河蚬GST氨基酸序列与其他物种的GST氨基酸序列进行同源比对分析,结果如图2所示。分析表明,河蚬GST基因与菲律宾帘蛤(Rudiraps philippinarum)同源性最高,为90.32%,河蚬与近江牡蛎(Crassostreaariakensis)、盘鲍(Haliotis discus)、魁蚶(Scapharacabroughtonii)、霸王莲花青螺(Lottiagigantea)、斑节对虾(Penacus monodon)、罗非鱼(Oreochromisniloticus)、锦鲤(Cyprinuscarpiao)、大西洋鲱(Clupeaharengus)的相似性分别为 74.65%、73.27%、72.81%、70.51%、64.55%、64.09%、60.81%、60.81%。结果说明,河蚬GST基因与菲律宾帘蛤同属一支。
2.2 河蚬GST mRNA表达及活性变化
2.2.1 Cd2+胁迫下,河蚬GST mRNA表达及酶活性变化

图1 河蚬GST基因的核苷酸序列及推测的氨基酸序列Fig. 1 Nucleotide and deduced amino acid sequences of C. fluminea GST
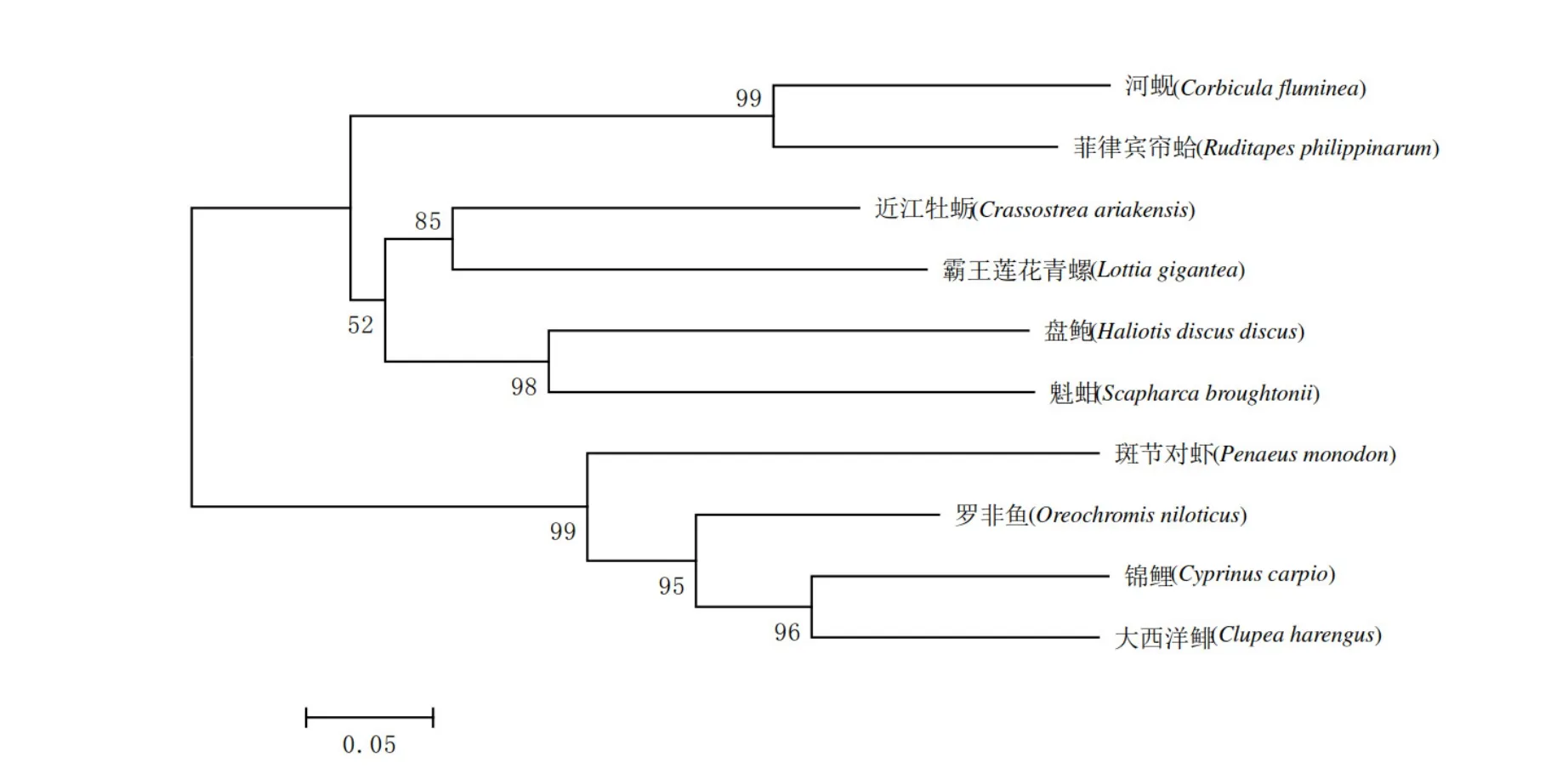
图2 河蚬GST与其他物种GST的系统发育树Fig. 2 Phylogenetic tree of GST of C. fluminea and other species based on amino acid sequence
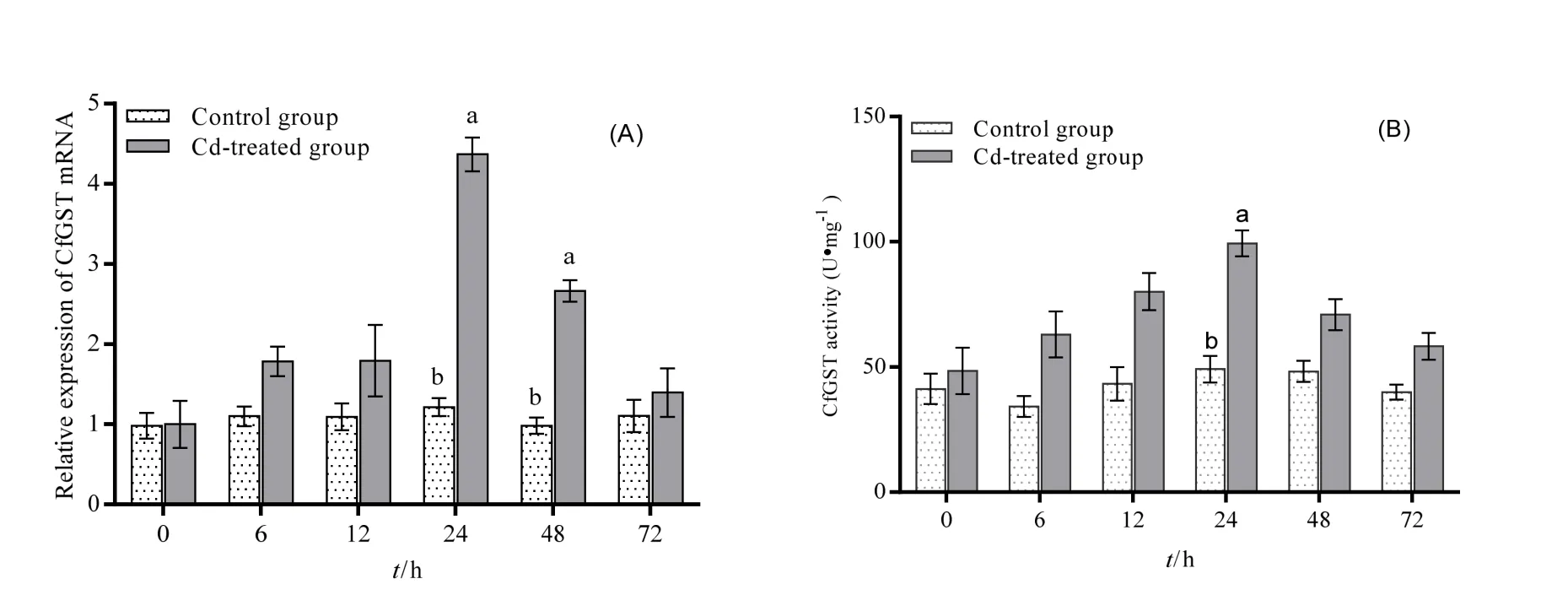
图3 肝胰腺GST mRNA表达水平(A)和活性(B)变化Fig. 3 Changes of GST mRNA expression (A) and activity in hepatopancreas (B)
经Cd2+胁迫后,河蚬GST mRNA表达水平和酶活性均随着时间延长逐渐增强,到达峰值后又逐渐减弱,胁迫组GST mRNA表达量在24 h和48 h分别约为对照组的4倍和3倍,与对照组相比其差异均具有统计学意义(P<0.05)(图 3A);GST酶活性在 24 h [(99.36±5.21) U·mg-1]与对照组相比其差异具有统计学意义(P<0.05)(图3B)。
2.2.2 Cu2+胁迫下,河蚬GST mRNA表达及酶活性变化
经Cu2+胁迫后,河蚬GST mRNA表达水平和酶活性均随着时间延长逐渐增强,到达峰值后又逐渐减弱,胁迫组GST mRNA表达量在12 h约为对照组的2倍,且与对照组相比其差异具有统计学意义(P<0.05)(图4A)。胁迫组GST酶活性在24 h[(104.04±8.21) U·mg-1] 和 48 h [(123.58±6.13)U·mg-1]与对照组相比其差异均具有统计学意义(P<0.05)。(图 4B)。
2.2.3 Pd2+胁迫下,河蚬GST mRNA表达及酶活性变化
经Pd2+胁迫后,河蚬GST mRNA表达水平和酶活性均随着时间延长逐渐增强,到达峰值后又逐渐减弱,胁迫组GST mRNA表达量在24 h和48h约分别为对照组的2倍和3倍,且与对照组相比其差异均具有统计学意义(P<0.05)(图5A)。胁迫组GST 酶活性在 48 h [(50.79±4.13) U·mg-1]与对照组相比差异具有统计学意义(P<0.05)(图5B)。

图4 肝胰腺GST mRNA表达水平(A)和活性变化(B)Fig.4 Changes of GST mRNA expression (A) and activity in hepatopancreas (B)
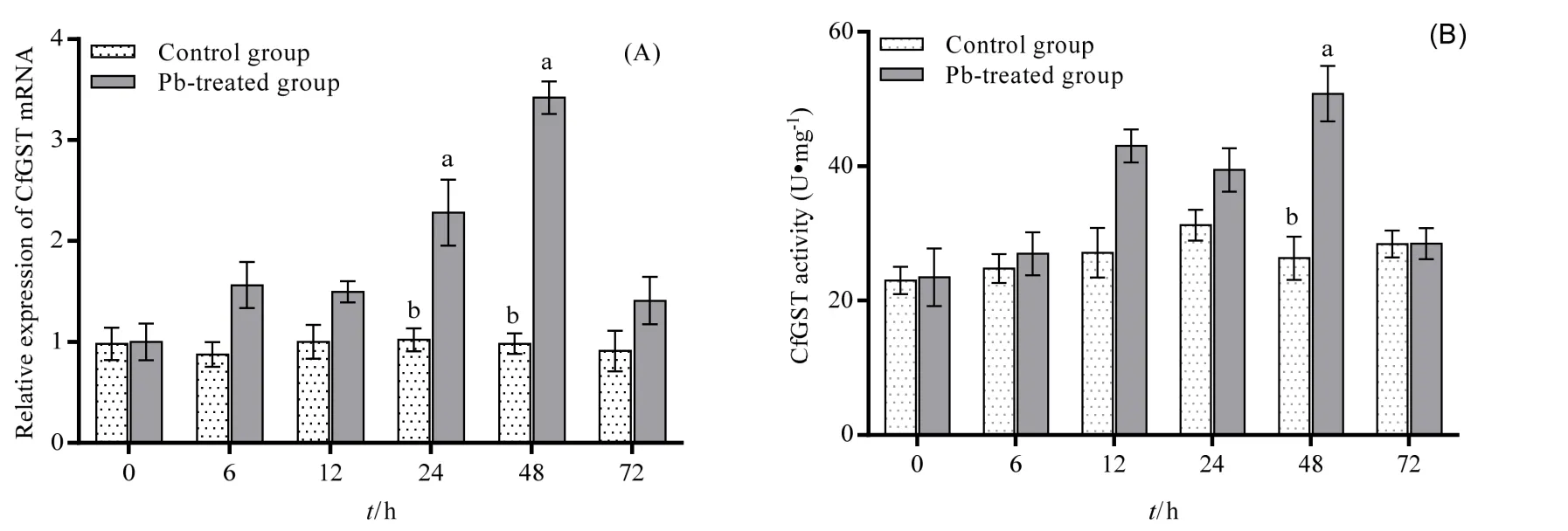
图5 肝胰腺GST mRNA表达水平(A)和活性变化(B)Fig. 5 Changes of GST mRNA expression (A) and activity in hepatopancreas (B)
3 讨论
3.1 河蚬GST序列分析与系统进化分析
本研究采用RACE方法克隆获得了河蚬GST完整序列,经生物信息学分析表明基因全长952 bp,编码217个氨基酸,分子量为25.169 kD,氨基酸序列中含有GST基因家族特的有两个保守性不同结构域(Sheehan et al.,2001):具有保守的N末端结构域(GST-N)含有谷胱甘肽(GSH)结合位点;具有不保守的C末端结构域(GST-C)可以结合不同底物(左伟东等,2007)。SignalP 4.1程序分析表明该GST蛋白不存在信号肽,TMHMM 软件分析表明该蛋白不存在跨膜结构。系统进化树分析表明,河蚬GST与菲律宾帘蛤亲缘关系最近,进一步说明本研究克隆得到的GST基因属于河蚬GST基因,为后续研究该基因结构和功能奠定基础。
3.2 重金属胁迫下河蚬GST mRNA的表达分析与酶活性变化
对GST mRNA相对定量表达和酶活性进行分析,发现河蚬在 Cd2+、Cu2+、Pb2+单一胁迫下均可使GST mRNA表达升高、酶活性增强,且表现为时间依赖型,随着时间延长内脏中GST mRNA表达和酶活性逐渐增强,表明谷胱甘肽硫转移酶对环境胁迫尤为敏感,其活性可被氧化应激所诱导而做出积极的应答反应,这与胡影等(2016)的研究结果是一致的,说明污染物处理时间是诱导GST活动的重要因素,产生这种现象可能是因为生物体在遇到外界环境有毒物质时,GST具有消除中间产物与体内自由基的双重功能,将体内潜在的毒性物质和亲电的疏水化合物变成亲水化合物,使之降解排出体外(聂湘平等,2008)。随着暴露时间的延长,GST mRNA和活性达到峰值后逐渐下降,可能与河蚬对环境的适应,体内自由基被清除和酶活性逐渐丧失有关。然而,3种金属离子胁迫的表达特征略有不同,即表达峰值出现的时间点差异:在 Cd2+胁迫下,GST mRNA表达和酶活性峰值均出现在24 h;在Cu2+胁迫下,GST mRNA表达峰值出现在12 h,酶活性峰值出现在48 h;在Pb2+胁迫下,GST mRNA表达和酶活性峰值均出现在48 h,以上表达特征差异可能是因为 GST对不同的重金属的解毒能力的存在差异。
以往利用 Cu2+和 Cd2+胁迫厚壳贻贝(Mytilus coruscus)能使其内脏中GST基因表达升高,到达峰值后又逐渐下降,且表现为时间依赖型(刘慧慧等,2014)。利用污染物对贝类产生刺激时,也发现贝类体内的GST酶活性显著升高,从而保护自身细胞免受外界胁迫环境损伤(Blanchette et al.,2002)。另外,有研究发现胁迫栉孔扇贝(Chlamys farreri)可以诱导其 GSTPi表达且具有一定时间剂量效应(苗晶晶,2010),已有研究表明底泥浸出液对GSTD基因的mRNA转录水平表达也显示出先诱导后抑制作用(蒋玫等,2013),以上研究结果均与本实验结果类似。GST mRNA转录水平和酶活性的提高意味着体内相应蛋白表达水平提高,间接证明了 GST的诱导是生物体对化学物质胁迫的适应性反应。鉴于此敏感反应,GST能够作为环境污染指示分子(Lenartova et al.,2000),可直观反映水体环境的污染状况。
以河蚬作为环境监测的指示生物,第一,因为河蚬是淡水水域系统底栖动物的重要组成部分,分布广,生活周期长,对环境变化敏感;第二,当水体受到污染时,最先接触污染物的是活动能力差的贝类品种,由于其不具有回避能力,暴露在污染物中的时间长,有害物质易发生富集,进而影响其正常的生理代谢。因此,通过对河蚬体内GST mRNA和酶活性进行实时监测,可加强对水体中重金属污染程度的监测。
4 结论
本研究通过克隆获得河蚬GST mRNA完整序列,由进化树分析得知河蚬GST与菲律宾帘蛤亲缘关系最近。河蚬体内GST mRNA表达量和酶活性对水体中 Cd2+、Cu2+、Pb2+高度敏感且均随迫时间的延长呈先增强后减弱趋势,说明河蚬内脏中GST可以作为水体环境重金属污染的监测指示分子。

