颈动脉内膜剥脱术中患者呼气末二氧化碳分压对局部脑氧饱和度的影响
高小慧 刘伟亮
研究表明,颈动脉粥样硬化性狭窄是导致缺血性脑血管疾病发作的最重要原因[1]。目前,临床主要采用颈动脉内膜斑块剥脱术(carotid endarterectomy,CEA)进行治疗,可有效增加脑血流,改善脑缺氧,防治缺血性脑血管疾病的发生和发展,明显降低病死率和致残率[2]。但该治疗方法可导致继发性卒中以及认知障碍等神经系统并发症发生,相关研究表明,上述风险可能是由于术中阻断颈动脉后,术侧脑循环血流失代偿所致[3]。因此在进行CEA过程中,严密监测脑组织血流学变化就显得尤为重要。
目前,临床多采用局部脑氧饱和度(rScO2)来评价脑组织血流变化,相关研究表明,通过控制脑氧饱和度变化,可有效减少神经外科手术术后相关危险因素发生[4]。所以在神经外科手术的麻醉管理中,连续有效的进行rScO2监测非常重要。然而,在实际临床手术中,许多因素可干扰rScO2监测,截至目前,关于呼气末二氧化碳分压(PETCO2)与rScO2的相关性研究报道较少。本研究就行CEA患者术中 PETCO2对 rScO2的影响进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月至2018年5月于潍坊市人民医院择期行单侧CEA的60例患者作为研究对象,采用随机数字表法分为A、B、C三组,各20例。本研究已通过潍坊市人民医院伦理委员会审核,制订并校订最终版试验方案、知情同意书、研究者手册以及临床试验观察表(CRF)。
1.1.1 纳入标准 美国麻醉医师协会(ASA)分级Ⅱ或Ⅲ级;年龄45~75岁,性别不限;经颅多普勒彩超提示一侧颈动脉狭窄(有症状患者狭窄>70%;无症状患者狭窄>80%);有自主行为能力,且自愿签署了知情同意书。
1.1.2 排除标准 长期应用镇静类药物或抗抑郁类药物;全身性消耗性疾病;严重心律失常;心肌梗死、心力衰竭;脑血管疾病急性期;严重呼吸系统疾病。
1.2 方法
1.2.1 术前准备 入室后建立静脉通路;注射咪达唑仑注射液1 mg,于局部麻醉下行桡动脉穿刺置管;使用迈瑞T8监护仪监测患者平均动脉压(MAP)、心率(HR)、心电图(ECG)、动脉血氧饱和度(SaO2)、PETCO2,使用 EGOS-600近红外组织血氧参数无创检测仪监测rScO2。
1.2.2 术中血流动力学维持 术前准备血管活性药品(阿托品、尼卡地平、麻黄碱、去甲肾上腺素等)。术中若发生以下情况时:收缩压(SBP)下降>入室前的20%;SBP升高>入室前的20%;HR<50次/min;HR>100次/min;可应用血管活性药物,以维持血流动力学稳定,维持SBP为100~140 mmHg(1 mmHg=0.133 kPa),舒张压(DRP)为60~70 mmHg。
1.2.3 麻醉过程
1.2.3.1 麻醉诱导 静脉留置管中依次注入咪达唑仑注射液0.01~0.05 mg/kg、依托咪酯0.1~0.3 mg/kg、顺苯磺酸阿曲库铵0.1~0.2 mg/kg、枸橼酸舒芬太尼0.4~0.6 μg/kg,待患者肌肉完全松弛后进行气管插管。插管成功后连接麻醉机完成机械通气,通过调整氧流量、潮气量、吸呼比等呼吸参数,3组PETCO2值设定为A组(PETCO2值为25~30 mmHg)、B组(PETCO2值为35~40 mmHg)、C组(PETCO2值为45~50 mmHg)。
1.2.3.2 麻醉维持 持续泵入丙泊酚2~6 mg/(kg·h)、瑞芬太尼 0.1~0.3 μg/(kg·min),直至手术结束。
1.3 观察指标
1.3.1 术中一般情况 比较 3组患者术中使用血管活性药物次数及麻黄碱、尼卡地平、去甲肾上腺素、丙泊酚、瑞芬太尼使用量与液体入量、苏醒时间、拔管时间。
1.3.2 MAP、HR、SaO2记录患者颈动脉阻断前5 min(T0)、阻断即刻(T1)、颈动脉阻断后 5 min(T2)、颈动脉阻断后 10 min(T3)、颈动脉阻断后15 min(T4)时的 MAP、HR、SaO2。
1.3.3 动静脉血氧含量差(Da-jvO2)、脑氧摄取率(CERO2)及rScO2记录患者各时间段的rScO2及血气分析结果。根据血气分析结果动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)、SaO2数值计算颈内静脉血氧分压(PjvO2)和血氧饱和度(SjvO2)数值。根据 Fick公式计算 Da-jvO2和CERO2。
CaO2=Hb×1.36×SaO2+0.0031×PaO2
CjvO2=Hb×1.36×SjvO2+0.0031×PjvO2
Da-jvO2=CaO2-CjvO2
CERO2=(CaO2-CjvO2)/CaO2×100%
1.4 统计学分析
2 结果
2.1 术前患者一般资料
3组患者年龄、性别构成、ASA分级、心电图异常率比较差异均无统计学意义(均P>0.05)。见表1。
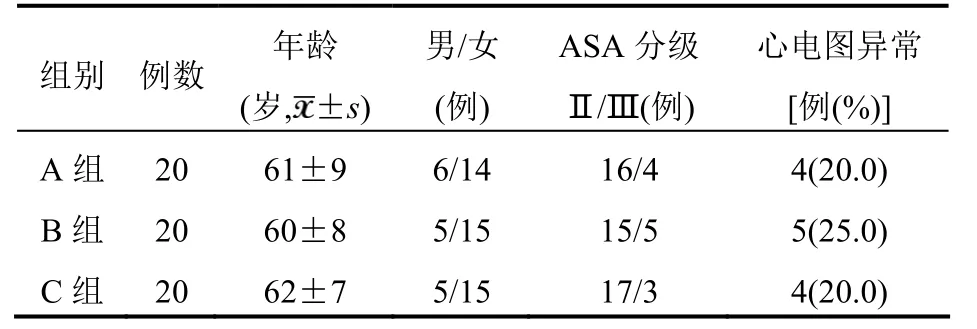
表1 3组患者术前一般资料比较
2.2 术中患者一般情况
3组患者术中使用血管活性药物次数及麻黄碱、尼卡地平、去甲肾上腺素、丙泊酚、瑞芬太尼使用剂量与液体入量、苏醒时间、拔管时间比较,差异均无统计学意义(均P>0.05)。见表2。
2.3 不同时点SaO2、MAP、HR比较
3组患者不同时点的SaO2、HR、MAP比较,差异均无统计学意义(均P>0.05)。见表3。
2.4 不同点Da-jvO2和CERO2比较
与 T0时刻比较,3组患者 T1~4时刻的 Da-jvO2和CERO2数值均明显低于T0时刻,差异均有统计学意义(均P<0.05);T1时,3组患者的 Da-jvO2和CERO2数值比较差异均无统计学意义(均P>0.05);T2~4时,B组、C组患者的Da-jvO2和CERO2数值均明显高于A组,差异均有统计学意义(均P<0.05);T3、T4时,C组患者的 Da-jvO2和 CERO2数值均明显高于B组,差异均有统计学意义(均P<0.05)。见表4。
表2 3组患者术中一般情况比较(±s)
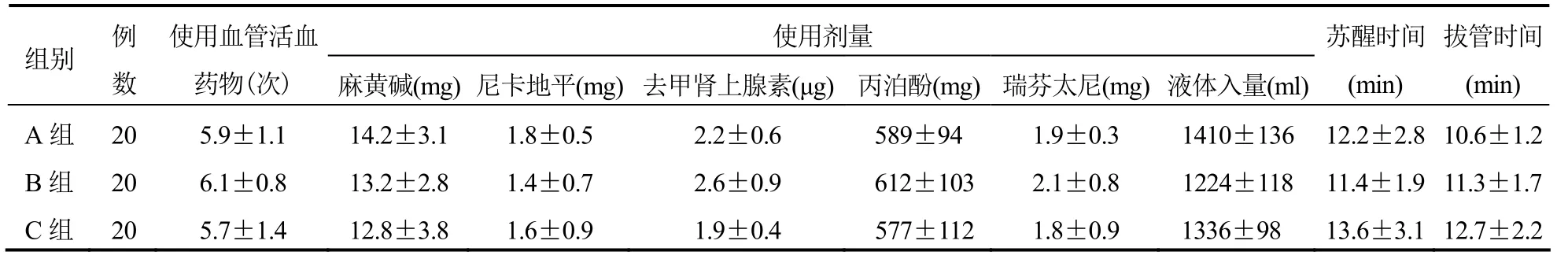
表2 3组患者术中一般情况比较(±s)
使用剂量组别 例数使用血管活血药物(次) 麻黄碱(mg)尼卡地平(mg)去甲肾上腺素(μg)丙泊酚(mg)瑞芬太尼(mg)液体入量(ml)苏醒时间(min)拔管时间(min)A 组 20 5.9±1.1 14.2±3.1 1.8±0.5 2.2±0.6 589±94 1.9±0.3 1410±136 12.2±2.8 10.6±1.2 B 组 20 6.1±0.8 13.2±2.8 1.4±0.7 2.6±0.9 612±103 2.1±0.8 1224±118 11.4±1.9 11.3±1.7 C 组 20 5.7±1.4 12.8±3.8 1.6±0.9 1.9±0.4 577±112 1.8±0.9 1336±98 13.6±3.1 12.7±2.2
2.5 术中3组患者rScO2测定结果
3组患者T1~4时刻术侧rScO2数值均明显低于非术侧,差异均有统计学意义(均P<0.05);3组患者T1~4时刻术侧 rScO2数值均明显低于 T0时刻,差异均有统计学意义(均P<0.05);T1时刻,3组患者术侧rScO2数值比较差异无统计学意义(P>0.05);T2~4时刻,B组、C组患者术侧rScO2数值均明显高于A 组,差异均有统计学意义(均P<0.05);T3~4时刻,C组患者术侧rScO2数值均明显高于B组,差异均有统计学意义(均P<0.05)。见表5。
3 讨论
在预防和治疗因颈动脉硬化性狭窄所导致的缺血性脑血管病中,与单纯性溶栓、抗凝等药物治疗相比较,CEA能够快速改善症状,防止病情进展[5]。但该术式要求术中暂时性夹闭颈动脉切开段,而脑组织供血的主要来源由椎基底动脉系统提供,其可导致术侧脑组织供血中断,诱发脑组织继发性损伤。
3.1 监测rScO2的实用性
目前临床多采用rScO2来评价脑组织血流变化,该方法主要依靠近红外光谱学技术,可以准确反映颅部局部测定目标区域内脱氧血红蛋白和氧合血红蛋白的各自浓度以及相关比例[6]。其具有无创伤、易连续、高灵敏等优势,可以即时评估脑血管的供血状态和损伤程度。
表3 3组患者不同时点SaO2、MAP、HR比较(±s)
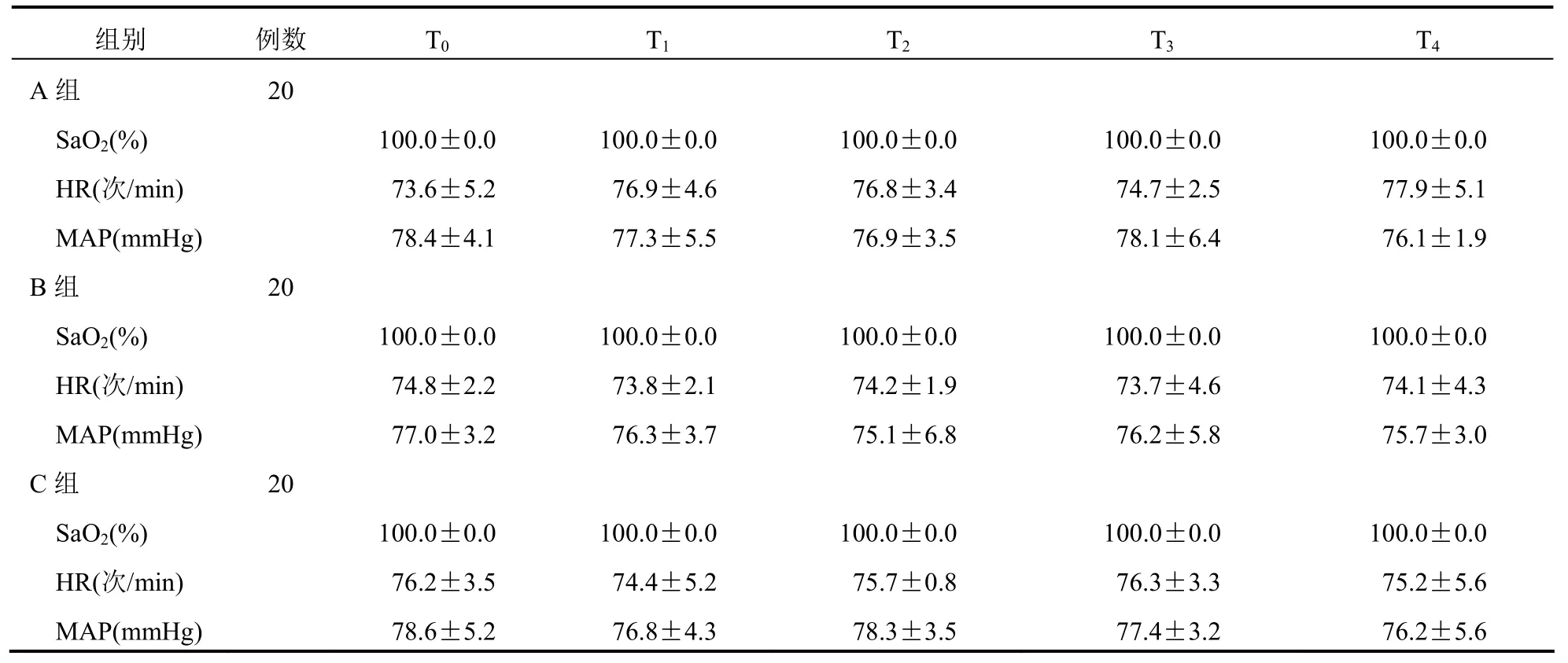
表3 3组患者不同时点SaO2、MAP、HR比较(±s)
组别 例数 T0 T1 T2 T3 T4 A组 20 SaO2(%) 100.0±0.0 100.0±0.0 100.0±0.0 100.0±0.0 100.0±0.0 HR(次/min) 73.6±5.2 76.9±4.6 76.8±3.4 74.7±2.5 77.9±5.1 MAP(mmHg) 78.4±4.1 77.3±5.5 76.9±3.5 78.1±6.4 76.1±1.9 B组 20 SaO2(%) 100.0±0.0 100.0±0.0 100.0±0.0 100.0±0.0 100.0±0.0 HR(次/min) 74.8±2.2 73.8±2.1 74.2±1.9 73.7±4.6 74.1±4.3 MAP(mmHg) 77.0±3.2 76.3±3.7 75.1±6.8 76.2±5.8 75.7±3.0 C组 20 SaO2(%) 100.0±0.0 100.0±0.0 100.0±0.0 100.0±0.0 100.0±0.0 HR(次/min) 76.2±3.5 74.4±5.2 75.7±0.8 76.3±3.3 75.2±5.6 MAP(mmHg) 78.6±5.2 76.8±4.3 78.3±3.5 77.4±3.2 76.2±5.6
表4 3组患者不同时点Da-jvO2和CERO2比较(±s)

表4 3组患者不同时点Da-jvO2和CERO2比较(±s)
注:与T0时刻比较,aP<0.05;与A组同时点比较,bP<0.05;与B组同时点比较,cP<0.05
组别 例数 T0 T1 T2 T3 T4 A组 20 Da-jvO2 52.3±6.6 46.3±5.2a 43.2±3.7a 40.3±3.5a 39.4±6.2a CERO2 37.4±6.1 34.4±4.3a 30.2±4.1a 28.3±4.7a 26.2±2.9a B组 20 Da-jvO2 50.4±7.1 48.2±3.1a 46.3±4.4ab 44.3±5.1ab 42.6±4.1ab CERO2 36.2±4.4 34.2±3.7a 33.4±3.8ab 30.2±3.1ab 30.1±3.2ab C组 20 Da-jvO2 51.7±4.8 48.3±3.7a 46.2±3.2ab 45.4±2.8abc 45.6±3.2abc CERO2 37.2±5.9 34.8±4.3a 34.2±3.2ab 33.6±5.7abc 32.9±3.8abc
表5 术中3组患者rScO2变化(±s)
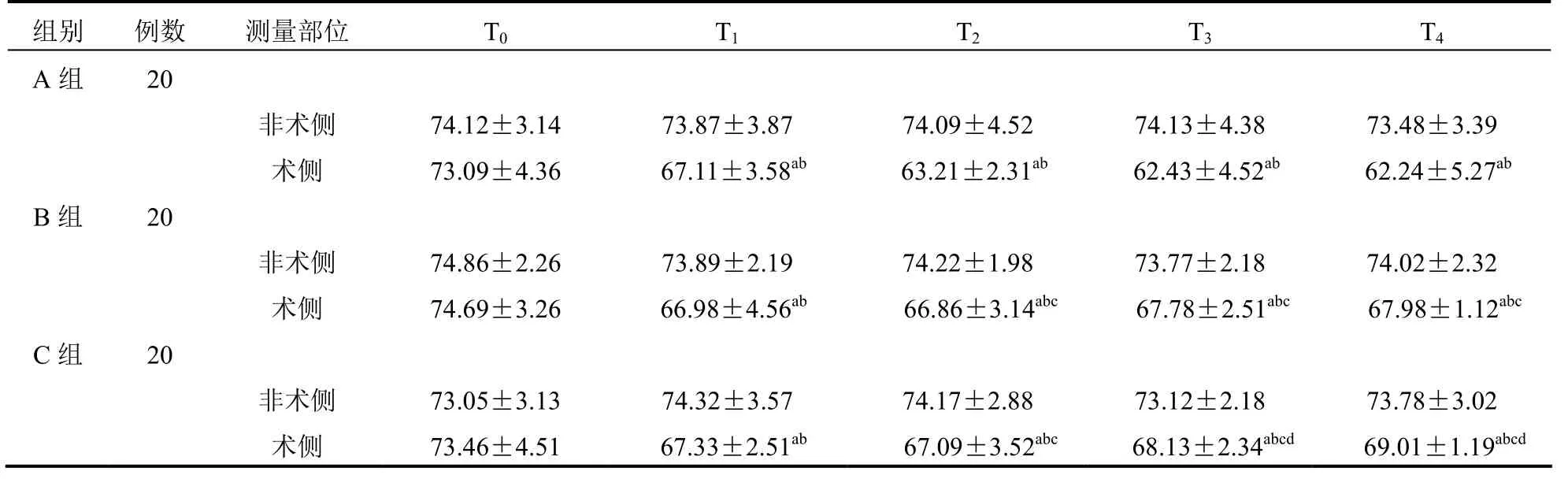
表5 术中3组患者rScO2变化(±s)
注:与非术侧比较,aP<0.05;与T0时刻同组术侧比较,bP<0.05;与A组同时点比较,cP<0.05;与B组同时点比较,dP<0.05
组别 例数 测量部位 T0 T1 T2 T3 T4 A组 20非术侧 74.12±3.14 73.87±3.87 74.09±4.52 74.13±4.38 73.48±3.39术侧 73.09±4.36 67.11±3.58ab 63.21±2.31ab 62.43±4.52ab 62.24±5.27ab B组 20非术侧 74.86±2.26 73.89±2.19 74.22±1.98 73.77±2.18 74.02±2.32术侧 74.69±3.26 66.98±4.56ab 66.86±3.14abc 67.78±2.51abc 67.98±1.12abc C组 20非术侧 73.05±3.13 74.32±3.57 74.17±2.88 73.12±2.18 73.78±3.02术侧 73.46±4.51 67.33±2.51ab 67.09±3.52abc 68.13±2.34abcd 69.01±1.19abcd
3.2 监测PETCO2的意义
目前在外科麻醉手术的监测过程中,PETCO2作为一种新型的高敏无创监测手段已广泛应用于临床,其不仅可及时反映受术者的通气状态,同时也能精确描述受术者的循环状态,是一种具有较高价值和较高灵敏性的报警系统,具有重要的应用价值和研究意义。
3.3 PETCO2与rScO2的相关性
本研究也采用监测PETCO2来判断颅内血管内皮细胞内二氧化碳的真实含量,通过调控不同组别的PETCO2数值,用以观察脑血容量变化。本研究中,特别是在T3、T4时间段,A组患者因PETCO2偏低,致使二氧化碳浓度较低,颅内血管收缩增加,脑血流量减少,同时因低碳酸状态,血pH值相对性增高,氧气与血红蛋白的结合度急剧升高,氧解离曲线发生变化,以至脑组织的脑氧利用度降低。B组与 C组患者因PETCO2调整后,致使二氧化碳浓度相对性增高,颅内血管扩张增加,脑血流量增大,血pH值相对性减少,氧解离曲线右移,氧气与血红蛋白的结合度降低,脑组织的氧气利用度增加,脑氧的供需平衡得以维持,有效保证了脑氧饱和度。为保证监测结果的准确性,本研究另外通过计算Da-jvO2、CERO2来反映整个脑组织血流和氧代谢的变化,由于术中直接采集脑部的血液来测量脑氧摄取率风险太高,根据Fick原理,Da-jvO2值可以即时地反映一定量血液中机体交换用的含氧量。同时CERO2作为脑神经细胞从动脉血氧含量中摄取氧的百分比,在临床监测上可对脑灌注压与颅压内进行实时监测,在一定程度上反映患者脑循环的状态[7],所以通过计算二者的数值能较好地反映脑氧供需平衡情况变化。通过研究发现其与呼气末二氧化碳分压相关性的分析结果基本与rScO2结果一致。
综上所述,rScO2与 PETCO2变化成正相关,在CEA过程中,将PETCO2适当调整后,使二氧化碳浓度维持在35~50 mmHg时,可以使颅内血管扩张增加,脑血流量增大,从而出现血pH值相对性减少,氧解离曲线右移,氧气与血红蛋白的结合度降低,脑组织的氧气利用度增加,脑氧的供需平衡得到有效维持。

