水稻镉安全材料分蘖期根部镉积累分布特征
李 芹,张 曼,张锡洲,余海英,李廷轩
(四川农业大学资源学院,四川成都 611130)
近年来,工业生产、污水灌溉、过度施肥等人类活动导致农田Cd污染日益严重[1]。水稻是我国主要的粮食作物之一,对土壤中Cd具有较强的吸收积累能力,稻田Cd污染可通过食物链影响人体健康。因此,降低籽粒Cd含量可减少人体通过饮食摄入Cd的风险,培育籽粒Cd安全品种是保障粮食安全的有效措施[2]。水稻籽粒中Cd的积累主要受其根部向地上部转移的影响[3],该过程主要发生于水稻分蘖期[4],不同积累型间存在明显差异,Cd低积累水稻对Cd的转移能力较低[5]。植物体内的Cd大多与各种物质结合以复合物的形式存在,其移动性因化学形态不同而有所差异。根部Cd以醋酸、盐酸提取态等移动性较弱的形态为主,有利于减少作物地上部Cd的积累[6]。水稻地上部对Cd的积累不仅与根部Cd的主要化学形态有关,化学形态的分配比例也是决定植株内Cd转移难易程度的重要因素[7]。此外,由于细胞壁和液泡的区隔化作用,植物根对Cd的滞留可限制Cd通过木质部向地上部运输[8],区隔化的部位可能因Cd胁迫程度、作物种类、植株积累特性等不同而有所差异。Cd低积累水稻通过液泡的区隔化作用限制Cd向地上部的转移[9],而另有研究发现水稻根部Cd主要分布于细胞壁中,且细胞壁Cd的分配比例随Cd浓度升高而增加[10]。细胞壁对Cd的固持是水稻适应Cd胁迫的关键,Cd低积累型植物细胞壁对Cd的固持能力强于Cd高积累型[11]。细胞壁中果胶、半纤维素等多糖含有大量带负电荷的官能团可与Cd结合,细胞壁对Cd的滞留作用受多糖含量的制约[12]。因此,研究水稻根部Cd的化学形态和细胞壁对Cd的固持机理有利于探明其根部Cd的移动性,对揭示不同水稻材料Cd向地上部转移能力差异的原因具有重要意义。前期土培[13]和大田试验[14]中,水稻Cd安全材料D62B糙米Cd含量低于食品安全国家标准 (GB2762-2017) 限量 (0.2 mg/kg),其根部对Cd的滞留率较高是籽粒Cd安全的重要原因之一[15],然而Cd在根部的分布如何以及植株通过何种方式降低Cd在根部的移动性还缺乏深入探讨。本试验通过分析分蘖期水稻Cd安全材料D62B根部Cd的化学形态和亚细胞分布,结合细胞壁多糖对Cd的响应特征明确根部对Cd的滞留作用机理,以期揭示其籽粒Cd安全的原因,为Cd安全品种的培育提供理论依据。
1 材料和方法
1.1 供试材料
前期通过土培试验[13]及大田试验[14]筛选获得的水稻Cd安全材料D62B (糙米Cd含量低于0.2 mg/kg)和普通材料Luhui17。两类水稻亲本材料均为籼稻,生育期基本一致,为 (150 ± 5) d,均由四川农业大学农学院提供。
1.2 试验设计与处理
试验设4个Cd浓度处理:0 (CK)、0.5 (Cd0.5)、1.0 (Cd1)、2.0 (Cd2) mg/L,每个处理重复3次,完全随机排列。水稻种子经10%的H2O2消毒30 min,再用0.1%的NaClO浸种1 d后播于已消毒的石英砂盘中,在恒温恒湿箱 (温度35℃、湿度60%) 中催芽,期间用去离子水浇灌以保持一定湿度。出苗后用1/4浓度的营养液浇灌培养,三叶一心时选择长势一致的秧苗移栽至盆 (40 cm × 60 cm × 15 cm) 中,每盆18孔,每孔1株,用完全营养液预培养一周,以CdCl2·2.5H2O (分析纯) 添加在完全营养液中进行不同浓度Cd处理。营养液采用菲律宾国际水稻所 (IRRI)推荐的营养液配方[16],每5天更换一次营养液,培养期间用0.1 mol/L的HCl或NaOH调节营养液的pH到5.5左右,采用自然光照,并补充适量去离子水。
1.3 样品采集与制备
于分蘖期 (Cd处理30天) 采样,以6株为一个混合样,每盆3个混合样为1次重复,每处理采集3个重复。样品经水冲洗后,将根部浸泡于20 mmol/L Na2-EDTA溶液中15min,用去离子水润洗后吸水纸擦干,将其分为根和地上部。一部分于105℃下杀青30 min后75℃下烘干至恒重,粉碎用于植株Cd含量的测定;另一部分经液氮固定后保存于-70℃超低温冰箱中,用于Cd化学形态和亚细胞分布的测定。
1.4 测定项目与方法
植株Cd含量测定采用HNO3-HClO4(5∶1,V/V)消化,经原子吸收分光光度计 (AAS,PinAAcle 900T,PerkinElmer,USA) 测定。
Cd化学形态参照Su等[17]采用化学试剂逐步提取法。称取根系鲜样按照以下顺序经研磨、浸提、离心后获得上清液:1) 采用80%乙醇提取硝酸盐/亚硝酸盐、氯化物为主的无机盐和氨基酸盐;2) 采用去离子水提取水溶性Cd、Cd-有机酸复合物和Cd(H2PO4)2;3) 采用1 mol/L NaCl溶液提取果胶酸盐和Cd-蛋白质复合物;4) 采用2% HAc溶液提取CdHPO4、Cd3(PO4)2等难溶性磷酸盐;5) 采用0.6 mg/L HCl溶液提取草酸盐,并收集沉淀测定残渣态Cd。各级提取液及5)中残渣经HNO3-HClO4(5∶1,V/V) 消化后测定Cd含量,并分别计算各形态Cd的分配比例。
Cd亚细胞分布测定参照Wang等[18]的方法略作调整,采用差速离心法分离根部亚细胞组分。称取根系鲜样于0.25 mol/L蔗糖、50 mmol/L Tris-HCl(pH 7.5)、1.0 mmol/L C4H10O2S2(二硫赤藓糖醇) 组成的提取液中研磨后于4000 r/min离心15 min,沉淀为细胞壁部分,取上清液继续在16000 r/min离心30 min,离心后获得的上清液为可溶部分,主要包括细胞质及液泡内无机离子、高分子和大分子有机物质,底部碎片为细胞器部分。可溶部分过0.22 μm滤膜后直接上机测定,细胞壁、细胞器在70℃下烘干至恒重后经HNO3-HClO4(5∶1,V/V) 消化后测定Cd含量,并分别计算各组分Cd的分配比例。
细胞壁果胶、半纤维素Cd含量测定采用细胞粉碎、去除细胞内物质的方法[19-20]提取细胞壁,再逐步分类提取细胞壁组分。称取根鲜样于液氮中研磨成粉末,用75%乙醇冰浴20 min后于8000 r/min离心10 min,去除上清液后再经丙酮、甲醇-氯仿 (1∶1)、甲醇分别冰浴20 min,离心后剩下的颗粒即粗细胞壁。冷冻干燥后称取细胞壁粉末用沸水提取3次离心获得上清液为果胶,沉淀经4% (W/V) KOH和0.02% (W/V) KBH4提取12h,提取两次后离心获得上清液为半纤维素1。分别取果胶、半纤维素1提取液经HNO3-HClO4(5∶1,V/V) 消化后测定Cd含量。
果胶糖醛酸含量测定参照Zhu等[12]的方法略作调整。以半乳糖醛酸为标准物质,采用硫酸-间羟基联苯法测定果胶糖醛酸含量。取果胶提取液0.2 mL,加入1 mL含12.5 mmol/L四硼酸钠的浓硫酸沸水浴5 min,冰浴冷却至室温后加入0.02 mL 0.15%间羟基联苯溶液,混匀后静置20 min于520 nm比色测定。
半纤维素1总糖含量测定参照Zhu等[12]的方法略作调整。以葡萄糖为标准物质,采用硫酸-苯酚法测定半纤维素1总糖含量。取半纤维素1提取液0.2 mL,加入0.01 mL 80%苯酚溶液,混匀后冰浴中加入1 mL浓硫酸混匀后静置15 min,沸水浴15 min,冷却至室温后于490 nm比色测定。
1.5 数据处理
转移系数 = 地上部Cd含量/根部Cd含量[21]。
采用DPS 11.0进行统计分析,LSD法进行多重比较 (P< 0.05);Origin 9.0和Excel 2013进行图表制作。
2 结果与分析
2.1 Cd处理对水稻Cd安全材料各部位Cd含量和转移系数的影响
由表1可知,两类水稻材料各部位Cd含量随Cd处理浓度升高而显著增加;根部Cd含量高于地上部Cd含量,转移系数较小,Cd向地上部转移能力较弱。Cd处理下D62B各部位Cd含量显著低于Luhui17,其转移系数小于Luhui17。Cd2处理下D62B根、地上部Cd含量较Cd0.5处理分别增加32.9%、84.5%,而Luhui17分别增加50.7%、102.4%,D62B各部位Cd含量增幅较小。Cd0.5处理下D62B根部Cd含量与Luhui17差异不显著,而地上部Cd含量显著低于Luhui17,D62B根部Cd向地上部转移弱于Luhui17。
2.2 Cd处理对水稻Cd安全材料根部Cd化学形态的影响
由表2可知,Cd处理下两类水稻材料根部Cd以6种化学形态存在,主要为氯化钠提取态,约占总化学形态的55%,其余各形态分布特征为水提取态 > 乙醇提取态 > 醋酸提取态 > 残渣态 > 盐酸提取态。随Cd处理浓度升高,两类水稻材料根部不同形态Cd含量显著增加,D62B根部各形态Cd含量显著低于Luhui17。随Cd处理浓度升高,Cd2处理下D62B根部乙醇提取态、水提取态、氯化钠提取态、醋酸提取态、盐酸提取态、残渣态Cd含量较Cd0.5处理分别增加104%、37.7%、33.3%、18.3%、75.0%、85.2%,Luhui17分别增加90.6%、46.1%、19.6%、45.5%、100%、56.2%。Cd处理促进两类水稻材料根部乙醇、盐酸提取态Cd、残渣态Cd形成,Cd的移动性和活性减弱。D62B根部乙醇提取态Cd、氯化钠提取态Cd、残渣态Cd增幅高于Luhui17,其根部Cd更多转化为移动性较弱的形态。
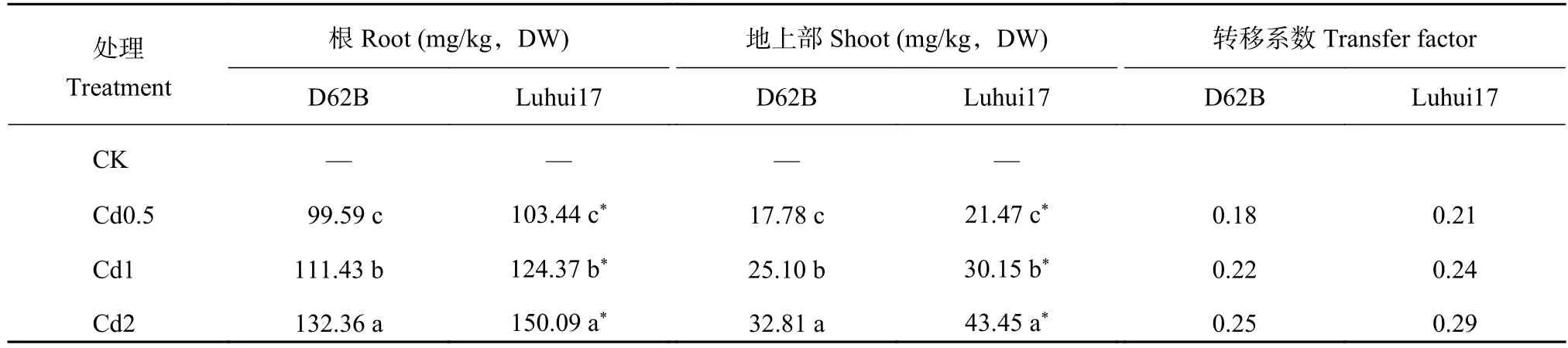
表 1 Cd处理对两类水稻材料各部位Cd含量和转移系数的影响Table 1 Effect of Cd treatments on Cd content in different parts and transfer factor of two rice lines
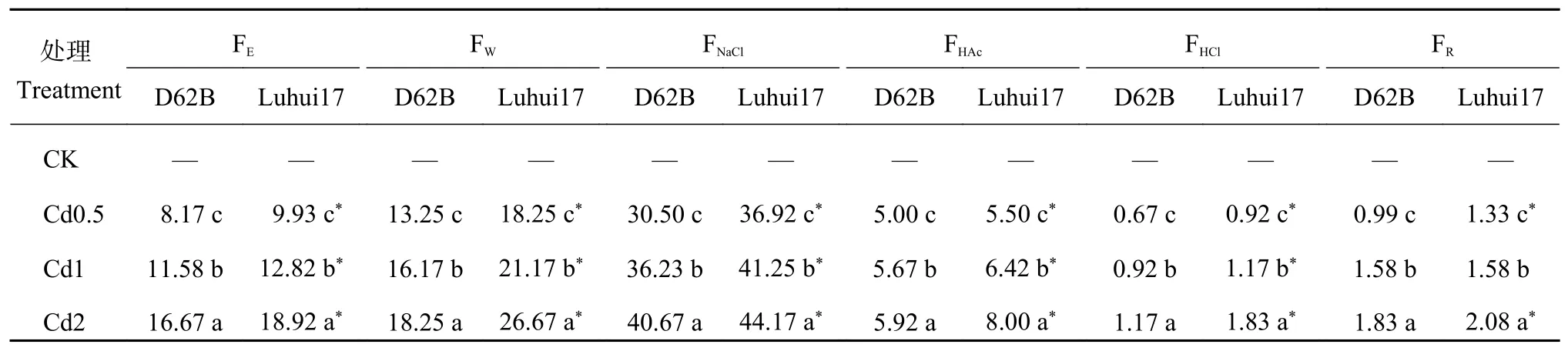
表 2 Cd处理下两类水稻材料根部Cd化学形态分布 (mg/kg,FW)Table 2 Cd distribution of chemical forms in roots of two rice lines treated with Cd
由表3可知,Cd处理下两类水稻材料根部氯化钠提取态Cd分配比例最高,盐酸提取态Cd最低,Cd的分配比例总体表现为氯化钠提取态 > 水提取态 >乙醇提取态 > 醋酸提取态 > 残渣态 > 盐酸提取态。随Cd处理浓度升高,两类水稻材料根部乙醇提取态Cd、残渣态Cd分配比例升高,氯化钠、盐酸提取态Cd分配比例降低。Cd处理下两类水稻材料根部水、醋酸提取态Cd分配比例变化趋势不同,D62B根部水、醋酸提取态Cd分配比例随Cd处理浓度升高而降低,Luhui17则随Cd处理浓度升高而增加,Luhui17根部Cd移动性增大。Cd处理下D62B根部乙醇、氯化钠提取态Cd分配比例高于Luhui17,水、盐酸提取态Cd分配比例低于Luhui17,D62B根部Cd移动性较弱。Cd处理下两类水稻材料根部醋酸提取态、残渣态Cd分配比例因Cd处理浓度而不同,Cd0.5处理下D62B根部醋酸提取态Cd分配比例高于Luhui17,残渣态Cd低于Luhui17,Cd1处理下其根部醋酸提取态、残渣态Cd分配比例均高于Luhui17,Cd2处理下D62B根部醋酸提取态Cd分配比例低于Luhui17,残渣态Cd高于Luhui17,高Cd浓度处理下D62B根部Cd的移动性较弱。
2.3 Cd处理下水稻Cd安全材料根部Cd的亚细胞分布特征
由表4可知,Cd处理下两类水稻材料根细胞可溶部分 (除细胞器外的原生质体部分,包括胞液和液泡) Cd含量最高,其次为细胞壁,细胞器Cd含量最低。随Cd处理浓度升高,两类水稻材料根部亚细胞Cd含量显著增加,D62B根部各亚细胞Cd含量低于Luhui17。Cd0.5处理下,D62B根细胞可溶部分Cd含量显著低于Luhui17,细胞壁、细胞器Cd含量与Luhui17差异不显著,Luhui17根部Cd易向细胞可溶部分转移。Cd1、Cd2处理下,D62B各亚细胞组分Cd含量显著低于Luhui17。Cd2处理下D62B和Luhui17根细胞可溶部分Cd含量较Cd0.5处理分别增加66.5%和106.0%,细胞壁Cd含量分别增加59.6%和70.7%,细胞器Cd含量分别增加110.0%和107.1%,细胞器增幅最大,随Cd处理浓度升高,Cd跨膜进入细胞原生质增多。D62B根细胞可溶部分Cd含量增幅明显低于Luhui17,其根部Cd向细胞可溶部分中转移较少。
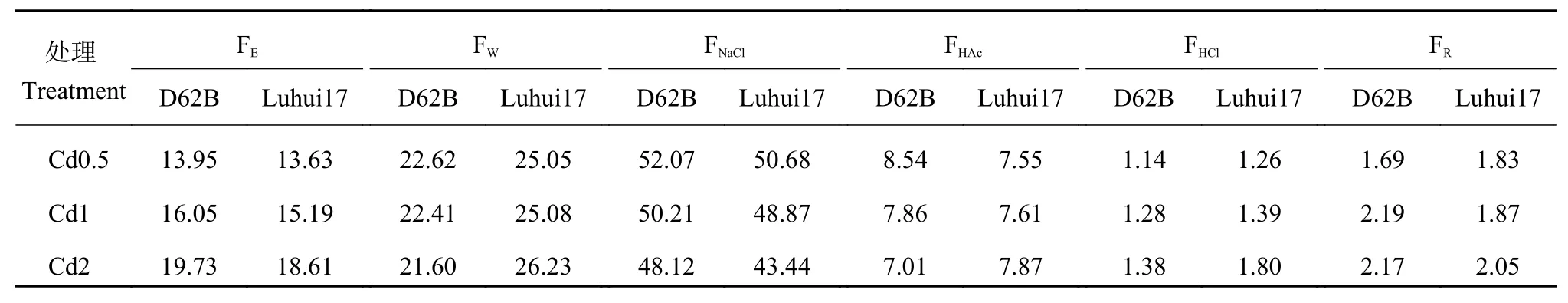
表 3 Cd处理下两类水稻材料根部Cd化学形态分配比例 (%)Table 3 Proportion of Cd chemical forms in roots of two rice lines treated with Cd

表 4 Cd处理下两类水稻材料根部Cd的亚细胞分布特征 (mg/kg, FW)Table 4 Subcellular distribution of Cd in roots of two rice lines treated with Cd
由图1可知,Cd处理下两类水稻材料根细胞可溶部分Cd分配比例最高,其次为细胞壁,细胞器Cd分配比例最低。随Cd处理浓度升高,两类水稻材料根细胞可溶部分和细胞器Cd分配比例升高,而细胞壁降低,细胞壁对Cd的结合能力有限,高浓度Cd处理下Cd跨膜进入细胞原生质中。Cd处理下D62B根细胞可溶部分、细胞器Cd分配比例低于Luhui17,细胞壁Cd分配比例高于Luhui17,其细胞壁对Cd的结合能力较强,其细胞内生理活性较高的区域Cd积累较少。随Cd处理浓度升高,D62B根细胞壁Cd分配比例降幅小于Luhui17,而可溶部分Cd分配比例增幅小于Luhui17,D62B细胞壁对Cd的固持能力较强,进入细胞原生质体的Cd少于Luhui17。
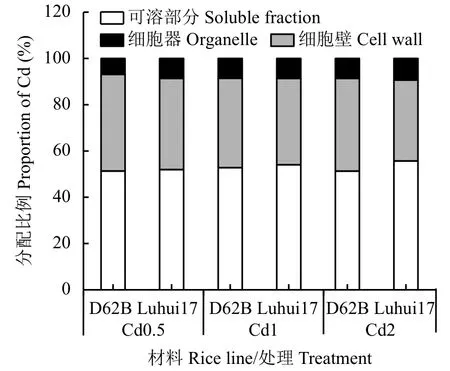
图 1 Cd处理下两类水稻材料根部Cd的亚细胞分配比例Fig. 1 Proportion of subcellular distribution of Cd in roots of two rice lines treated with Cd
2.4 Cd处理对水稻Cd安全材料根细胞壁组分及其Cd含量的影响
2.4.1 Cd处理对水稻Cd安全材料根细胞壁果胶糖醛酸及其Cd含量的影响 由图2可知,随Cd处理浓度升高,两类水稻材料根细胞壁果胶糖醛酸含量及其Cd含量呈逐渐增加的趋势,且D62B根细胞壁果胶Cd含量显著低于Luhui17。Cd0.5处理下水稻根细胞壁果胶糖醛酸含量与CK差异不显著,而Cd1、Cd2处理下显著增加,中高浓度Cd处理促进根细胞壁果胶的合成。随Cd处理浓度升高,Cd1处理下D62B和Luhui17根细胞壁果胶糖醛酸含量分别增加27.4%、35.4%,Cd2处理下D62B和Luhui17根细胞壁果胶糖醛酸含量分别增加42.4%、93.5%,D62B根细胞壁中合成果胶糖醛酸少于Luhui17。随Cd处理浓度升高,两类水稻材料根细胞壁果胶Cd含量显著增加,结合图2A,除Cd2处理外,两类水稻材料根细胞壁果胶糖醛酸含量差异不显著,而D62B果胶Cd含量显著低于Luhui17,可见两类水稻材料单位果胶Cd结合量不同。Cd0.5、Cd1、Cd2处理下D62B根细胞壁果胶分别可结合0.069、0.082、0.109 mg Cd/mg糖醛酸,而Luhui17分别结合0.085、0.102、0.101 mg Cd/mg糖醛酸。随Cd处理浓度升高,两类水稻材料根细胞壁果胶对Cd的结合增加,Cd0.5、Cd1处理下D62B果胶对Cd结合较少。Cd2处理下Luhui17单位果胶糖醛酸Cd结合总量不再增加,D62B果胶对Cd结合增加明显。低、中浓度Cd处理下两类水稻材料根细胞壁果胶对Cd的结合不饱和,高浓度处理下D62B根细胞壁果胶对Cd的结合能力强于Luhui17。
2.4.2 Cd处理对水稻Cd安全材料根细胞壁半纤维素1总糖及其Cd含量的影响 由图3可知,随Cd处理浓度升高,两类水稻材料根细胞壁半纤维素1总糖含量及其Cd含量呈逐渐增加的趋势。Cd处理下两类水稻材料根细胞壁半纤维素1总糖含量及其Cd含量远高于果胶糖醛酸含量 (图2A) 及其Cd含量(图2B),可知细胞壁中Cd主要与半纤维素1结合。相较于CK处理,Cd0.5处理下两类水稻材料根细胞壁半纤维素1总糖含量差异不显著,而Cd1、Cd2处理下显著增加,中、高浓度Cd处理促进根细胞壁半纤维素1的合成。Cd处理下两类水稻材料根细胞壁半纤维素1总糖含量差异不显著,随Cd处理浓度升高,Cd1处理下D62B和Luhui17根细胞壁半纤维素1总糖含量分别增加50.0%、29.0%,Cd2处理下分别增加57.8%、35.4%,D62B根细胞壁中合成半纤维素1总糖多于Luhui17。随Cd处理浓度升高,D62B半纤维素1Cd含量显著增加,Cd0.5处理下Luhui17半纤维素1Cd含量显著低于Cd1处理,而Cd1、Cd2处理下差异不显著。结合图3A,Cd0.5、Cd1、Cd2处理下D62B根细胞壁半纤维素1分别可结合0.068、0.073、0.096 mg Cd/mg总糖,而Luhui17分别结合0.078、0.111、0.124 mg Cd/mg总糖。随Cd处理浓度升高,两类水稻材料根细胞壁半纤维素1对Cd的结合增加,Cd2处理下D62B、Luhui17单位半纤维素1Cd结合量较Cd1处理分别增加32.6%、11.2%。不同浓度Cd处理下两类水稻材料根细胞壁半纤维素1对Cd的结合均未饱和,高浓度Cd处理下D62B半纤维素1对Cd的结合增幅较大。Cd2处理下两类水稻材料半纤维素1Cd含量差异不显著,而D62B根细胞壁Cd含量显著低于Luhui17 (表4),高浓度Cd处理下D62B半纤维素1对细胞壁中Cd结合相对比例较高。
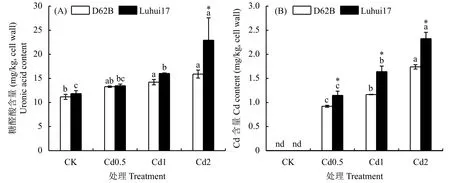
图 2 Cd处理下两类水稻材料根细胞壁果胶糖醛酸和Cd含量的变化Fig. 2 Uronic acid and Cd content in pectin of roots cell wall of two rice lines treated with Cd
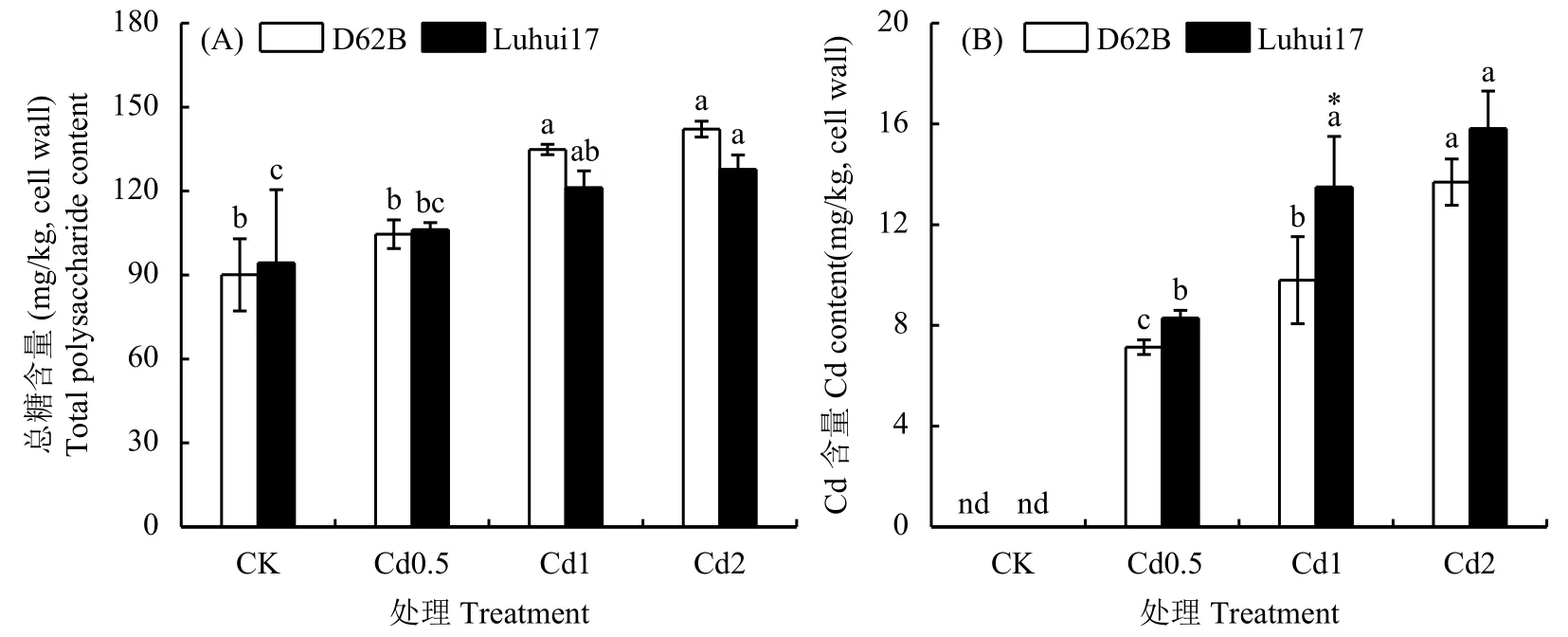
图 3 Cd处理下两类水稻材料根细胞壁半纤维素1总糖和Cd含量的变化Fig. 3 Total polysaccharide and Cd content in hemicellulose1 of roots cell wall of two rice lines treated with Cd
3 讨论
3.1 Cd处理下水稻根部Cd的亚细胞分布特征
水稻地上部Cd的积累主要受根向地上部Cd转移能力的影响[22],其移动难易程度与根部Cd的亚细胞分布有关[23]。本研究中两类水稻材料根细胞可溶部分 (胞质和液泡) Cd含量最高,与Li等[24]和Shi等[25]研究结果一致,而水稻No.6 huaidao[1]和Zhonghua11[26]根部Cd主要分布于细胞壁中,这是由于在不同的研究中栽培介质、培养时间、Cd处理浓度等栽培条件均有较大差异,并且不同水稻材料自身生长特性不同,根部Cd亚细胞分布特征呈现明显的材料间差异[9]。本研究中可溶部分包括胞质和液泡,液泡占细胞原生质容积的大部分且具有较高的Cd积累潜力,因此较多的Cd分布于可溶部分可能与液泡的区隔化作用有关[27]。且由于细胞壁中可与Cd结合的多糖官能团、蛋白质数目的限制,高浓度Cd处理下细胞壁对Cd的结合作用有限[28]。Cd处理下水稻Cd安全材料D62B根部亚细胞Cd含量显著低于Luhui17,但细胞壁Cd的分配比例高于Luhui17,其细胞壁对Cd的结合能力强于普通材料,与Yu等[29]和Zhang等[30]研究结果一致。细胞壁中含有多种官能团可与Cd发生离子交换、吸附、络合、沉淀等反应,有利于减少Cd的移动,因此细胞壁对Cd的结合能力不同是导致不同积累型作物Cd转移差异的重要原因[31]。Cd低积累辣椒[32]根细胞壁Cd分配比例较高,而Cd耐性萝卜 (低积累) 根细胞壁Cd分配比例低于敏感性品种[33],Cd低积累型豆瓣菜根细胞壁Cd分配比例仅在高浓度Cd处理下高于Cd高积累型[28],由此可见细胞壁对根部Cd固持作用的贡献不仅与作物种类有关,还受Cd胁迫程度的影响。随Cd处理浓度升高,Cd高积累小白菜细胞壁Cd分配比例降低,而Cd低积累小白菜仅可溶部分降低[34],本研究中两类水稻材料根细胞壁Cd分配比例降低,D62B降幅小于Luhui17,可知细胞壁在Cd低积累材料适应高Cd胁迫中发挥重要作用,但可能对Cd的结合能力有限。
3.2 Cd处理下果胶对水稻根细胞壁Cd固持作用的贡献
果胶分布于细胞壁胞间层,主要成分是部分甲酯化的α-1,4-D-聚半乳糖醛酸,含有丰富的羧基、羟基等官能团,可提供带有负电荷的Cd结合位点。Cd处理下两类水稻根细胞壁果胶的糖醛酸含量、Cd含量显著增加,可知果胶的合成有利于增强根细胞壁对Cd的固持。Cd主要与果胶中的羧基结合[35],果胶对Cd的结合能力取决于羧基的数目。果胶的甲酯化程度越低,自由羧基数目越高,Cd处理下番茄细胞壁果胶组成发生改变,其甲酯化程度明显降低[36],进而增加自由羧基数目以促进果胶对Cd的结合。大量研究表明,Cd处理下植物根系果胶甲酯酶 (PME)活性增加[37-39],可促进果胶去甲酯化,增加自由羧基数目。随Cd处理浓度升高,两类水稻材料根细胞壁单位果胶糖醛酸Cd结合量增加,可能与甲酯酶活性增加有关,水稻降低果胶酯化度有利于增加果胶对Cd的结合。Cd0.5、Cd1处理下D62B单位果胶糖醛酸Cd结合量低于Luhui17,可能低浓度下D62B根细胞壁果胶的酯化度较高,还有待深入研究。果胶中羧基仅部分以电离状态存在,可与金属离子发生离子交换作用[40],且由于Ca2+的竞争吸附[41],因此较低浓度Cd处理下D62B根细胞壁果胶的官能团未完全与Cd结合。高浓度Cd处理下D62B根细胞壁单位果胶Cd结合量增加,而Luhui17几乎不变,可能由于D62B果胶的Cd固持容量较大。果胶和半纤维素的合成增多是水稻细胞壁对Cd的固持作用增强的主要原因[42],而随Cd处理浓度升高D62B根细胞壁果胶糖醛酸含量增幅小于Luhui17,其半纤维素1总糖含量增幅较大,可见两类水稻材料根细胞壁组分发育特征存在差异,可能D62B果胶对Cd结合能力较强,而普通材料由于果胶的Cd结合能力有限,在高Cd浓度下通过促进果胶的合成以增加根细胞壁对Cd的固持。
3.3 Cd处理下半纤维素1对水稻根细胞壁Cd固持作用的贡献
果胶是一组聚半乳糖醛酸,而半纤维素是几种不同类型单糖构成的异质多聚体,其结合能力可能由于组成和性质的差异而不同。拟南芥根细胞壁中Cd主要与半纤维素结合[43],水稻细胞壁半纤维素和果胶可分别结合总Cd的56%、23%[44],本研究中两类水稻材料根细胞壁半纤维素1的Cd含量是果胶的6.80~8.40倍,可知半纤维素1是水稻根细胞壁中主要的Cd结合位点。随Cd处理浓度升高,两类水稻材料根细胞壁半纤维素1单位总糖Cd结合量增加,可能是由于半纤维素1的Cd结合容量较大,随Cd处理浓度升高,Cd结合不断增加,在本研究中高浓度Cd处理下依然未饱和。不同浓度Cd处理下,D62B根细胞壁半纤维素1单位总糖对Cd的结合较少,这是由于D62B细胞壁Cd含量显著低于Luhui17,细胞壁对Cd的固持总量较小。拟南芥根细胞壁半纤维素1对Cd的结合增强原因在于半纤维素组成糖类 (葡萄糖、木糖) 合成增多[12],本研究中随Cd处理浓度升高,D62B根细胞壁半纤维素1总糖含量增幅明显大于Luhui17,Cd处理下D62B根细胞壁合成半纤维素1增多,有利于增加其细胞壁对Cd的结合。Cd2处理下两类水稻材料半纤维素1总糖含量较Cd1处理增幅相同,而D62B和Luhui17半纤维素1Cd含量分别增加39.8%和17.2%,可知高Cd浓度处理下D62B根细胞壁半纤维素1对Cd的结合增多。Cd耐性水稻根细胞壁半纤维素Cd分配比例较大[45],其半纤维素较强的Cd结合能力促进了细胞壁对Cd的固持,对降低Cd向籽粒转移有关键作用。本研究结果与之一致,Cd2处理下两类水稻材料半纤维素1Cd含量差异不显著,而D62B根细胞壁Cd含量显著低于Lhui17,高浓度Cd处理下D62B半纤维素1对Cd的结合相对比例较高,其对Cd的结合能力较强。
4 结论
D62B根和地上部Cd含量显著低于Luhui17,其根部Cd向地上部转移较少。D62B根部Cd主要为氯化钠提取态,随Cd处理浓度升高水提取态Cd分配比例降低,盐酸提取态Cd和残渣态Cd分配比例升高。D62B根细胞壁中Cd主要与半纤维素1结合,其结合能力强于Luhui17,其细胞壁Cd固持能力较强。因此,D62B根部Cd向移动性较弱的化学形态转化,且其细胞壁半纤维素1对Cd的固持作用较强,是水稻Cd安全材料减少Cd向籽粒运输的重要原因之一。

