不同加入方式下金霉素对猪场污水厌氧消化系统的影响
曹俊超,王小庆,马保华,邹永德,廖新俤,庞燕玲,吴银宝,2*
(1.华南农业大学动物科学学院,广州 510642;2.华南农业大学农业部华南热带农业环境重点实验室,广州 510642;3.南海出入境检验检疫局,广东 佛山 528200)
近年来随着规模化、集约化畜禽养殖业的迅猛发展,兽用抗生素用量显著增长。2015年我国发布了首份抗生素使用量和排放量清单,清单显示从2007年到2013年我国抗生素使用量也呈逐年增长的趋势,在2013年使用量达16.2万t,使用量是英国和美国的近160倍和9倍[1]。兽用抗生素进入畜禽体后,除残留在畜禽机体组织和产品中外,有40%~90%会以原形和体内代谢产物形式随畜禽粪尿排出体外[2-4],经不同途径对土壤和水体造成污染。值得注意的是,兽用抗生素经畜禽吸收后,随排泄物进入环境的除了兽用抗生素原形,还包括其活性代谢产物。Andrzej等[5]研究发现,金霉素在pH为2~6时可转化为4-差向异构金霉素(4-epi-CTC),并且在猪肾中检测到金霉素及4-epi-CTC的残留。王小庆等[6]的研究表明,在猪饲料中加入75 mg·kg-1的金霉素,7 d用药期内猪粪中金霉素及代谢产物4-epi-CTC平均浓度分别为239.92 µg·g-1和217.79 µg·g-1。由于兽用抗生素活性代谢产物在结构和功能上与其原形有一定的共性,因此不可忽视其进入环境后的生态毒理学效应。
厌氧发酵是畜禽粪污处理与利用的重要技术之一,但兽用抗生素及其活性代谢产物会随畜禽粪污进入厌氧发酵系统,对厌氧消化系统产生影响。目前,已有一些学者关注并研究了四环素类、大环内酯类和磺胺类等兽用抗生素残留对厌氧消化系统的影响。如Huang等[7]研究表明,采用直接添加法在常温厌氧消化系统中加入混有0.55 mg·g-1金霉素的猪粪时,与对照组相比,7 d的加药期内系统产甲烷量被显著抑制了15%,但该研究并未检测并确认金霉素活性代谢产物4-epi-CTC对厌氧消化系统功能的影响,也未检测系统中产甲烷菌多样性,不能很好地解释所得结果。Wang等[8]研究表明,在厌氧消化系统中加入经饲料添加并经猪体代谢后含12 mg·g-1泰乐菌素A的猪粪时,与对照组相比对系统产甲烷量的抑制率达35.52%,而且显著高于直接添加法组对系统产甲烷量的抑制率12.98%,其原因与经猪体代谢后,猪粪中不仅含有泰乐菌素A,而且含有高浓度的体内代谢产物泰乐菌素D相关。所以研究兽用抗生素对厌氧消化系统的影响时,不应忽视其活性代谢产物的影响。
由此,本文选用目前在养猪业中普遍使用的金霉素(Chlortetracycline,CTC)为研究对象,通过测定金霉素原形及其主要活性代谢产物4-epi-CTC在厌氧消化系统中的浓度、系统产甲烷量、沼液pH值以及产甲烷菌多样性等参数,研究采用直接添加法和经体内代谢法金霉素对猪场污水厌氧消化系统的影响,阐明两种方法所得结果的差异性。本文可为兽用抗生素在养殖业的合理使用、兽用抗生素对厌氧消化系统的影响及其生态毒理学效应的准确评价提供参考。
1 材料与方法
1.1 试验材料
金霉素:金霉素原料药购自华南农业大学华天兽药厂,金霉素标准品购自中国标准物质网。
猪粪:随机选取30头33 kg左右的成年二元杂母猪,预饲2周,期间日粮中不添加任何兽药,临床无异常后开始猪粪收集试验。猪粪收集试验分空白组和试验组,空白组日粮中不添加任何兽药,试验组日粮中CTC的添加量为75 g·t-1饲料,用药期7 d。分别收集空白组和试验组的猪粪,检测CTC和4-epi-CTC浓度后用于厌氧消化试验。
0.01 mol·L-1Na2EDTA的Mcl-Vaine液:准确称取28.4 g Na2HPO4,用超纯水溶解定容于1000 mL容量瓶中,简称A液;准确称取柠檬酸21.00 g,用超纯水溶解定容于1000 mL容量瓶中,简称B液;取625 mL溶液A与1000 mL溶液B混匀,调节pH至4.0±0.5,简称C液;准确称取60.5 g Na2EDTA溶解于C液中,即成0.01 mol·L-1Na2EDTA的Mcl-Vaine液。
1.2 试验装置及主要仪器
模型厌氧消化系统:如图1所示,该系统为有效容积1300 mL的定做的三口玻璃烧瓶[9],3个出口均采用橡胶塞封严,顶部橡胶塞钻出输气孔与吸收瓶相连,侧边出口分别用于取发酵液样和加入新鲜猪粪样。吸收瓶和集液瓶采用500 mL广口瓶,吸收瓶用橡胶塞封口。吸收瓶橡胶塞上钻孔连接玻璃和橡胶管路,用于导出厌氧发酵所产生的的气体及吸收瓶中的液体。
图1 厌氧发酵装置Figure 1 Anaerobic digestion device
主要仪器:包括高效液相色谱仪(Waters 600 Controller,Waters 717 plus Autosampler,Waters 2487 Dual λ Absorbance Detector),固相萃取仪,凝胶成像系统,PCR仪,基因突变检测仪(DGGE)等。
1.3 试验设计
厌氧消化试验设4个试验组和1个空白对照组,每组3个重复。试验组依据2种CTC加入方式和2种CTC加入浓度分为4种处理,2种加入方式分别为体内代谢组(即在饲料中添加CTC后所获含CTC和4-epi-CTC残留的猪粪)和直接添加组(即在空白猪粪中加入相应浓度的CTC),2种CTC加入浓度分别为310.54 mg·kg-1干猪粪(高浓度)和160.05 mg·kg-1干猪粪(低浓度)。试验分组如表1所示。厌氧消化温度设定为30℃。

表1 厌氧消化试验分组Table 1 The design of anaerobic digition trial
1.4 检测指标
1.4.1 系统产甲烷量及沼液pH
采用排水法计算系统产甲烷量[10];以pH计测定沼液pH。
1.4.2 金霉素及4-差向异构金霉素浓度
取10 mL沼液沼渣混合物,加入10 mL 0.01 mol·L-1Na2EDTA的Mcl-Vaine液,漩涡混合30 s,超声10 min,4 ℃、13 000 r·min-1离心10 min,上清液倒入另一干净离心管中,沉淀中加入5 mL提取液,重复上述步骤再次提取,混合两次上清液,4 ℃、13 000 r·min-1离心5 min,取上清液过固相萃取小柱。固相萃取小柱先用1 mL甲醇激活,1 mL水平衡,然后将上清液过柱,使药物吸附在萃取小柱上,加水3 mL清洗小柱,顶空1 min,然用0.5 mL甲醇和0.5 mL 2%甲酸甲醇溶液洗脱。洗脱液用0.22µm滤膜过滤后,用于高效液相色谱仪检测。
CTC色谱条件:紫外检测器,检测波长355 nm;色谱柱采用Kromasil C18柱(250 mm×4.6 mm,5µm,100 Å);柱温40℃;进样量20µL;流动相,乙腈∶0.01 mol·L-1草酸=18∶82;流速 1.0 mL·min-1;检测限 0.01µg·mL-1;CTC回收率62.25%。在上述检测条件下,能将沼液沼渣中CTC与其他物质分开,其保留时间为17.377 min。
4-epi-CTC色谱条件:紫外检测器,检测波长365 nm;色谱柱采用Kromasil C18柱(250 mm×4.6 mm,5µm,100 Å);柱温40℃;进样量20µL;流动相,乙腈∶0.01 mol·L-1草酸=22∶78;流速1.0 mL·min-1;检测限0.01µg·mL-1;4-差向异构CTC回收率67%。在上述检测条件下,能将沼液沼渣中4-差向异构金霉素与其他物质分开,其保留时间为15.230 min。
1.4.3 产甲烷菌多样性
将20 mL沼液沼渣样品5000 r·min-1室温离心3 min,去上清液后取1 g沼渣,加入10 mL PBS(pH为7.2~7.4),漩涡,然后5000 r·min-1离心10 min,倒掉上清液;固体加1 mL TE buffer和5 mg·mL-1的溶解酶,漩涡,37 ℃水浴30 min,5000 r·min-1离心10 min,去掉上清液,固体采用OMEGA公司E.Z.N.A.TMSoil DNA Kit试剂盒提取细菌基因组DNA。
采用50µL PCR扩增反应体系对产甲烷菌16S rDNA可变区进行PCR扩增。扩增反应体系为:1µL模板,1 µL dNTP,10×PCR buffer 1 µL,0.5 µL Ex⁃TagDNA聚合酶,1µL上游引物,1µL下游引物,加ddH2O补足至50µL。PCR反应上下游引物分别为:A934F 5 "-AGG AAT TGG CGG GGG AGC A-3 "和1390R 5 "-ACG GGC GGT GTG TCA A-3 "[8],其中在引物1390R的5 "端加入33个GC夹(5 "-CGC CCG GGG CGC GCC CCG GGC GGG GGC GGG GGC ACG GGC GGT GTG TCA A-3 "),以增加产物的稳定和片段电泳分离度。梯度反应参数:94℃预变性3 min;94℃变性30 s;58℃退火30 s;72℃延伸45 s;38个循环,最后72℃延伸10 min。所得PCR产物用1.5%琼脂糖凝胶电泳鉴定。
采用变性梯度凝胶电泳(DGGE)检测样品中产甲烷菌多样性。首先配制变性剂范围为35%~60%的变性梯度凝胶,并放入充满预热至60℃的1×TAE电泳液的电泳槽内,然后将20µL PCR产物与4µL 6×loading buffer混合,用移液器加入点样孔中,最后以80 V电压,60℃电泳16 h。电泳完毕后,用去离子水漂洗凝胶2 min,加入350 mL固定液(10%乙醇,0.5%乙酸)中,静置15 min;倒掉固定液,去离子水漂洗2 min。漂洗完成后加入350 mL银染液(10%乙醇,0.5%乙酸,用之前加入0.2%AgNO3,0.1%甲醛),放置在摇床上避光摇动染色10 min;倒掉银染液,用去离子水漂洗两次,每次5~10 s,加入350 mL显色液(3%NaOH,0.1%甲醛)显色,待条带显示清楚停止显色;倒掉显色液,加入350 mL终止液(10%乙醇,0.5%乙酸)。将银染后的DGGE凝胶放置在白光投影仪上,用数码相机拍照保存图片。使用Phoretix 1D Pro(Totallb)软件分析DGGE图像,计算Shannon "s多样性参数H′。H′的计算公式为:

式中:s为每个泳道条带数;pi为每个条带强度占总条带强度的比例;H′值越大说明样品的多样性程度越高。
利用Phroetix-1D和Phroetix-1D pro软件对DG⁃GE电泳图谱进行相似性分析,得出戴斯系数(Dice coefficient,Cs),根据Cs得到各个泳道相似性系数矩阵图,用非加权组平均法(Unweighted pair group mean average,UPGMA)将相似性系数矩阵转化为聚类树状图,然后对聚类树状图进行分析[8]。聚类树状图中的Distance表示泳道间条带差异性,当Distance为0时表示差异性为0,泳道间的条带完全相同,当Distance为1时则相反,表示差异性为1,泳道间的条带完全不同。
1.5 数据分析
数据统计结果用平均数±标准误差(Mean±SE)表示,采用SPSS 13.0软件进行统计分析,多重比较采用邓肯极差检验法,显著水平P值设为0.05,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 金霉素及4-差向异构金霉素在厌氧消化系统中的浓度变化
CTC在厌氧消化系统中的浓度变化如图2a所示。由图可知,7 d的加药期内除空白组外,其他各试验组CTC浓度均逐步上升,表明每日加入到厌氧消化系统中的CTC不会被完全降解,而会逐渐累积。加药期结束时(8 d),除空白组未检出CTC外,第2~4试验组系统中CTC的浓度分别达到0.59±0.07、0.61±0.16、0.36±0.02、0.56±0.04 mg·kg-1。进入停药期后,各试验组CTC浓度逐渐降低,在试验第15 d时,各试验组CTC浓度降至0.1 mg·kg-1左右,直至试验第25 d时系统中才检测不到CTC残留。
方差分析表明,在厌氧消化系统中添加CTC浓度为310.54 mg·kg-1的猪粪时,第二组(高浓度体内代谢组)在加药期内CTC平均浓度显著低于第三组(高浓度直接添加组)(P<0.05),但当CTC添加浓度为160.05 mg·kg-1时,第四组(低浓度体内代谢组)与第五组(低浓度直接添加组)在加药期内CTC平均浓度无显著差异(P>0.05)。由此表明,不同加入方式对厌氧消化系统中CTC浓度的影响与CTC的加入浓度有关,CTC加入浓度高时经体内代谢组CTC的消失速度快于直接添加组。
CTC在粪便中的主要代谢产物是4-差向异构金霉素(4-epi-CTC)[9],因此本文检测了各试验组厌氧消化系统中4-epi-CTC的浓度(图2b)。由图可知,除空白组外,随着含CTC猪粪的加入,在加药期各试验组厌氧消化系统中4-epi-CTC逐步累积。由于直接添加组所加猪粪中不含4-epi-CTC,但在系统中也能检测到4-epi-CTC,说明4-epi-CTC不但可以由畜禽体内代谢产生,而且也可在厌氧消化系统中产生。进入停药期后,各试验组4-epi-CTC浓度逐渐降低,直至试验第28 d系统中检测不到4-epi-CTC残留。
方差分析表明,在厌氧消化系统中添加CTC浓度为310.54 mg·kg-1的猪粪时,第二组(高浓度体内代谢组)在加药期内4-epi-CTC平均浓度显著高于第三组(高浓度直接添加组)(P<0.05),但当CTC添加浓度为160.05 mg·kg-1时,第四组(低浓度体内代谢组)与第五组(低浓度直接添加组)在加药期内4-epi-CTC平均浓度无显著差异(P>0.05)。其原因可能为在猪粪中CTC浓度为310.54 mg·kg-1时,与直接添加组相比,经体内代谢组系统中CTC的降解速度更快,由此导致4-epi-CTC的累积量更多。
2.2 金霉素对厌氧消化系统产甲烷量的影响
CTC对厌氧消化系统产甲烷量的影响如图3所示,对整个试验期不同试验组厌氧消化系统产甲烷量进行方差分析,结果显示各试验组厌氧消化系统产甲烷量与空白组相比无显著差异(P>0.05),表明28 d的试验期内,猪粪中残留的CTC未显著影响厌氧消化系统的产甲烷量。
方差分析表明,在厌氧消化系统中添加CTC浓度为310.54 mg·kg-1和160.05 mg·kg-1的猪粪时,直接添加组与相同CTC浓度的经体内代谢组相比,加药期内产甲烷量分别显著降低了4.40%、5.22%(P<0.05),而经体内代谢组与空白组无显著差异(P>0.05)。这可能是由于直接添加组厌氧消化系统中CTC浓度显著高于经体内代谢组,因此其对系统中微生物的抑制作用更强,从而使厌氧消化系统的产甲烷量显著降低。
2.3 金霉素对沼液pH的影响
由图4可知,各试验组pH变化趋势基本一致。在7 d的加药期内,各试验组沼液平均pH值分别为6.15±0.10、6.17±0.11、5.98±0.11、6.18±0.05、5.95±0.04。方差分析表明,采用直接添加组的沼液pH显著低于经体内代谢组和空白组(P<0.05),而经体内代谢组沼液pH变化与空白组相比无显著差异(P>0.05);同时对于同种研究方法(经体内代谢法和直接添加法),不同试验浓度间无显著差异(P>0.05)。由此说明,直接添加法会导致厌氧消化系统中pH显著降低,进而使系统产甲烷量显著低于其他试验组。
2.4 金霉素对厌氧消化系统中产甲烷菌多样性的影响
2.4.1 产甲烷菌16S rDNA可变区PCR扩增结果
对各试验组第0、4、8、28 d沼液沼渣混合样品提取微生物总DNA,并用产甲烷菌的通用引物进行PCR扩增,所得扩增产物的电泳图如图5所示。由图可知,所得PCR产物的分子量约为500 bp,片段大小与引物所能扩增的产物大小一致,且条带单一,可进行后续DGGE分析。

图2 金霉素与4-差向异构金霉素在厌氧消化系统中的浓度变化Figure 2 The concentration of chlortetracycline and 4-epi-CTC in anaerobic digestion system

图3 金霉素对厌氧消化系统产甲烷量的影响Figure 3 Effect of chlortetracycline on the methane volume of anaerobic digestion system

图4 金霉素对沼液pH的影响Figure 4 The effect of chlortetracycline on the pH value of anaerobic digestion system
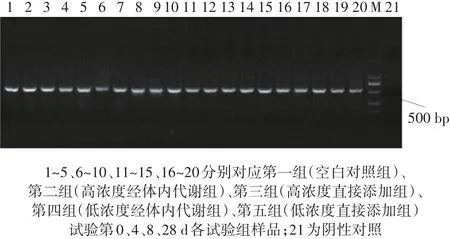
图5 样品产甲烷菌16S rDNA可变区PCR扩增产物电泳图Figure 5 Electrophoregram of PCR amplified products derived from methanogenic archaea 16S rDNA
2.4.2 产甲烷菌多样性的DGGE分析
CTC对厌氧消化系统产甲烷菌多样性指数H′的影响如表2所示,方差分析表明,在各时间段,两种研究方法未显著影响系统产甲烷菌多样性指数H′(P>0.05),且均与空白组无显著差异(P>0.05)。
对所获的DGGE图谱进行聚类分析,结果见图6。在试验开始时,各试验组产甲烷菌相似性水平为0.86。加药期第4 d,各试验组产甲烷菌相似性上升为0.90,但总条带数减少,因此在试验第4 d时各试验组产甲烷量较试验开始时略低。试验第8 d加药期结束时,各试验组产甲烷菌条带数增多,此时各试验组的产甲烷量比试验开始时也有所增加,不同初始浓度的体内代谢法组和直接添加组分别聚为一类,相似性为0.90和0.95,但所有试验组产甲烷菌相似性水平为0.82,说明不同CTC加入方法会影响厌氧消化系统中产甲烷菌群落多样性,使其相似性降低,这也可能是直接添加组产甲烷量显著低于其他试验组的原因之一。整个试验期结束时,各试验组产甲烷细菌相似性水平为0.90。
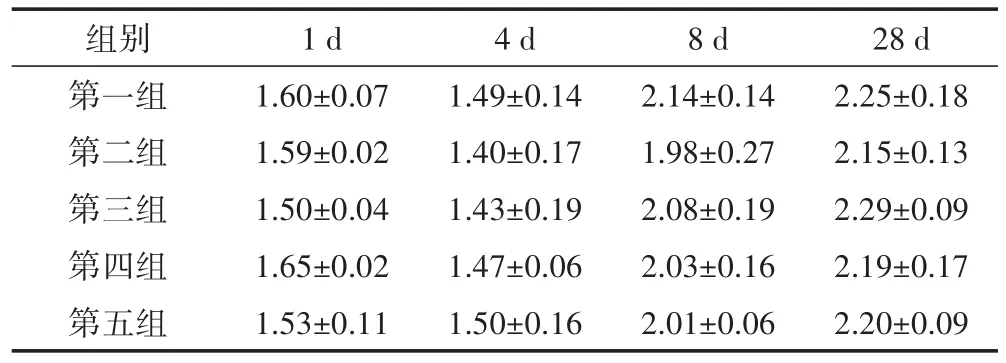
表2 金霉素厌氧消化产甲烷菌H′的变化Table 2 Effect of chlortetracycline on methanogenic archaea diversity index H′

图6 金霉素厌氧消化试验产甲烷菌相似性树状图Figure 6 Dendrogram of the similarity of methanogenic archaea in anaerobic digestion
3 讨论
3.1 金霉素在厌氧消化系统中的降解
环境中CTC的化学稳定性主要取决于光照、温度、基质理化性质和微生物学性质等[11]。本研究各试验组温度和基质一致,并且试验均在避光厌氧条件下进行,因此微生物降解可能是系统中CTC消失的主要途径。
本研究表明,连续7 d在厌氧消化系统中加入CTC,系统中CTC和其代谢产物4-epi-CTC逐步累积,而且直接添加组也检测到4-epi-CTC,说明在体外厌氧条件下,CTC也可降解为4-epi-CTC。停止加药后,添加过CTC的试验组直至试验第25 d系统中才检测不到CTC,而其主要代谢产物4-epi-CTC在试验第28 d才检测不出,说明4-epi-CTC在厌氧消化系统中停留时间比CTC原形还要长,而且在试验后期系统中CTC浓度逐步降低时4-epi-CTC仍处于较高浓度。Arikan等[12]的研究也表明,33 d的试验中厌氧消化系统内的CTC浓度从5.9 mg·L-1降低到1.4 mg·L-1,降低了76%;差向异构CTC浓度从4.1 mg·L-1降到2.5 mg·L-1,降低了39%,说明4-epi-CTC在系统中停留时间比母体还要长,并且母体浓度降低时4-epi-CTC浓度仍较高。差向异构化可使兽用抗生素的抗菌活性有所降低,如4-差向异构土霉素大约为土霉素原形抗菌活性的30%,但其毒性增强了1.87倍[13]。因此,不能忽视4-epi-CTC进入环境后的生态毒理学效应。
本研究还表明,在CTC添加浓度为310.54 mg·kg-1时,经体内代谢组厌氧消化系统中CTC的浓度显著低于直接添加组,而且系统中4-epi-CTC的浓度也显著高于直接添加组,其原因可能是采用经体内代谢法时,加入到厌氧系统中的猪粪微生物已经对CTC有一定的适应性,所以系统中CTC降解较快,其代谢产物4-epi-CTC的浓度也较高;而采用直接添加法时,空白猪粪和厌氧消化系统中微生物对CTC缺乏适应性,所以CTC降解缓慢,4-epi-CTC的浓度也较低。本结果与Huang等[7]所得结果相似,其研究发现在低温厌氧消化系统中,CTC加入浓度为0.55 mg·g-1时,经体内代谢组CTC浓度显著低于同浓度直接添加组。
值得注意的是,不同研究方法所得四环素类抗生素在厌氧消化系统中的降解速度不同。如本研究采用的是与生产实践相近的动态厌氧消化系统,结果发现直接添加法组直至试验第25 d厌氧消化系统中才检测不到CTC。Shi等[14]研究发现,采用静态厌氧发酵系统时四环素初期降解很快,但低浓度时会在系统内维持较长时间,直至第20 d检测不到沼液中四环素残留。童子林等[15]应用间歇试验研究了外源添加含CTC的猪粪时,CTC在中温(35℃)厌氧消化系统中的降解过程,结果表明,CTC的降解过程符合一级反应动力学方程,其半衰期为10 d,经过45 d的厌氧消化处理后,CTC降解率为97.7%~98.2%。
3.2 金霉素对厌氧消化系统产甲烷量的影响
兽用抗生素对厌氧消化系统产甲烷量的影响与兽用抗生素种类、研究方法、厌氧消化系统类型及运行条件等直接相关。
本文的研究结果表明,与空白对照组和经体内代谢组相比,直接添加组在加药期显著降低了厌氧消化系统产甲烷量。其原因与直接添加组厌氧消化系统中CTC降解慢,其残留浓度高于经体内代谢组有关。CTC残留浓度高会抑制系统中古细菌和嗜乙酸甲烷菌等的活性,使系统中VFA累积导致pH下降[16-17],在本研究中也出现相同的结果。采用直接添加法(即第三组和第五组)加药期厌氧发酵系统沼液pH降低;同时由于CTC具有广谱抗菌性,其浓度越高,对产甲烷菌的影响也越大,因此共同导致第三组(高浓度直接添加组)加药期厌氧发酵系统的产甲烷量被显著抑制。Huang等[7]研究发现,采用直接添加法在常温厌氧消化系统中加入混有0.55 mg·g-1金霉素的猪粪时,7 d的加药期内系统产甲烷量被显著抑制了15%。Fernandez等[18]也发现,直接加入浓度为 100~1000 mg·L-1的四环素对厌氧消化系统的产气量产生了抑制作用。这些研究所得结果类似,均表明直接在厌氧消化系统中加入四环素类兽用抗生素时,会影响系统产甲烷量,进而影响系统功能。
在厌氧消化过程中,产甲烷菌的数量、种群结构、活性直接影响厌氧发酵效率。由于兽用抗生素具有广谱抗菌性,因此进入厌氧消化系统的兽用抗生素就有可能影响产甲烷菌等厌氧微生物,进而影响厌氧消化系统的功能。本研究发现经体内代谢法和直接添加法这两种CTC加入方式未显著影响系统产甲烷菌多样性指数H′,但试验第8 d加药期结束时,经体内代谢组和直接添加组厌氧消化系统中产甲烷菌群落多样性的相似性降低,结合直接添加组产甲烷量显著减少的结果,说明直接添加法可能会通过影响产甲烷菌群落进而影响系统产甲烷量。Sanz等[16]发现,金霉素可以通过干扰蛋白质合成抑制产甲烷菌的活性,进而对厌氧消化过程产生很强的抑制作用。James等[17]发现,金霉素对甲烷产量的抑制率为27.8%,而且金霉素处理组中两种产甲烷毛菌和产甲烷八叠球菌的丰度比空白组少。Shimada等[19]研究表明,在泰乐菌素添加剂量为167 mg·L-1时,厌氧系统中产甲烷古菌物种的相对丰度明显减少,并认为该结果与系统中丙酸不断累积有关。由此可知,厌氧消化系统中存在兽用抗生素残留时,可能会通过影响产甲烷菌进而影响系统产甲烷量。
值得注意的是,本研究中直接在厌氧消化系统中加入混有CTC的猪粪时会显著降低系统6~15 d时的产甲烷量,但添加经猪体代谢后含CTC的猪粪未对厌氧消化系统产甲烷量产生显著影响。这也说明研究方法会影响兽用抗生素对厌氧消化系统的作用,应采用更接近养猪生产实践的经体内代谢法研究兽用抗生素对厌氧消化系统的生态毒理学效应。
4 结论
在厌氧消化系统中加入含金霉素浓度为310.54 mg·kg-1和160.05 mg·kg-1的猪粪时,与同浓度经体内代谢组相比,采用直接添加法的试验组显著抑制了系统产甲烷量,显著降低了沼液pH,产甲烷菌群落多样性的相似性降低,而且高浓度组厌氧消化系统中CTC残留浓度显著高于同浓度的经体内代谢组。
由于采用经体内代谢法和直接添加法研究金霉素对猪场污水厌氧消化系统影响的结果不同,而且经体内代谢法更接近养猪生产实践,因此应采用经体内代谢法研究兽用抗生素对厌氧消化系统的生态毒理学效应。

