慢病毒介导的FOXJ1过表达对胃腺癌细胞凋亡及线粒体膜电位的影响
张世甲,李 剑,韩广森
郑州大学附属肿瘤医院普外科 郑州 450008
胃癌是一种世界范围内的恶性肿瘤。胃腺癌是由胃腺体细胞恶性转化形成,发病机制涉及一系列基因的调控作用,这些基因可以影响细胞的多种生物学特性[1-2]。叉头框转录因子J1(forkhead box J1,FOXJ1)是FOX转录因子家族成员,参与纤毛形成、胚胎发育、自身免疫等过程。FOXJ1在不同肿瘤组织中的作用不同,其在肝癌中可能发挥促癌作用,而在乳腺癌、卵巢癌等肿瘤中可能发挥抑癌作用[3-6]。目前的研究[7-8]显示,FOXJ1在胃癌组织中表达减弱,上调其表达可以降低胃癌细胞转移潜能。本研究探讨了过表达FOXJ1对胃腺癌细胞凋亡的影响及可能机制。
1 材料与方法
1.1细胞和主要试剂FOXJ1过表达慢病毒(Lv-FOXJ1)和阴性对照慢病毒(Lv-NC)由赛业(苏州)生物科技有限公司构建;胃腺癌细胞SGC-7901购自美国ATCC;Frist Strand cDNA Synthesis购自美国Thermo Fisher公司;SYBR Premix Ex Taq试剂盒购自大连TaKaRa;引物由金斯瑞生物科技有限公司设计并合成;激活型Caspase-3(C-Caspase-3)抗体、细胞色素C(Cytochrome C,Cyt C)抗体、激活型Caspase-9(C-Caspase-9)抗体购自北京百奥莱博科技有限公司;JC-1法线粒体膜电位检测试剂盒购自北京索莱宝科技有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自碧云天生物技术研究所。
1.2实验分组将SGC-7901细胞接种到24孔培养板,37 ℃条件下常规培养过夜,细胞融合度达30%左右开始慢病毒感染。用Opti-MEM稀释病毒液(MOI=50),将病毒液添加到细胞中,同时加入Polybrene(终浓度为5 μg/mL),混合,37 ℃条件下培养24 h,吸弃培养液,加入体积分数10%胎牛血清的DMEM培养液常规培养72 h,用4 μg/mL嘌呤霉素筛选10 d,收集细胞。稳定感染Lv-FOXJ1和Lv-NC的SGC-7901细胞记为FOXJ1组和阴性对照组,设置不感染慢病毒的SGC-7901细胞为空白对照组。
1.3细胞中FOXJ1mRNA的检测取各组细胞,添加Trizol(每个6孔板内加入1 mL),冰上静置5 min,按照RNA提取试剂盒提取细胞中的总RNA,用First Strand cDNA Synthesis试剂盒合成cDNA,根据SYBR Premix Ex Taq试剂盒说明进行Real-time PCR。反应条件:95 ℃预变性30 s(1个循环);95 ℃ 5 s,60 ℃ 30 s,72 ℃ 15 s,共40个循环。引物序列:FOXJ1-F为5’-TGGATCACGGACAACTTCTGC TA-3’,FOXJ1-R为5’-CACTTGTTCAGAGACAGGT TGTGG-3’;内参β-actin-F为5’-GAGCTACGAGCT GCCTGACG-3’,β-actin-R为5’-CCTAGAAG CATTTGCGGTGG-3’。用2-ΔΔCt法计算FOXJ1 mRNA表达水平。实验重复3次。
1.4细胞中FOXJ1蛋白的Westernblot法检测取各组细胞,添加含有蛋白酶抑制剂的RIPA裂解液于冰上裂解,用Bradford法检测蛋白浓度。在蛋白样品中添加5×上样缓冲液,98 ℃加热10 min,4 ℃ 12 000×g离心10 min,-20 ℃保存。配制100 g/L积层胶和8 g/L分离胶,每个泳道上样50 μg,100 V电压电泳,直至溴酚蓝进入到凝胶底部。用半干法将凝胶上的蛋白转移到NC膜上(25 mA,转膜30 min),将NC膜放在50 g/L脱脂奶粉中室温封闭2 h,加鼠抗人FOXJ1抗体(1∶600)、鼠抗人β-actin抗体(1∶1 000)4 ℃孵育过夜,加HRP标记的山羊抗鼠二抗(1∶2 000)在室温孵育1 h,ECL显色。内参为β-actin。以目的蛋白和内参条带灰度值的比值表示目的蛋白表达水平。实验重复3次。
1.5细胞存活率的检测取各组细胞种植到96孔板,每孔5×103个细胞,培养2 d以后取出培养板,每孔加20 μL的MTT培养4 h。吸弃孔内液体,加150 μL的DMSO于摇床上振荡反应10 min。用酶标仪比色,参比波长为490 nm。设置空白孔调零。实验重复3次。
1.6克隆形成能力的检测取各组细胞接种在10 mL的培养皿中,每皿200个细胞,37 ℃培养箱内培养,14 d可观察到细胞克隆出现。多聚甲醛固定后,吉姆萨染色20 min,室温条件下干燥,计数细胞数≥50个的克隆数目,以克隆数目与接种细胞数目的百分比表示克隆形成率。实验重复3次。
1.7细胞凋亡率的检测取各组细胞,用4 ℃预冷后的PBS洗涤2次,加400 μL结合缓冲液,再加5 μL PI、5 μL Annexin V-FITC,避光条件下孵育20 min,上流式细胞仪检测凋亡率。实验重复3次。
1.8胞浆中CytC和细胞中C-Caspase-3、C-Caspase-9蛋白的检测取各组细胞,提取胞浆中的总蛋白,用Western blot法检测Cyt C蛋白水平,同时用Western blot方法检测细胞总蛋白中C-Caspase-3、C-Caspase-9水平;C-Caspase-3、C-Caspase-9抗体均以1∶600稀释,步骤同1.4。实验重复3次。
1.9线粒体膜电位的JC-1法检测取各组细胞配制成单细胞悬液,用PBS重悬3次,加JC-1染色液于37 ℃培养箱中孵育20 min,用冰预冷的JC-1染色缓冲液洗涤2次,添加1 mL的DMEM,上流式细胞仪检测。正常细胞中JC-1聚集在线粒体中产生红色荧光,凋亡细胞内JC-1以单体的形式聚集在胞浆中,产生绿色荧光。计算红色荧光和绿色荧光的比值,以此比值作为线粒体膜电位水平。实验重复3次。
1.10统计学处理实验数据用SPSS 21.0分析,3组细胞上述各指标的比较采用单因素方差分析,组间两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 3组细胞中FOXJ1表达水平的比较FOXJ1组细胞中FOXJ1 mRNA和蛋白表达水平均高于空白对照组、阴性对照组(P<0.05)。见图1和表1。
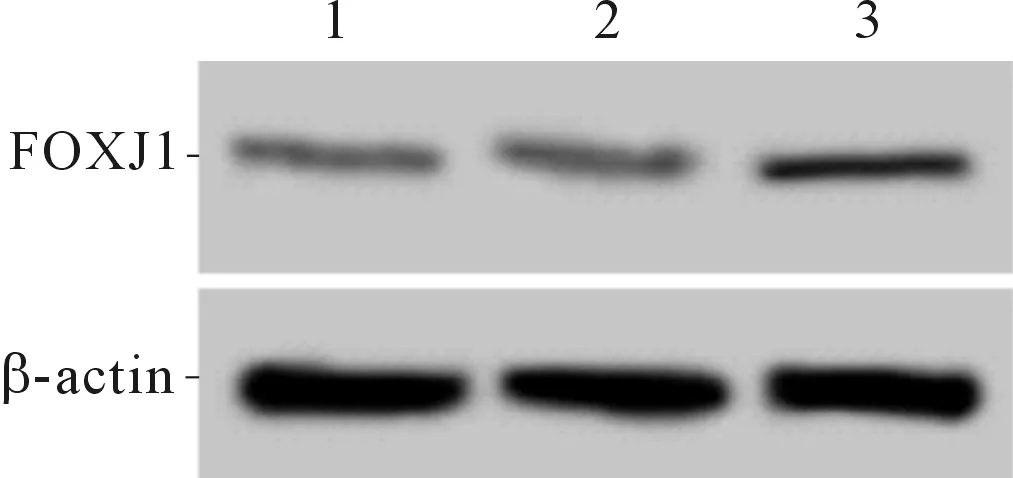
1:空白对照组;2:阴性对照组;3:FOXJ1组
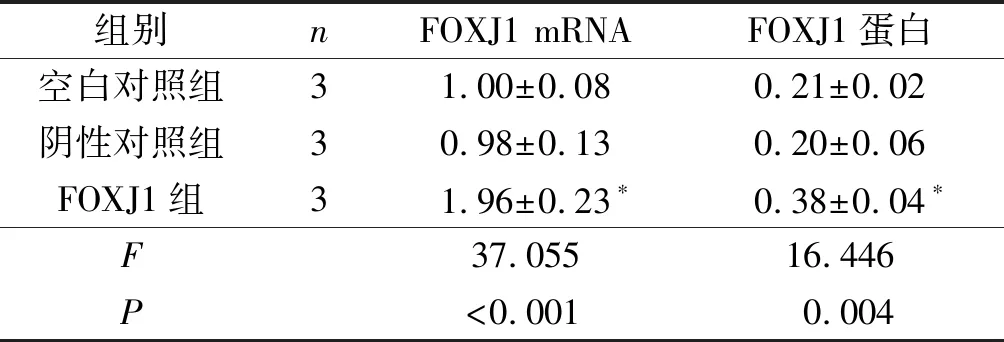
组别nFOXJ1 mRNAFOXJ1蛋白空白对照组31.00±0.080.21±0.02阴性对照组30.98±0.130.20±0.06FOXJ1组31.96±0.23∗0.38±0.04∗F37.05516.446P<0.0010.004
*:与空白对照组、阴性对照组比较,P<0.05
2.2 3组细胞存活率和克隆形成率的比较FOXJ1组细胞存活率和克隆形成率低于空白对照组、阴性对照组(P<0.05)。见表2。
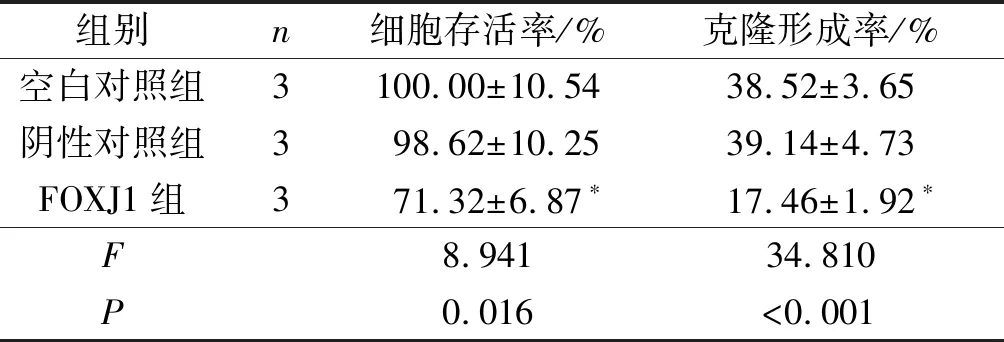
表2 3组细胞存活率和克隆形成率的比较
*:与空白对照组、阴性对照组比较,P<0.05
2.3 3组细胞凋亡率和C-Caspase-3、C-Caspase-9表达水平的比较FOXJ1组细胞中C-Caspase-3、C-Caspase-9表达水平和细胞凋亡率高于空白对照组、阴性对照组(P<0.05)。见图2和表3。
2.4 3组细胞线粒体膜电位及胞浆中CytC表达水平的比较FOXJ1组细胞线粒体膜电位低于空白对照组、阴性对照组,胞浆中Cyt C蛋白水平高于空白对照组、阴性对照组(P<0.05)。见图3和表4。
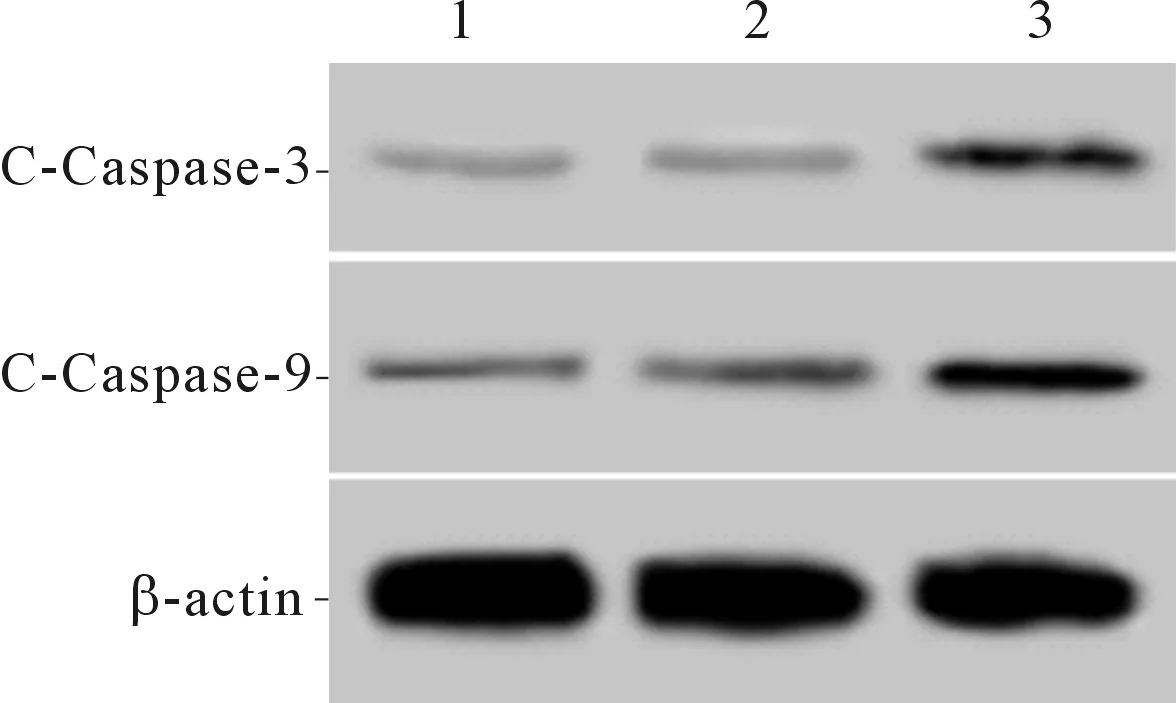
1:空白对照组;2:阴性对照组;3:FOXJ1组
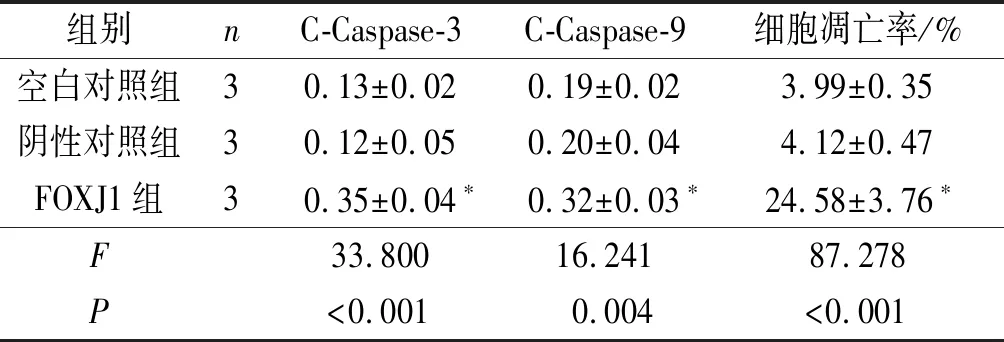
组别nC-Caspase-3C-Caspase-9细胞凋亡率/%空白对照组30.13±0.020.19±0.023.99±0.35阴性对照组30.12±0.050.20±0.044.12±0.47FOXJ1组30.35±0.04∗0.32±0.03∗24.58±3.76∗F33.80016.24187.278P<0.0010.004<0.001
*:与空白对照组、阴性对照组比较,P<0.05
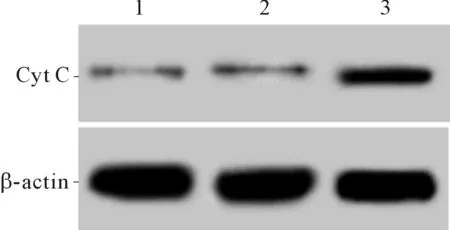
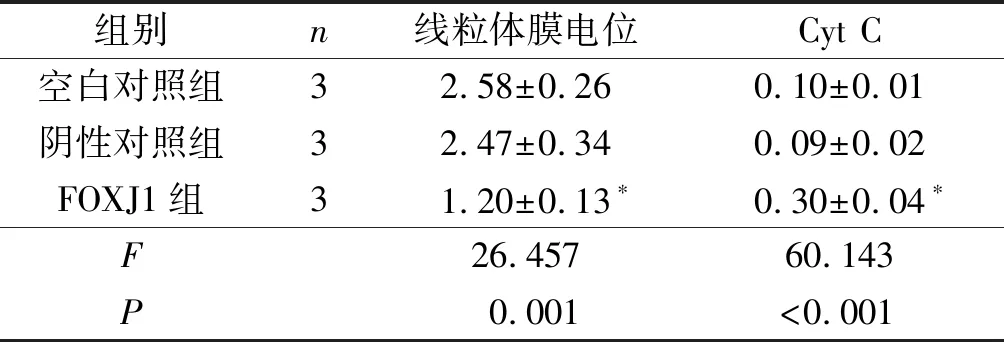
1:空白对照组;2:阴性对照组;3:FOXJ1组
*:与空白对照组、阴性对照组比较,P<0.05
3 讨论
FOXJ1基因定位于染色体17q22~q25,属于FOX转录因子家族成员。FOXJ1蛋白由403个氨基酸组成,含有转录激活域、核定位序列、DNA结合域。当受到多种细胞因子、生长因子等外界信号刺激时,细胞内的FOXJ1被激活,与靶基因上的KTTT GTTGTTKTW或者HWDTGTTTGTTTA序列结合(其中W表示A或T,H为非G,D为非C,K表示G或者T),从而影响靶基因的转录,目前对于FOXJ1调控转录的具体机制尚不明确[9-11]。FOXJ1具有多种功能,参与免疫细胞如T细胞活化等过程,参与细胞内炎症因子、黏附分子、趋化分子等的表达调控,在脊椎动物纤毛、胚胎发育、神经系统分化等过程中发挥关键作用[12-14]。研究[4-5,15]证实FOXJ1参与肿瘤的发生,在不同肿瘤中发挥的作用不同;目前在人类乳腺癌细胞中发现FOXJ1基因异常高甲基化,而在肝癌细胞中FOXJ1表达水平升高。
最近的研究[7-8,16]显示,FOXJ1在胃癌组织中表达下调,在胃癌发生发展中可能发挥抑癌作用;上调胃癌细胞中FOXJ1的表达后,胃癌细胞的运动、迁移和侵袭能力降低,胃癌细胞分解细胞外基质的能力也下降。本实验结果表明,过表达FOXJ1的胃腺癌细胞凋亡率升高,同时细胞克隆形成能力和存活能力降低,提示过表达FOXJ1具有抑制胃腺癌细胞生长并诱导凋亡的作用,其在胃癌中发挥抑癌作用。
细胞凋亡是一个主动过程,其发生机制主要有内质网途径、线粒体途径、死亡受体途径等,线粒体途径是最为经典的细胞凋亡机制。线粒体释放Cyt C和线粒体外膜通透性增加是线粒体途径凋亡发生的关键。线粒体膜上的通透性转换孔开放可导致线粒体膜电位下降,存在于线粒体内的Cyt C可进入到胞质中。Cyt C具有激活Caspase-9的作用。Caspase-9是Caspase凋亡反应的上游因子,其活化可以迅速激活Caspase级联反应,最终激活位于凋亡反应下游的Caspase-3,诱导细胞凋亡发生[17-19]。Caspase-3和Caspase-9在正常细胞中以没有活性的酶原形式存在,C-Caspase-3、C-Caspase-9分别是Caspase-3和Caspase-9的活化形式,二者是细胞凋亡发生的直接参与因子[20-21]。本实验结果表明,过表达FOXJ1的胃腺癌细胞线粒体膜电位下降,同时细胞中C-Caspase-3、C-Caspase-9水平升高,胞浆中Cyt C蛋白水平升高,提示FOXJ1可能通过激活线粒体途径诱导Caspase凋亡反应,从而促进胃腺癌细胞凋亡。
综上所述,高表达FOXJ1可以抑制胃腺癌细胞的生长,诱导其凋亡,凋亡诱导机制与线粒体途径有关。这对于研究FOXJ1在肿瘤发生中的具体机制,对于阐明胃腺癌的发病机制具有重要意义。

