采后苯并噻重氮处理对‘玉金香’甜瓜单萜类香气及其代谢关键酶的影响分析
王 雨,李霁昕,李经纬,郝兰兰,胡妍芸,王 博,蒋玉梅,*
(1.甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070;2.甘肃出入境检验检疫局综合技术中心,甘肃 兰州 730070)
‘玉金香’甜瓜是我国西北地区主要的经济作物之一,属于呼吸跃变型果实,采后极易被病原菌侵染而发生腐烂[1-2]。苯并噻重氮(benzo-(1,2,3)-thiadiazole-7-carbothioic acid S-methyl ester,BTH)是目前常用的一种典型的植物抗病诱导剂[3],能够诱导甜瓜果实产生抗病性,有效降低甜瓜果实的采后腐烂率[4-5]。香气物质的组成和含量是衡量甜瓜品质的重要指标[6],已有240多种香气物质被分离检测[7],根据合成前体,其代谢途径可分为脂肪酸途径、氨基酸途径和碳水化合物途径[8]。目前研究显示采后BTH诱抗处理可提高甜瓜果肉和果皮组织的脂肪氧合酶(lipoxygenase,LOX)活性,进而影响脂肪酸途径香气组分代谢[9]。同时,采后BTH处理会降低‘玉金香’果实氨基酸含量,抑制相关代谢酶活性,进而改变酯类香气组分的释放[10]。关于采后BTH处理对萜烯类香气代谢的影响分析及研究目前鲜见报道。
以碳水化合物为前体的萜烯类合成途径包括甲基磷酸赤藓糖途径(methyl-erythritol-4-phosphate pathway,MEP)和甲羟戊酸途径(mevalonate pathway,MVA)[11]。单萜类香气物质以糖的中间代谢产物3-磷酸甘油醛、丙酮酸为前体,经MEP途径生成香叶基二磷酸(geranyl diphosphate,GPP),再由单萜合成酶催化生成[12-13],其中l-脱氧-D-木酮糖-5-磷酸还原异构酶(l-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)是MEP代谢途径中的限速酶[14]。
本研究以厚皮甜瓜‘玉金香’为实验材料,监测采后常温贮藏期间单萜类香气组分及其代谢酶DXR活力的变化,分析其相关性,探讨采后BTH诱抗处理对DXR活力和单萜类香气形成的影响,以期为甜瓜果实香气代谢机理研究提供参考。
1 材料与方法
1.1 材料与试剂
‘玉金香’厚皮甜瓜,2017年6月(花后45 d)采自甘肃省皋兰县什川镇,果发泡网袋包装,36 个/箱,当天运抵实验室,室温((22±2)℃、相对湿度55%~65%)贮藏。
BTH(纯度98%)、2-辛醇(色谱纯) 美国Sigma Aldrich公司。
1.2 仪器与设备
TRACE1300GC-ISQ300气相色谱-质谱联用仪、TG-WAX色谱柱(60 m×0.25 mm,0.5 µm)、Genesis 10S型紫外-可见分光光度仪 美国Thermo Scientific公司;固相微萃取(solid phase microextraction,SPME)装置、50/30 μm二乙基苯/碳分子筛/聚二甲基硅(divinylbenzene/carboxen/polydimethyl-siloxane,DVB/CAR/PDMS)萃取头 美国Surpelco公司;CP 214型电子分析天平 上海奥豪斯仪器有限公司;PHS-3C pH计上海雷磁仪器有限公司。
1.3 方法
1.3.1 样品处理
1.3.1.1 BTH诱抗处理
参照Vieira dos Santos等[15]的方法并略作修改。于采收当日,选择成熟度、大小相近、无损伤和虫咬的果实,分别采用100 mg/L BTH溶液(蒸馏水配制,BTH处理组)、蒸馏水(CC组)浸泡10 min,以未处理果实为对照(CK组)。室温条件((22±2)℃、相对湿度55%~65%)贮藏。
1.3.1.2 取样
参照Bi Yang等[16]的方法并略作修改。贮藏第0、2、4、6、8、l0、12、14天随机抽取外观相近、无损伤的‘玉金香’果实样品,每组10 个,分别取果实“赤道”附近的果皮组织(皮下2~5 mm)、果肉组织(皮下5~8 mm),切小块混匀,每3.0 g锡箔纸包裹液氮冷冻,-80 ℃保存用于测定酶活力;香气检测样品每5.0 g混匀的小块置于20 mL顶空瓶中,加入1.0 g NaCl、内标2-辛醇(8.82 mg/L)20 μL,密封混匀,-20 ℃保存待测。
1.3.2 指标测定
1.3.2.1 香气含量的测定
参照Zhang Bo等[17]的方法并修改。样品常温解冻,40 ℃下平衡30 min。插入活化的SPME装置,40 ℃顶空吸附30 min。GC进样口热解析10 min。
GC条件:进样口温度240 ℃,不分流进样,20 min后打开分流阀,分流比30∶1;升温程序:初温50 ℃,以3 ℃/min升至170 ℃,保持10 min;载气(He)流速1.0 mL/min。
MS条件:电子轰击离子源(electron impact ionization,EI);电子能量70 eV;传输线温度180 ℃;离子源温度240 ℃;质谱扫描范围m/z 40~350。
1.3.2.2 酶活力的测定
DXR活力的测定参照Hasunuma等[18]的方法并略作修改。取低温保存样品3.0 g(冷冻状态)于-20 ℃预冷研钵,加6.0 mL提取液(含150 mmol/L pH 7.5 Tris-HCl、5 mmol/L MgCl2、5 mmol/L β-巯基乙醇、1 mmol/L二磷酸硫胺),冰浴条件下研磨匀浆,15 000×g、4 ℃离心15 min,取上清液,为粗酶液。反应混合液(含100 mmol/L pH 7.5 Tris-HCl、1 mmol/L MnCl2、0.12 mmol/L NADPH、0.25 mmol/L DXP)3.0 mL,加入1 mL粗酶液,利用紫外-可见分光光度计测定340 nm波长处的吸光度,每隔20 s读数,连续测定3 min。以不含粗酶液的反应混合液为对照。酶活力单位为U/g,结果以鲜质量计。每个样品检测做3 次独立重复。
1.4 数据处理与分析
香气物质经计算机检索NIST Library(11)、Wiley Library,结合文献人工图谱解析定性,内标法半定量。采用Excel 2010软件对数据进行统计分析;采用SPSS 19.0软件进行相关性分析(相关系数法)。
2 结果与分析
2.1 不同处理对甜瓜果实贮藏过程中DXR活力的影响
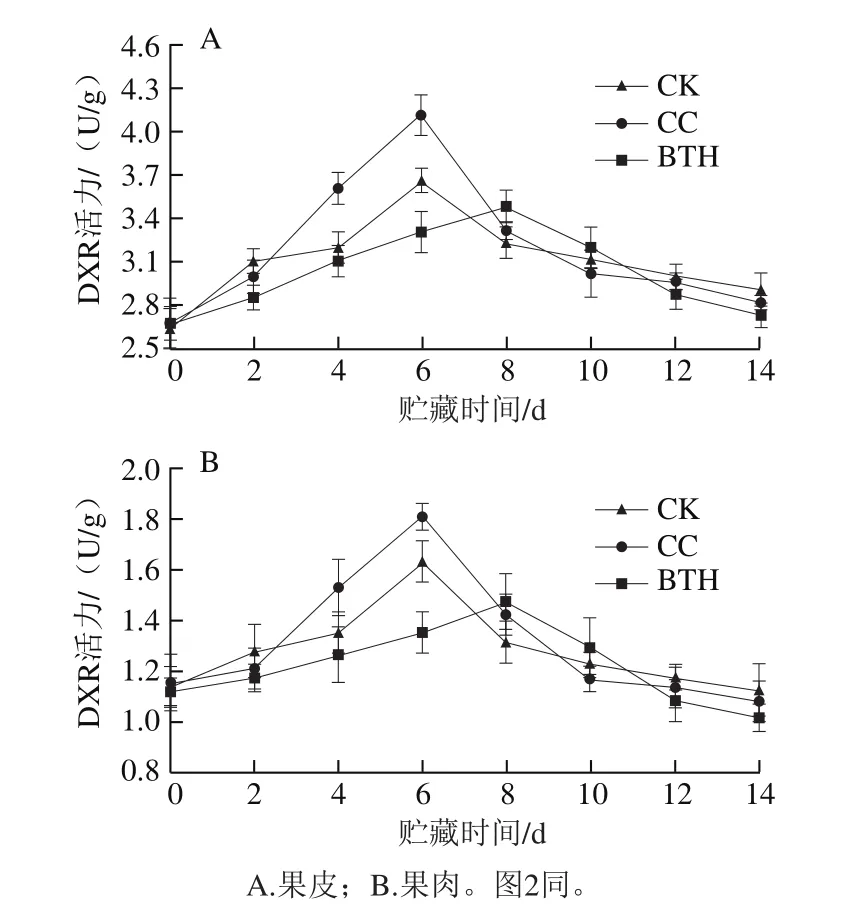
图 1 BTH处理对贮藏过程中甜瓜DXR活力的影响Fig. 1 Effect of BTH treatment on DXR activity in muskmelon during storage
由图1A、B可知,采后贮藏期间果皮和果肉试样中DXR活力均呈单峰型变化,CK和CC组果皮和果肉试样活力峰值均在第6天出现,BTH处理可抑制DXR活力,并使高峰延迟2 d出现,条件因子水使DXR活力高峰值增加,贮藏第0~2天,CC组果皮和果肉试样DXR活力低于CK组,高于BTH处理组;第2~6天,CC组DXR活力急剧上升;贮藏的第10天,CC组的DXR活力比CK组低,CC组果皮和果肉试样DXR活力分别较CK组低3.41%和4.35%。贮藏期间CC组DXR果皮和果肉试样活力峰值分别为(4.11±0.14)、(1.81±0.05)U/g,BTH处理组果皮和果肉中DXR活力比CC组分别降低了19.48%和25.49%。果皮试样DXR活力整体高于果肉试样,CK、CC组和BTH处理组果皮试样DXR活力峰值较果肉试样分别高1.2、1.3、1.4 倍。由图1A可知,对于果皮,BTH处理组峰值为(3.48±0.11)U/g,分别比CK和CC组峰值低4.85%和15.15%。由图1B可知,对于果肉,BTH处理组峰值为(1.48±0.11)U/g,比CK和CC组低9.78%和18.23%。
前人报道‘玉金香’厚皮甜瓜贮藏期间乙烯释放规律为:常温贮藏期间CC组果实乙烯于第6天出现释放高峰,BTH处理后,乙烯释放高峰提前,释放量受到显著抑制[19]。结合分析发现,本实验CK和CC组果皮和果肉试样DXR活力达到峰值的时间与乙烯跃变的时间相一致,均出现在第6天,BTH处理后DXR活力也被抑制。由此推断,厚皮甜瓜‘玉金香’DXR活力与乙烯的释放存在一定的相关性,具体机理还有待进一步研究。
2.2 不同处理对甜瓜果实贮藏过程中单萜类香气释放量的影响
实验甜瓜果实共检出代谢自MEP途径的单萜类香气组分9 种。包括1 种无环单萜(香叶醇)、7 种单环单萜(α-萜品醇、顺-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇、L-香芹醇、对-薄荷-(7),8(10)-二烯-9-醇、反式-(+)-异柠檬烯、L-薄荷醇、水茴香醛)、1 种三环单萜(桉叶油醇)。
2.2.1 不同处理对甜瓜果实贮藏过程中无环单萜类香气物质释放量的影响
香叶醇在果皮和果肉样品中均呈双峰型变化,各样品峰值出现时间一致。BTH处理组香叶醇含量始终低于CK和CC组。由图2A可知,对于果皮,贮藏前期各处理组香叶醇的释放量均呈上升趋势,分别于第4天和第8天出现释放高峰。第8天CC组释放峰值为(0.432±0.037)ng/g,分别是CK组和BTH处理组的1.27 倍和1.59 倍。由图2B可知,对于果肉,香叶醇的释放量分别在第2天和第8天达到释放高峰。CK、CC组和BTH处理组第二次释放高峰值远远大于第一次释放高峰值,分别是第一次释放高峰值的4.00、3.58、6.03 倍。CK组和BTH处理组第8天释放峰值分别为(1.872±0.167)ng/g和(1.438±0.216)ng/g,分别是CC组的87.98%和67.57%。
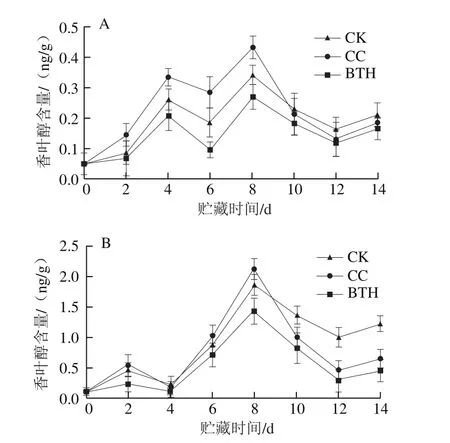
图 2 BTH处理对贮藏过程中甜瓜MEP途径代谢无环单萜类香气物质释放量的影响Fig. 2 Effect of BTH treatment on release of aroma-active acyclic monoterpene compounds through methyl-erythritol-4-phosphate pathway from muskmelon during storage
2.2.2 不同处理对甜瓜果实贮藏过程中单环单萜类香气物质释放量的影响
实验甜瓜果实检测出单环单萜类香气α-萜品醇、L-香芹醇、对-薄荷-(7),8(10)-二烯-9-醇、L-薄荷醇和反式-(+)-异柠檬烯在样品贮藏期间呈双峰型变化,顺-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇CK组呈单峰型变化,CC组和BTH处理组呈双峰型变化,水茴香醛呈单峰型变化。
α-萜品醇在果肉样中的释放量是单萜类香气物质中最高的。由图3A1可知,对于果皮,CC组在第2天和第6天达到释放高峰,CK组和BTH处理组第0~2天急速下降,第4天和第10天达到峰值,两者变化趋势一致;CC组第6天释放峰值为(0.623±0.071)ng/g,分别是CK组和BTH处理组第二次(10 d)峰值的1.26 倍和1.70 倍。由图3A2可知,对于果肉,各处理组α-萜品醇的释放量均分别在第2天和第8天达到高峰,CK、CC组和BTH组第二次释放峰值分别是第一次释放峰值的5.61、4.21 倍和5.90 倍;BTH处理组释放量始终低于CC组,BTH处理组第8天释放峰值为(2.320±0.211)ng/g,分别是CK和CC组释放峰值的78.31%和70.55%。
顺-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇在果皮和果肉中释放规律不同。CC组和BTH处理组释放高峰出现在第2天和第6天,CK组第4天达到释放高峰。由图3B1可知,对于果皮,贮藏第6天CC组释放峰值为(0.347±0.043)ng/g,分别是CK组和BTH处理组第二次释放峰值的1.22 倍和1.43 倍。由图3B2可知,对于果肉,BTH处理组第二次释放峰值是第一次释放峰值的5.14 倍,BTH处理组第6天释放峰值为(0.890±0.143)ng/g,分别是CK组和CC组第二次释放峰值的81.52%和63.97%。
由图3C1可知,对于果皮,CC组L-香芹醇在第2天和第6天达到释放高峰,释放量明显高于CK组和BTH处理组,10 d后含量低于CK组,高于BTH处理组;CK组和BTH处理组第二次释放高峰较CC组推迟2 d出现;第6天CC组释放峰值为(0.580±0.056)ng/g,分别是CK组和BTH处理组第二次峰值的1.23、1.44 倍。由图3C2可知,对于果肉,CK组和BTH处理组变化趋势相一致,CC组8 d后含量低于CK组和BTH处理组,BTH处理组第8天释放峰值为(0.430±0.057)ng/g,分别是CK组和CC组第二次峰值的80.52%和62.41%。
对于果皮和果肉,CC组对-薄荷-(7),8(10)-二烯-9-醇第一次释放高峰均出现在第2天,含量低于CK组,高于BTH处理组,第二次释放高峰均出现在第6天。由图3D1可知,对于果皮,CK组和BTH处理组第二次释放峰值较CC组推迟2 d出现。第6天CC组释放峰值为(0.524±0.054)ng/g,分别是CK组和BTH处理组第二次释放峰值的1.19、1.50 倍;由图3D2可知,对于果肉,CC组和BTH处理组变化趋势相一致,BTH处理组第6天释放峰值为(1.280±0.172)ng/g,分别是CK组和CC组第二次释放峰值的90.67%和59.20%。
由图3E1可知,对于果皮,CC组L-薄荷醇在第2天和第6天达到释放高峰,CK组和BTH处理组在贮藏前2 d释放量呈下降趋势,第4天和第8天达到峰值,贮藏第10~14天,L-薄荷醇释放量再次升高;第6天CC组释放峰值为(1.214±0.173)ng/g,分别是CK组和BTH处理组第二次释放峰值的1.22、1.62 倍。由图3E2可知,对于果肉,BTH处理组第二次释放高峰较CK和CC组推迟2 d出现,BTH处理组第8天释放峰值为(0.787±0.145)ng/g,分别是CK和CC组第二次释放峰值的79.82%和55.19%(第6天)。
由图3F1可知,对于果皮,CK和CC组反式-(+)-异柠檬烯释放高峰均出现在第2天和第6天,BTH处理组第二次释放高峰较CC和CK组推迟2 d,贮藏第10~14天,反式-(+)-异柠檬烯释放量略有上升,第6天CC组释放峰值为(1.991±0.158)ng/g,分别是CK组和BTH处理组第二次峰值的1.15、1.59 倍。由图3F2可知,对于果肉,各处理组差异较大,BTH处理组第二次释放高峰较CC组推迟4 d出现,BTH处理组第10天释放峰值为(2.067±0.280)ng/g,分别是CK和CC组第二次释放峰值的82.31%和71.99%。
水茴香醛在果肉试样中未检出。由图3G1可知,对于果皮,CK组水茴香醛在第4天达到释放高峰,CC组和BTH处理组的释放高峰则出现在贮藏第6天,释放高峰后,样品释放量急剧下降,CC组释放峰值为(0.527±0.042)ng/g,分别是CK组和BTH处理组的1.14 倍和1.43 倍。
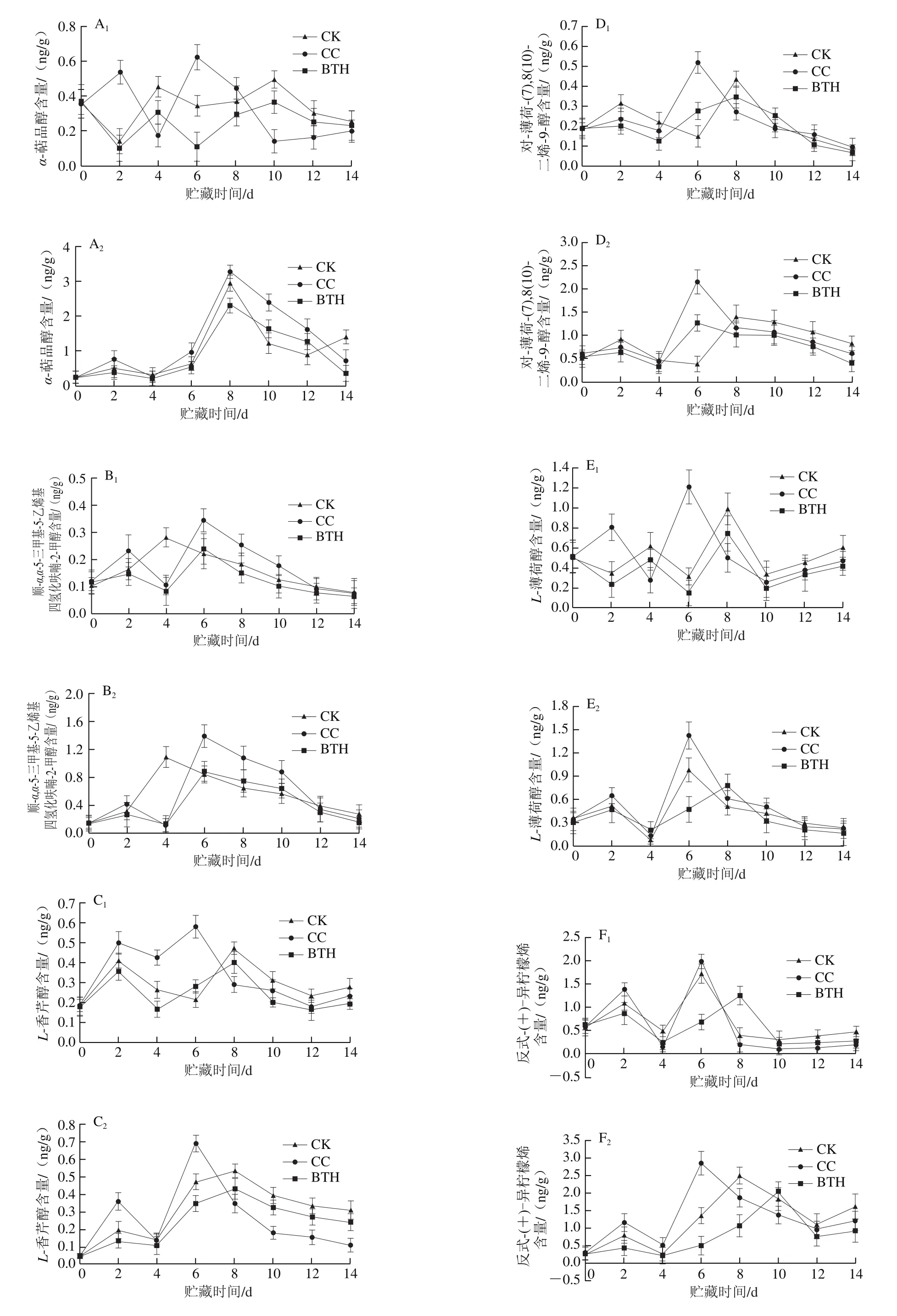

图 3 BTH处理对贮藏过程中甜瓜MEP途径代谢单环单萜类香气物质释放量的影响Fig. 3 Effect of BTH treatment on release of aroma-active monocyclic monoterpene compounds through the methyl-erythritol-4-phosphate pathway from muskmelon during storage
2.2.3 不同处理对甜瓜果实贮藏过程中三环单萜类香气物质释放量的影响
桉叶油醇在果皮样中未检测出,果肉样中呈单峰型变化。由图4可知,对于果肉,CC组贮藏第0天未检测出,之后急剧增加,第6天达到释放高峰,CK组和BTH处理组贮藏前2 d未检测出,之后缓慢上升,分别在第8天和第10天达到释放高峰。BTH处理组释放峰值为(1.069±0.198)ng/g,分别是CK组和CC组的69.40%和50.72%。

图 4 BTH处理对贮藏过程中甜瓜MEP途径代谢三环单萜类香气物质释放量的影响Fig. 4 Effect of BTH treatment on release of aroma-active tricyclic monoterpene compounds through the methyl-erythritol-4-phosphate pathway from muskmelon during storage
由此可见,BTH处理可抑制单萜类香气物质的释放,改变其释放峰值出现时间。条件因子水会促进释放高峰前单萜类香气物质的释放,8 d后则在一定程度上减少了单萜类香气物质的释放,但无明显作用规律。
2.3 甜瓜贮藏过程中DXR活力与单萜香气物质释放量相关性分析
由表1可知,CK组α-萜品醇含量与DXR活力呈负相关,其他8 种单萜类香气物质含量都与DXR活力呈正相关,香叶醇、反式-(+)-异柠檬烯、水茴香醛含量与DXR活力呈显著正相关(P<0.05)。由表2可知,采后BTH处理,对L-薄荷醇、桉叶油醇含量与DXR活力相关性无影响;但会提高顺-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇、L-香芹醇、对-薄荷-(7),8(10)-二烯-9-醇、水茴香醛含量与DXR活力的相关性;BTH处理组的α-萜品醇含量与DXR活力相关性由CK组的负相关变为正相关。反式-(+)-异柠檬烯含量与DXR活力的相关性则会被BTH处理减弱。
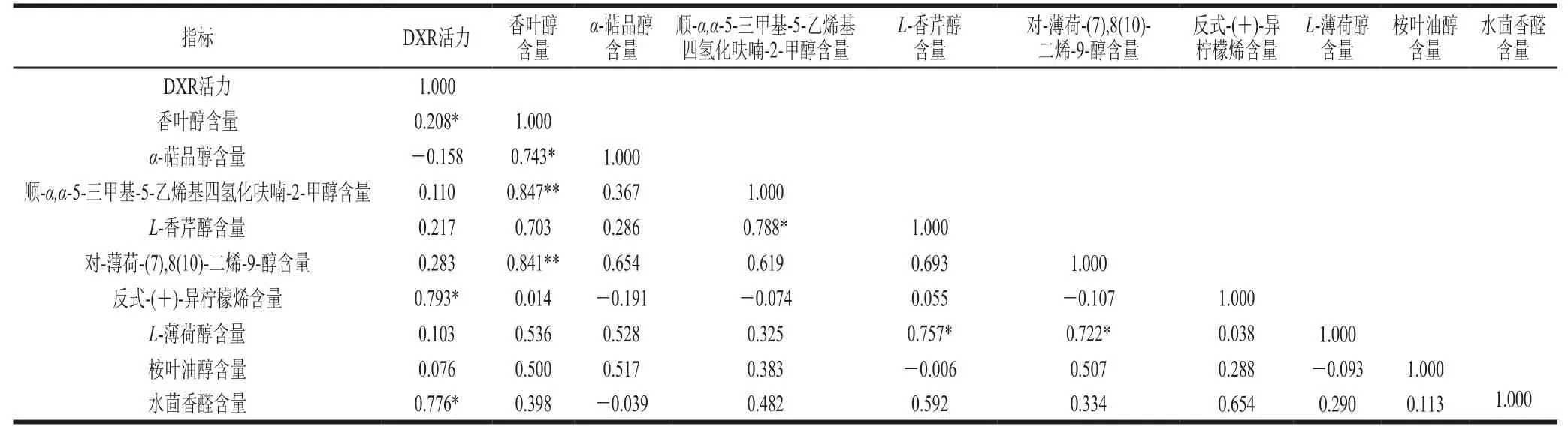
表 1 CK组DXR活力与单萜类香气物质释放量相关性Table 1 Correlation analysis of DXR activity with release of aroma-active monoterpenes from control samples
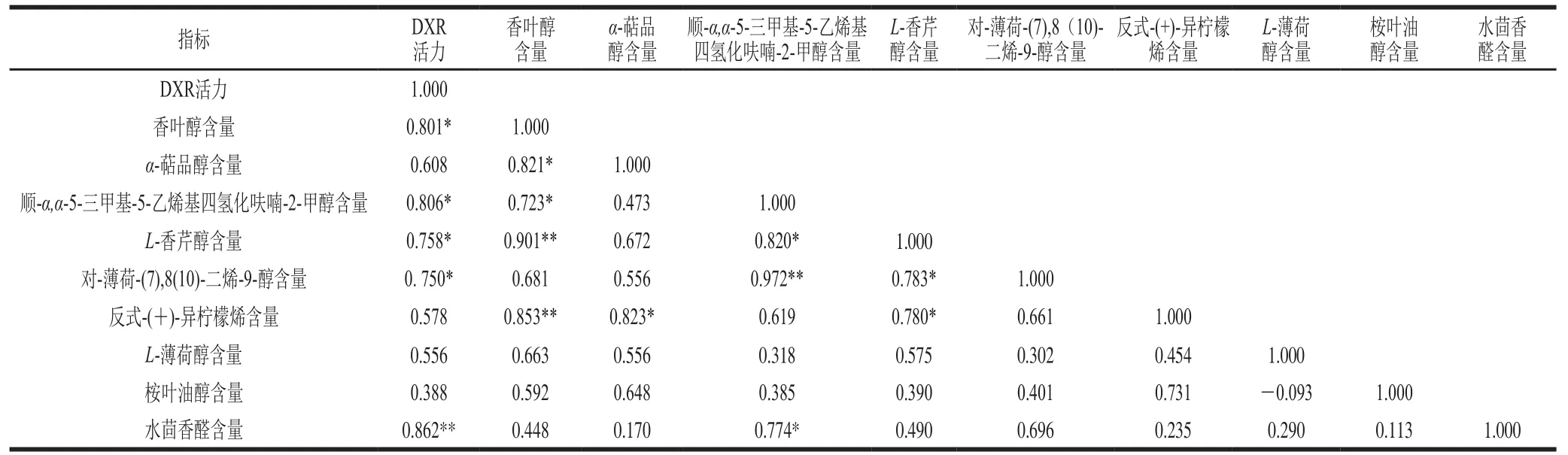
表 2 BTH处理组DXR活力与单萜类香气物质释放量相关性Table 2 Correlation analysis of DXR activity with release of aroma-active monoterpenes from BTH-treated samples
3 讨 论
本实验研究表明采后BTH处理可抑制‘玉金香’甜瓜DXR活力,延迟其活力峰值的出现,改变单萜类香气物质含量与DXR活力的相关性,进而影响单萜类香气的释放。已报道的研究显示糖代谢中的葡萄糖经糖酵解途径产生的产物3-磷酸甘油醛、丙酮酸及乙酰CoA是萜类物质合成的前体[20]。以3-磷酸甘油醛和丙酮酸为原料经MEP途径是单萜合成的最主要途径[21]。DXR是MEP途径中的关键限速催化酶[22]。DXR催化的反应是MEP途径中“碳流”的分支点,也是调控萜类化合物合成的有效靶点[23]。研究人员从薄荷中分离得到DXR基因,并将DXR基因连接CaMV 35S启动子转移到薄荷中,大多数转基因植株的薄荷精油(多为单萜化合物)含量与对照相比增高,最高增幅可达50%[24]。姜花萜类代谢途径以MEP途径为主,经磷甘霉素(可抑制MEP途径中DXR活力)处理后,姜花萜类挥发性香气物质含量与对照相比降低了90%以上[25]。这些报道佐证了本实验的推断,采后BTH处理可通过抑制MEP途径DXR活力,进而影响厚皮甜瓜‘玉金香’的单萜类香气的生成和释放。
从感官品质的角度分析,单萜类香气大都带有浓郁的果香、花香和木香[26-27],如香叶醇具有橙子花香味[28];α-萜品醇具有带甜的浓青香和木青香[29];反式-(+)-异柠檬烯具有令人愉快的柠檬香气[30],采后BTH处理减少了该类物质的释放,进而会减弱样品甜瓜甜香和花香感,影响其香气品质,这与消费者对BTH处理甜瓜样品的感官认知基本一致。
4 结 论
‘玉金香’甜瓜果皮和果肉中共检出9 种单萜类香气组分,其中8 种单萜类香气物质含量与DXR活力呈正相关;采后BTH处理在一定程度上抑制了甜瓜DXR活力和单萜类香气物质的释放,延迟了DXR活力峰值出现,改变了单萜类香气释放规律及其与DXR活力的相关性。由此可见,采后BTH处理可通过抑制‘玉金香’甜瓜DXR活力,延迟活力峰值的出现,改变单萜类香气与DXR活力的相关性,进而影响单萜类香气的释放。条件因子水对DXR活力及其产物单萜类香气物质释放均有影响,但其作用规律和机理还有待进一步研究。

