熊果酸及其衍生物抗肿瘤作用的研究进展
向润清,范源
(1.云南中医药大学中药学院,云南 昆明 650500;2.云南中医药大学临床医学院,云南 昆明 650500)
熊果酸(ursolic acid,UA)又名乌索酸、乌苏酸,是一种天然的五环三萜类化合物(结构图见图1),广泛存在于天然植物中,如夏枯草、熊果、野木瓜、山茱萸、白花蛇舌草等[1]。研究表明,熊果酸具有抗糖尿病、抗多种细菌、抗炎、抗氧化、抗人类免疫缺陷病毒(HIV)、丙型肝炎病毒(HCV)等生物学效应,此外熊果酸对肺、肾、肝与脑的化学损害起保护作用[2]。熊果酸可以通过多种细胞信号通路抑制肿瘤形成及细胞毒作用、抑制肿瘤细胞增殖、诱导肿瘤的分化及凋亡、抗侵袭性和抗肿瘤血管形成。熊果酸衍生物的合成主要是对熊果酸C-2位氢、C-3位羟基、C-28位羧基和A环的结构进行修饰、改造、设计,很多衍生物具有较强的抗肿瘤活性[3]。

图1 熊果酸结构图
1 熊果酸抗肿瘤作用
1.1 抗乳腺癌 UA可以抑制乳腺癌细胞增殖并诱导其凋亡。UA作用于乳腺癌细胞株MCF-7和MDA-MD-231时,作用浓度分别为5、7.5 μmol·L-1、作用时间分别为48 h和72 h时,其可下调信号转导及转录活化因子3(STAT3)和表皮生长因子受体(EGFR)的表达,及自身调节细胞周期蛋白D1(Cyclin D1),并通过抑制磷脂酰肌醇-3-激酶(PI3K)、蛋白激酶B(Akt)和STAT3的表达,阻滞细胞周期,从而诱导细胞凋亡,抑制乳腺癌细胞的增殖[4],在细胞株MDA-MB-231体外实验中,用40 μmol·L-1的UA作用24 h和48 h,可下调抗凋亡因子B细胞淋巴瘤2(Bcl-2)与聚ADP-核糖聚合酶(PARP)和上调促凋亡因子半胱氨酸天冬氨酸蛋白酶3(caspase-3)、半胱氨酸天冬氨酸蛋白酶8(caspase-8)、半胱氨酸天冬氨酸蛋白酶9(caspase-9)、Bax的表达,诱导细胞凋亡[5]。研究表明,UA明显抑制乳腺癌SK-BR-3细胞的增殖,并呈时间和浓度依赖性。经UA处理后的细胞呈现典型的凋亡核固缩表现,细胞核呈致密的颗粒状或块状,UA作用48 h后,SK-BR-3细胞阻滞在G0/G1期,DNA大片段断裂,表明UA在体外对SK-BR-3细胞具有抗增殖和诱导凋亡的作用[6]。此外,Mishra等[7]研究发现,用4种不同的乳腺癌细胞系MCF-7、SK-BR-3、MDA-MB-468、BT-549和一种非致瘤性乳腺上皮细胞系(MCF10A),将这些细胞分别用10、5、2.5 μmol·L-1浓度的UA处理48 h,计算抑制浓度IC50,发现UA对乳腺肿瘤细胞具有选择性毒性,对MCF-7的细胞毒性最大,对MCF-10A细胞的细胞毒性相对较低,且UA通过上调死亡受体DR4和DR5选择性地激活外源性凋亡途径,最后导致乳腺癌细胞凋亡。
1.2 抗肝癌 Son等[8]在研究中检测了AMP-活化蛋白激酶(AMPK)和糖原合成酶激酶3β(GSK3β)在UA诱导的HepG2肝细胞癌细胞凋亡中的作用。UA在HepG2细胞中显著增加亚G1群体和乙锭同型二聚体和末端脱氧核苷酸转移酶(TdT)介导的dUTP缺口末端标记阳性细胞的数量。此外,熊果酸增强了PARP和caspase-3的裂解,下调HepG2细胞中星形胶质细胞升高基因(AEG-1)和存活蛋白的表达,增加了AMPK和乙酰辅酶A羧化酶(ACCase)的磷酸化,并且还增强了无活性形式丝氨酸9处GSK3β的磷酸化,减弱了HepG2细胞中AKT和mTOR的磷酸化,研究中还发现AMPK抑制剂化合物C或GSK3β抑制剂SB216763阻断了HepG2细胞中UA诱导的PARP和caspase-3的裂解。此外,蛋白酶体抑制剂MG132在HepG2细胞中抑制AMPK活化,GSK3β磷酸化,切割PARP和降低由UA诱导的AEG-1。结果表明,UA通过AMPK活化和GSK3β磷酸化作为有效的化学预防剂诱导HepG2细胞凋亡。研究表明[9]不同浓度UA对人肝癌HepG2细胞的增殖均有抑制效应,并呈剂量、时间依赖性,用浓度为60 μmol·L-1的UA作用于人肝癌细胞株HepG2 72 h后达到最大细胞凋亡率。UA可明显增加G0/G1期的细胞含量,诱导人肝癌细胞株HepG2的凋亡。UA可抑制pERK1/2蛋白、Cyclin D1蛋白的表达,并随着浓度、时间逐渐上调抑制作用更加明显,促进癌细胞凋亡。Liu等[10]实验显示,在肝癌中信号转导和转录蛋白STAT3具有组成型活性,临床上没有批准用于治疗或预防肝癌的STAT3抑制剂,在人肝癌细胞系(Hep3B、HEPG2、SSMC-7721和Huh7)中检测了UA对STAT3磷酸化的抑制作用,显示UA可以抑制细胞增殖、迁移、体外集落形成以及体内肿瘤生长,并且UA可通过抑制白细胞介素-6(IL-6)诱导的P-STAT3,降低STAT3的下游靶基因(例如Bcl-2、Bcl-xl和存活蛋白)的表达,从而在体外和体内抑制STAT3活化和人肝癌细胞的生长。环氧合酶-2(COX-2)是一种多功能分子,其可在肝细胞癌中过度表达,并参与炎症和抗炎过程,前列腺素E2(PGE2)作为COX-2的下游产物经常参与炎症的发生,用不同浓度UA干预HepG2细胞,Liu等[11]用反转录-聚合酶链(RT-PCR)法,蛋白质印迹(Western blot)和酶联免疫吸附法(ELISA)分析UA的作用,结果显示UA显著降低COX-2的表达,并可降低HepG2细胞中PGE2的浓度,说明UA可通过下调COX-2的表达抑制肝癌细胞的增殖。
1.3 抗肺癌 罗敏等[12]研究表明,UA可以显著抑制人肺癌PC9细胞的活力,随着给药剂量和时间的增加,UA对PC9细胞的生长抑制率显著增加,UA并诱导PC9细胞自噬体表达增加、诱导微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)和自噬相关蛋白5(ATG5)表达增加,最后诱导细胞发生自噬。付伦等[13]研究报道,不同浓度的UA作用肺癌细胞株A549及SPCA1细胞时,可上调细胞周期抑癌基因p27和p16的表达,下调Cyclin D1蛋白和细胞周期E蛋白(Cyclin E)的表达,将细胞周期阻滞在G0/G1期,从而抑制细胞的增殖。Wu等[14]研究表明,UA可通过c-Jun氨基末端激酶(JNK)/应激活化蛋白激酶(SAPK)介导的特异性蛋白1(SP1)抑制肺癌NSCLC细胞的生长,这一过程反过来导致DNA甲基转移酶1(DNMT1)和组蛋白-赖氨酸N-甲基转移酶(EZH2)的表达受到抑制,DNMT1的过度表达减少,EZH2蛋白表达减少。此外SP1和DNMT1对SAPK/JNK信号的负反馈调节作用,以及EZH2和DNMT1的相互作用有助于UA的整体效应,最后导致UA抑制NSCLC细胞的生长。Gao等[15]前期实验显示UA能够抑制体外人肺癌A549细胞的增殖,将裸鼠接种A549细胞后,给予浓度为50 mg·kg-1和100 mg·kg-1的UA,显示UA可下调基质金属蛋白酶2(MMP-2)、核蛋白质MKI-67基因(MKI-67)和高度糖基化的跨膜细胞糖蛋白(CD34)蛋白的表达水平,并上调凋亡基因Bid的表达,即UA可抑制A549癌细胞活力与增殖。此外Kim等[16]报道了UA通过抑制肺癌细胞中的牛痘相关激酶1(VRK1)介导的损伤修复而发挥抗癌活性。VRK1是肺腺癌的主要调节因子,被认为是适应性的关键分子途径,主要控制细胞存活,实验发现UA抑制催化作用是通过直接结合VRK1的催化结构域,降低VRK1的活性,并通过阻断VRK1诱导的肺癌细胞中53BP1病灶,从而达到抗癌作用。
1.4 抗胃癌 Kim等[17]研究表明,UA可有效诱导SNU-484人胃癌细胞凋亡,通过下调抗凋亡因子Bcl-2蛋白的表达,上调促凋亡因子Bcl-2相关X蛋白的表达和促进caspase-3蛋白的水解,并增加p38丝裂原活化蛋白激酶和c-Jun N末端激酶的活化,从而诱导SNU-484人胃癌细胞凋亡。此外,UA显著抑制SNU-484细胞的侵袭性表型并显著降低了其表达,诱导细胞凋亡并抑制胃癌细胞的侵袭性表型。Yang 等[18]研究结果表明,UA用于人胃癌BGC-823细胞时,以剂量依赖性方式引起细胞毒性。通过UA的亚细胞毒性浓度来测试胃癌中UA的放射增强功效,以及采用克隆形成存活率测定确定UA放射敏感性,结果发现结合组的幸存部分照射和亚细胞毒性与照射组相比UA显著降低,实验结果表明,UA可增强BGC-823细胞生长周期G2/M期阻滞、增加活性氧(ROS)表达、下调Ki-67蛋白水平,抑制人胃癌BGC-823细胞的增殖。
1.5 抗前列腺癌 贺安东等[19]研究表明,前列腺癌PC-3细胞饥饿时,自噬相关蛋白ATG5和自噬蛋白Beclin1(BECN1)的表达显著升高,UA作用PC-3细胞后,PC-3细胞中ATG5蛋白和BECN1蛋白表达显著下调,提示UA可明显抑制其自噬。在该实验中进一步检测凋亡相关蛋白,发现UA作用PC-3细胞后,PC-3细胞中促凋亡因子caspase-3、caspase-8和caspase-9蛋白水平显著升高,凋亡率显著升高,表明UA作用后的PC-3细胞凋亡易感性明显增加,提示UA可抑制前列腺PC3细胞发生自噬,并进一步通过促进凋亡因子的分泌诱导其凋亡。Gai等[20]实验结果表明,UA可抑制细胞生长,诱导细胞凋亡。UA可增加人前列腺癌DU145细胞中促凋亡因子caspase-3和caspase-9的活性,UA处理DU145细胞后可影响细胞色素C(cytochrome C)蛋白在细胞质和线粒体中的表达,导致前列腺癌细胞中ROCK/PTEN信号传导和cofilin-1线粒体易位的抑制,促使细胞凋亡的激活。Meng等[21]的研究表明,用UA处理人前列腺癌细胞系LNCaP和PC-3后可抑制两种细胞系细胞的增殖,并诱导细胞凋亡。此外UA通过增加与膜联蛋白V结合,降低Bcl-2、Bcl-xl、存活蛋白和活化的caspase-3蛋白的表达水平,诱导细胞凋亡。UA作用DU145细胞后还可抑制PI3K蛋白的表达,抑制Akt和哺乳动物雷帕霉素靶蛋白(mTOR)信号蛋白的磷酸化。此外,用UA作用后的细胞显著抑制无胸腺裸鼠中LNCaP前列腺肿瘤异种移植瘤的生长,这与抑制细胞增殖,诱导肿瘤细胞凋亡和降低PI3K下游因子如p-Akt的表达有关,即UA不仅可抑制细胞生长,还通过调节人前列腺癌细胞中的PI3K/Akt/mTOR途径诱导细胞凋亡。
1.6 抗结肠癌 Wang等[22]研究显示,UA可抑制人结肠癌细胞系SW480和LoVo细胞的增殖并诱导其凋亡。用浓度分别为60、40、20 μmol·L-1的UA作用SW480和LoVo细胞48 h后,发现UA通过抑制兔基质金属蛋白酶-9(MMP9)和上调钙粘蛋白(CDH1)的表达来抑制结肠癌细胞迁移,抑制癌细胞中Akt和细胞外调节蛋白激酶(ERK)的磷酸化,UA还显著抑制结肠癌细胞COX-2表达和PGE2产生,增加PARP,caspase-3和caspase-9的裂解,并触发细胞色素c从线粒体膜间隙释放到胞质溶胶中,最终诱导结肠癌细胞凋亡。江华等[23]的研究结果表明,UA对结肠癌HT-29细胞具有明显的抑制增殖和诱导凋亡作用,用浓度分别为20、40 mol·L-1的UA作用HT-29细胞24 h后,较多细胞呈凋亡特征性改变,此外,UA可将HT-29细胞阻滞于G1期,且随着UA浓度的增加,细胞凋亡率也相应增加。Lin等[24]的研究表明,UA可通过抑制多种信号通路抑制结肠直肠癌血管生成。采用CRC小鼠异种移植模型、鸡胚绒毛尿囊膜(CAM)模型,人结肠癌细胞系HT-29和人类脐静脉内皮细胞(HUVECs)作为实验对象,UA作用后可显著抑制肿瘤体积且对CRC小鼠的体重变化没有影响,表明UA可在体内抑制结肠癌生长而没有明显的毒性迹象。此外,UA作用CRC小鼠异种移植和CAM模型后,CRC小鼠肿瘤内的微血管密度(MVD)和CAM模型中血管总数减少,并呈剂量和时间依赖性地抑制HUVEC的增殖、迁移和血管形成,并抑制了关键的血管生成因子如内皮生长因子A(VEGF-A)和碱性成纤维细胞生长因子(bFGF)的表达,最后抑制结肠直肠癌血管生成。
1.7 抗其他肿瘤 膀胱癌:Gai等[25]的研究表明,UA作用人膀胱癌T24细胞48 h后,可改变抗凋亡因子磷酸化AKT(pAkt)、磷酸化核因子κB抑制蛋白α(pIκBα)、磷酸化核因子-κBp65(pNF-κBp65)和Bcl水平的表达情况。pNF-κBp65水平降低,Akt的丝氨酸-苏氨酸蛋白激酶(SKT)活性降低,抗凋亡因子Bcl-2表达下调,从而减少T24细胞凋亡的抑制。即UA可通过AKT/NF-κB信号传导抑制T24人膀胱癌细胞中的细胞凋亡,并以剂量依赖性方式发生。口腔癌:Chen等[26]建立了人顺铂抗性口腔癌CAR细胞系,用UA处理CAR细胞48 h,采用流式细胞术检测并观察到活性氧物质的产生和线粒体膜电位的丧失,且UA降低了细胞凋亡相关信号AKT(Ser473)和Bcl-2相关的细胞死亡激动剂(BAD,Ser136)的磷酸化,以及Bcl-2蛋白水平,并增加了CAR细胞中BAD和Bcl-2相关X蛋白的表达,即UA通过半胱天冬酶依赖性途径介导诱导细胞死亡。胆囊癌:Weng等[27]的实验使用膜联蛋白V/PI双染色法和流式细胞术检测UA对GBC-SD和SGC-996细胞的细胞凋亡与细胞周期的变化,染色结果显示UA诱导细胞凋亡发生在早期和晚期,且在两个细胞中均观察到S期停滞,实验通过在裸鼠中建立异种移植GBC模型,腹腔注射UA后可显著抑制裸鼠移植瘤的生长,且抑制效率与剂量有关,验证了UA可以显著抑制胆囊癌细胞的生长。人骨肉瘤:Zhang等[28]的研究结果表明,UA作用人骨肉瘤OS 143B细胞后,可以抑制143B细胞的增殖,阻滞143B细胞的细胞周期、并抑制OS肿瘤的生长,最后诱导细胞凋亡。实验中建立小鼠异种移植模型,使用荧光素酶报告基因测定,UA作用143B细胞后明显抑制Wnt/β-联蛋白信号传导,且以浓度依赖性方式增加p53蛋白的表达水平,p53的抑制部分地逆转了UA诱导的β-连环蛋白的下调,提示UA可以通过激活Wnt/β-catenin信号来抑制OS 143B细胞的增殖,部分可能是通过上调p53的表达来介导的。皮肤癌:Junco等[29]的研究表明,用Ca3/7皮肤癌细胞,给予不同浓度UA作用后,采用噻唑蓝(MTT)法测定细胞活力,LDH检测细胞死亡,分析结果显示UA可抑制Ca3/7皮肤癌细胞的增殖,并促使细胞凋亡。此外,Junco等[30]的实验结果表明,与皮肤乳头状瘤细胞(MT1/2)相比,皮肤癌细胞(Ca3/7)显示出对熊果酸诱导的细胞毒性具有更强的抗性,在Ca3/7细胞中P-糖蛋白(P-gp)水平升高,这是一种依赖于ATP的外排泵,UA作用Ca3/7细胞后可快速地排出P-gp,而P-gp可以增强熊果酸介导的细胞毒性,用P-gp抑制剂维拉帕米或环孢素A攻击Ca3/7细胞,发现UA能通过抑制P-gp介导外流来体现诱导细胞的毒性作用。人胰腺癌:Prasad等[31]的研究结果表明,在体外用浓度为20 μmol·L-1的UA作用胰腺癌细胞Panc-28细胞,体内将裸鼠原位植入Panc-28细胞进行造模,裸鼠模型口服浓度为250 mg·kg-1的UA,实验用RT-PCR法、Western blot法、ELISA法分析,结果显示UA可抑制肿瘤增殖生长标志物(Ki-67)和微血管密度(CD31)的生长,并抑制核转录因子NF-κB的活化和STAT3的表达,即UA可以抑制人胰腺肿瘤的生长,并通过抑制炎症生物标志物抑制细胞增殖、侵袭、血管生成和转移。
2 熊果酸衍生物抗肿瘤作用
2.1 熊果酸的A环开环及引入杂环 有研究表明,熊果酸的A环开环及引入杂环后可增加抗肿瘤活性。Mendes等[32]制备了一系列新的熊果酸A环切割的熊果酸衍生物(结构图见图2),并使用2D和3D培养模型评估了它们在非小细胞肺癌(NSCLC)细胞系中的抗增殖活性,发现在C3处具有仲酰胺裂解的A环熊果酸衍生物(化合物1)是抗肿瘤活性最好的化合物,该化合物通过降低caspase-7、caspase-8以及Bcl-2蛋白的表达诱导细胞凋亡,此外,还可上调Beclin-1和LC3A/B-调蛋白的表达水平,及下调mTOR和p62蛋白的表达水平,诱导细胞自噬。裴婷等[33]将熊果酸A环开环,通过经典的酯化反应将查耳酮拼接到熊果酸上合成一系列衍生物,选取鼻咽鳞癌CNE2细胞、口腔表皮样癌KB细胞、乳腺癌 MCF-7、肺腺癌A549细胞和肝癌HepG2细胞为测试细胞株,采用MTT法对合成的查耳酮类化合物进行抗肿瘤活性检测,发现其对上述肿瘤细胞均有抑制活性,尤其是对乳腺癌有较强的抑制活性和选择性,且效果强于熊果酸。
王玉英等[34]合成4个杂环熊果酸化合物:吲哚并(3,2-b)熊果酸(化合物2)、喹啉并(3,2-b)熊果酸(化合物3)、吡嗪并(2,3-b)熊果酸(化合物4)、喹喔啉并(2,3-b)熊果酸(化合物5),选取乳腺癌MCF-7细胞、前列腺癌PC-3细胞、胃癌BGC-823细胞和口腔表皮样癌KB细胞作为测试细胞株,采用MTT法对化合物2、3、4、5进行生物活性测试,结果表明,在熊果酸A环引入喹喔啉基团能够显著地增加抗肿瘤活性,且抗肿瘤活性强于先导化合物熊果酸,而引入喹啉、吲哚和吡嗪基团却没有明显地增加抗癌活性,结果提示在熊果酸的A环引入杂环,其抗肿瘤活性明显高于非杂环的熊果酸衍生物。

图2 熊果酸衍生物结构图
2.2 熊果酸C-3、C-28位结构修饰 刘涵等[35]通过乙酰化反应对熊果酸的3-位羟基进行保护后,再将其28-位羧基制备成酰氯并与氨基酸酯反应,最后在碱性条件下水解制备得28-位羧基被修饰的熊果酸衍生物,实验采用MTT法测试合成的熊果酸衍生物抑制肿瘤细胞U937、HL-60、K562、DU145、EC109、MDA231和SMMC7721细胞株的增殖活性,结果显示熊果酸28-位羧基进行延长修饰,有利于提高熊果酸的抗肿瘤活性,当延长7~8个碳原子,合成的化合物熊果酸-28-酰-(4-氨基)苯甲酸(化合物6,结构图见图3)抗肿瘤效果最好。孟艳秋等[36]将熊果酸C-3位羟基改造成羰基、乙酰氧亚氨基,同时C-28位引入芳香氨基或含氮杂环形成酰胺得到一系列熊果酸衍生物,实验采用肿瘤细胞株HeLa、HepG2和BGC-823细胞作为研究对象,采用MTT法对其进行初步的体外抗肿瘤活性研究,结果显示该类化合物对上述肿瘤细胞增殖具有一定程度的抑制作用,其抗肿瘤活性均明显高于熊果酸,即合理修饰熊果酸C-3位和C-28位,对熊果酸抗肿瘤活性有较大影响。Meng等[37]报道了在熊果酸的C-3、C-11和C-28的位置设计并合成了一系列新的衍生物,使用红外吸收光谱(IR)、质谱(MS)和氢核磁共振(1H-NMR)以及元素分析确认它们的结构,将合成的熊果酸衍生物分别给予不同浓度作用肿瘤细胞株HeLa、BGC-823和SKOV3细胞,将细胞培养72 h,用MTT法在490 nm波长下测量吸光度计算IC50,结果显示新生成的化合物均表现出比熊果酸具有更强的细胞生长抑制作用。此外,Pattnaik等[38]研究报道,将熊果酸骨架进行新的化学修饰、设计,合成具有适当C-28的叠氮基丙基-3β-羟基-β-12-蒽-28-酸盐炔丙醇,将合成的化合物用于乳腺癌细胞系(MCF-7和MDA-MB-231)的细胞增殖试验。IC50数据显示合成的化合物对两种测试细胞具有较强的抑制活性,与MCF-7细胞相比,对MDA-MB-231细胞系的抑制活性更高,为熊果酸的2.9倍。
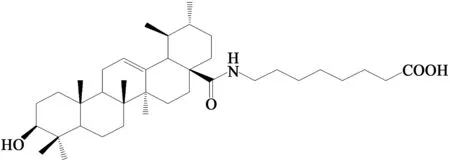
图3 化合物6结构图
2.3 其他熊果酸衍生物 顺式-3-O-β-羟基肉桂酰熊果酸(HCUA)(化合物7,结构图见图4),Wang等[39]研究发现HCUA在口腔癌细胞系(Ca9-22和SAS细胞)中呈现出较强的抗增殖和凋亡诱导活性,对两种细胞的IC50抑制浓度分别为24.0和17.8 μmol·L-1,且在正常口腔成纤维细胞中不表现出抗增殖活性。此外,在两种口腔癌细胞系中,HCUA以浓度依赖性方式增加亚G1期阻滞期细胞数和促进细胞凋亡,但不影响正常口腔成纤维细胞的增殖。此外,HCUA诱导p53介导的促凋亡蛋白(Bax、Bak、Bim、Noxa和PUMA)的转录调节,且通过线粒体膜电位的丧失诱导口腔癌细胞凋亡,HCUA还可引发细胞内ROS的产生,其被确定参与由ROS抑制剂YCG063和N-乙酰基-L-半胱氨酸(NAC)引起的HCUA诱导的细胞凋亡。因此,HCUA通过引发ROS依赖性和p53介导的线粒体凋亡而对口腔癌细胞具有潜在的抗肿瘤活性。

图4 化合物7结构图
Mallavadhania等[40]研究显示,熊果酸当用N-溴代琥珀酰亚胺处理时,得到一系列环-C转化产物,将合成的化合物对前列腺PC3细胞、白血病THP1细胞,宫颈HeLa细胞和肺A-549癌细胞系进行细胞毒性实验,给予4种细胞浓度为20 μmol·L-1的不同受试物,用MTT法检测细胞的抑制率IC50,结果显示合成的化合物对PC3细胞、A-549细胞、THP1细胞和HeLa细胞的增殖均具有明显的抑制作用。
3 总结
作为一种天然的抗肿瘤化合物,熊果酸具有毒性小、不良反应少等优点,具有很强的抗肿瘤效果,但不溶于水的物理性质,导致其生物利用度低。将熊果酸进行结构修饰和改造后,不仅获得生物利用度更好的抗肿瘤化合物,也为今后设计抗肿瘤活性更佳的熊果酸衍生物提供了指导。

