经皮腰椎内镜手术ERAS实施流程专家共识
毛海青 周非非 蔡思逸 孙浩林 张志成 孟浩 杜培 孙维 郭航 丁琛 殷国勇 杨惠林* 刘浩* 贺宝荣 孙宇* 李淳德* 沈建雄* 孙天胜* 邱贵兴*
(1.苏州大学附属第一医院骨科,江苏苏州 215006;2.北京大学第三医院骨科,北京 100191;3.中国医学科学院北京协和医学院北京协和医院骨科,北京 100730;4.北京大学第一医院骨科,北京 100034;中国人民解放军总医院第七医学中心5.骨科,6.麻醉科,北京 100700;7.四川大学华西医院骨科,成都 610041;8.南京医科大学第一附属医院骨科,南京 210029;9.西安交通大学附属红会医院脊柱外科,西安 710054)
随着经皮脊柱内镜技术的发展和器械的改进,经皮腰椎内镜手术逐步成为治疗腰椎间盘突出症和腰椎管狭窄症的主要微创术式[1-3]。与传统开放手术相比,腰椎内镜手术具有软组织损伤小、术中出血少、术后脊柱功能恢复快等优势,近年来得到迅速发展[4-7]。但也应该看到,由于脊柱内镜技术临床应用时间相对较短,各地技术水平参差不齐,缺乏相关的技术准入标准和系统培训等问题,临床实际应用过程中手术适应证把握不严,围手术期处理草率,手术并发症屡见不鲜,这导致部分患者临床疗效欠佳。加速康复外科(enhanced recovery after surgery,ERAS)通过多学科协作,优化围手术期处理措施,能有效减少手术相关并发症,促进患者康复[8,9]。将ERAS理念引入经皮腰椎内镜手术的围手术期管理,制定符合其临床特点、导向明确的个性化ERAS 临床路径,能够规范此类患者的诊疗过程,提高临床疗效,改善远期预后。经全国脊柱外科专家组多次讨论,在循证医学的基础上,针对腰椎内镜手术的ERAS实施流程达成共识,供广大脊柱外科医师及相关学科人员在临床工作中参考应用。该流程的实施需脊柱外科医师、麻醉医师、康复医师、病房护士及手术室护士等组成的多学科团队配合完成,为了更便于临床操作,特制定各科室成员的表单,详见表1~5。
1 经皮腰椎内镜手术的定义
经皮腰椎内镜手术主要适用于腰椎间盘突出症和腰椎管狭窄症的1~2个节段的微创减压手术,包括经皮脊柱内镜腰椎间盘摘除术(percutaneous endo⁃scopic lumbar discectomy,PELD)和经皮脊柱内镜腰椎管减压术(percutaneous endoscopic lumbar spinal decompression,PELSD)。
根据入路的不同,PELD 通常分为经椎间孔入路椎间盘摘除术(percutaneous endoscopic transforami⁃nal discectomy,PETD)和经椎板间入路椎间盘摘除术(percutaneous endoscopic interlaminar discectomy,PEID)。
2 经皮腰椎内镜手术目的及围手术期ERAS进程的主要问题
腰椎间盘突出症和腰椎管狭窄症是最常见的腰椎退行性疾病,基本病理表现是椎间盘退变突出、关节突增生内聚、黄韧带肥厚等,以腰腿痛为主要临床表现。手术目的是解除马尾神经和相关神经根的压迫,改善患者症状,促进神经功能恢复,提高患者生活质量。
虽然经皮脊柱内镜手术是微创手术,患者术后康复较快,但也存在着一定的手术风险和手术并发症。如何减少围手术期患者心理、生理的应激反应,帮助患者加速康复,将涉及以下几个主要问题:术前精确诊断,术中疼痛管理,手术入路选择,手术安全操作和术后康复指导。
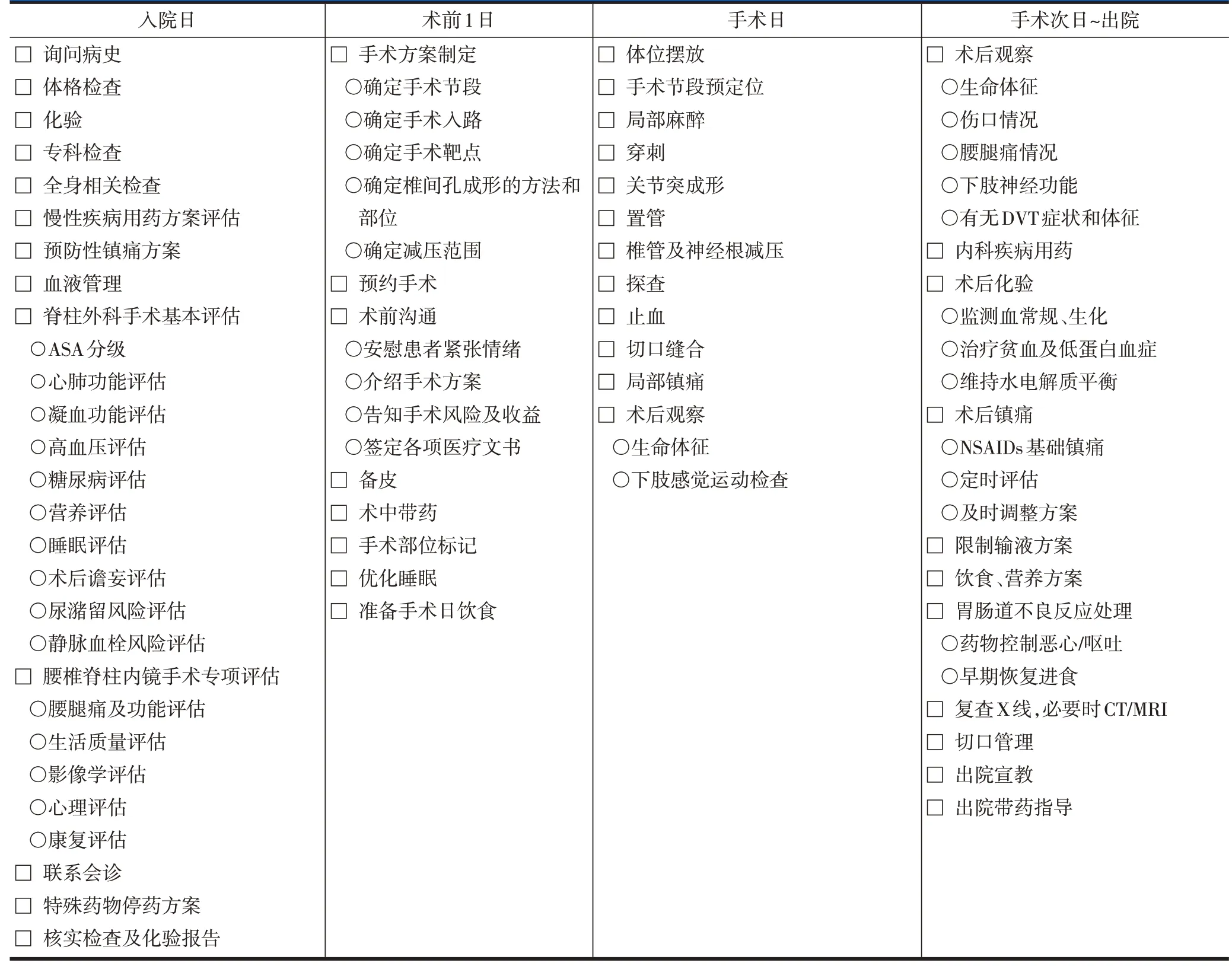
表1 腰椎脊柱内镜手术ERAS实施流程——外科医师表单
3 精确诊断和定位
多数情况下,根据病史、体检和影像学检查可以确定引起患者症状的责任节段和神经。但是对于多节段病变的患者,特别是一些临床表现与影像学检查不相符的病例,需要借助神经电生理检查[10]、诊断性介入操作如腰椎间盘造影、选择性的腰骶神经根阻滞术[11,12]、腰椎关节突关节封闭术、腰脊神经后内侧支阻滞术[13]、骶髂关节封闭术等技术帮助诊断。功能影像学技术如磁共振弥散张量成像技术(diffusion tensor imaging,DTI)可清楚地显示神经根走行和受压的情况,有助临床诊断和定位[14]。
4 评估
虽然经皮腰椎内镜手术创伤小,对患者内环境干扰较少,但仍需要对患者进行全面评估,及早发现潜在问题,使手术准备充分,从而提高手术的安全性。经皮腰椎内镜围手术期ERAS实施策略应“从评估开始,以评估结束”。
4.1 脊柱外科手术基本评估
4.1.1 美国麻醉医师协会(American Society of Anesthe⁃siologists,ASA)分级评估:根据ASA 分级对患者全身健康情况与疾病严重程度进行评估,初步判断患者对围手术期应激反应的耐受力[15]。
4.1.2 心肺功能评估:采用美国纽约心脏病学会(New York Heart Association,NYHA)心功能分级和代谢当量(metabolic equivalent of task,MET)评估患者心功能。常规检查胸片判断有无呼吸系统合并症。对于疑有呼吸功能异常患者通过肺功能检查判断有无通气及换气功能障碍。通过屏气试验评估患者的心肺储备能力,预测其对缺氧的耐受性。
4.1.3 凝血功能评估:通过病史采集、体格检查及术前实验室凝血功能检查可发现患者是否存在可能增加围手术期出血的相关疾病。
4.1.4 血糖评估:建议将空腹血糖控制在5.6~10.0 mmol/L之间,随机血糖应控制在12.0 mmol/L以内[16]。术前应将原有降糖方案过渡至胰岛素,并根据禁食情况减去控制餐后血糖的胰岛素剂量。糖尿病患者手术当日停用口服降糖药和非胰岛素注射剂,停药期间监测血糖,使用常规胰岛素控制血糖水平[17]。
4.1.5 高血压评估:术前了解患者高血压病因、病程、程度、靶器官受累情况。建议择期手术前中青年患者血压<130/85 mmHg,老年患者<140/90 mmHg 为宜。合并糖尿病的高血压患者,应降至130/80 mmHg以下[16]。必要时请心内科医师会诊并指导治疗。
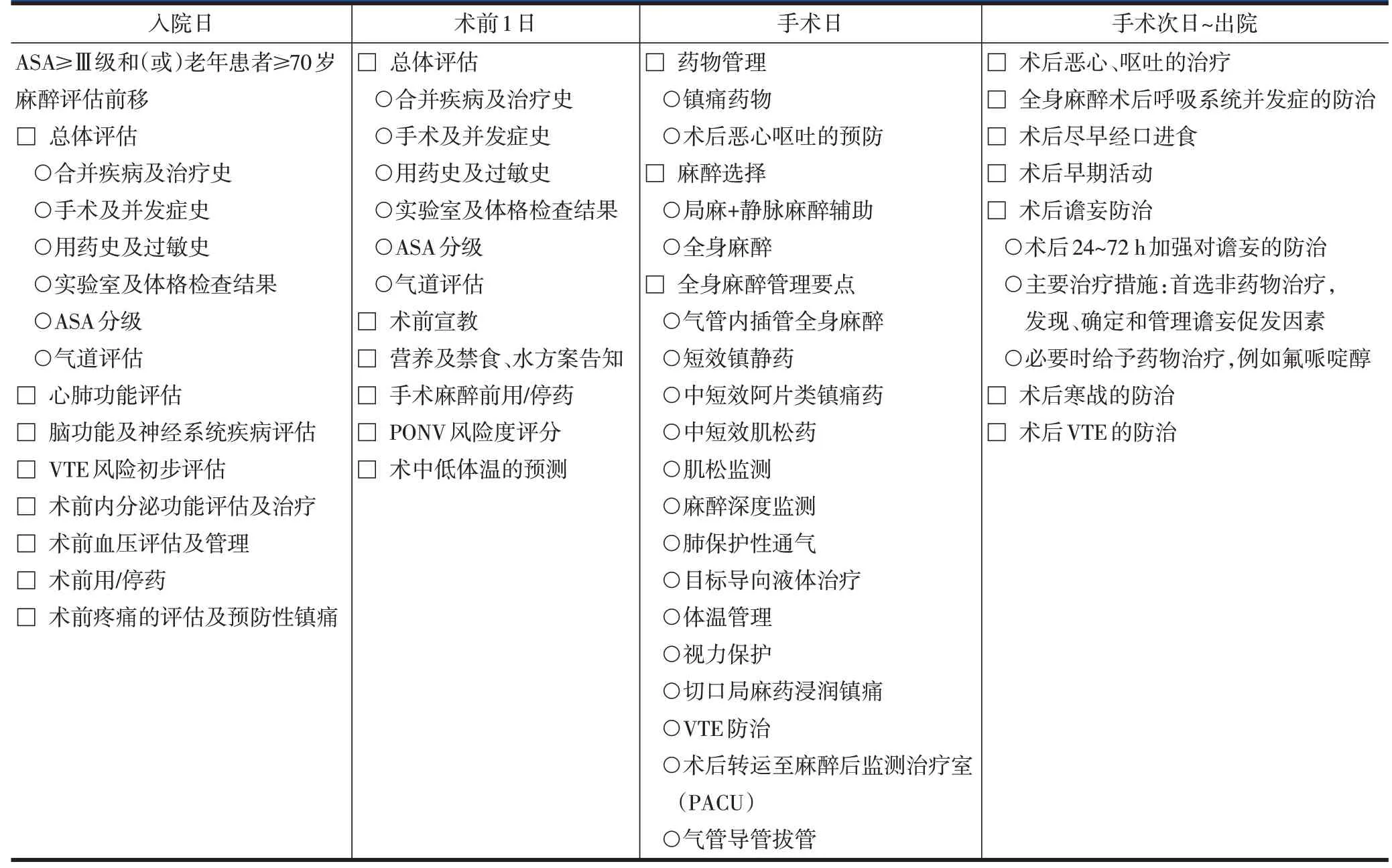
表2 腰椎脊柱内镜手术ERAS实施流程——麻醉医师表单
4.1.6 营养评估:术前进行营养风险筛查,采用欧洲肠内肠外营养协会NRS2002量表(Nutrition Risk Screen⁃ing 2002)评估手术患者是否存在营养风险。以NRS评分≥3 分者,存在营养风险,请营养科介入,制定营养治疗计划。
4.1.7 术后恶心呕吐(postoperative nausea and vomit⁃ing,PONV)风险评估:对于女性、不吸烟、晕动症或既往有恶心呕吐病史,以及术后应用阿片类药物的患者[18],注意识别并采取相应的防治措施。
4.1.8 术后谵妄(postoperative delirium,POD)易感因素评估:高龄、认知功能障碍、合并多种内科疾病、摄入减少、生理功能储备减少、多种药物应用、酗酒为术后谵妄的易感因素[19],对于此类人群应识别并采取相应的预防措施。
4.1.9 尿潴留风险评估:对于年龄>50 岁、男性、术前存在尿道梗阻症状和与尿潴留相关的神经性疾病以及围手术期应用抗胆碱能药物、β 受体阻滞剂的患者,可采用国际前列腺症状评分(international pros⁃tate symptom score,IPSS)评估术前膀胱功能,并预测术后尿潴留的风险[20,21]。
4.1.10 静脉血栓风险评估:对于瘫痪、高龄、肥胖、静脉曲张、脑梗死、血栓病史及家族史、D二聚体增高等具有深静脉血栓及肺栓塞高危因素的患者可采用Wells血栓风险评分表进行评估[22,23]。
4.2 经皮腰椎内镜手术专项评估
4.2.1 腰腿痛及功能评估:采用视觉模拟评分(visual analogue score,VAS)或者疼痛数字评价量表(numeri⁃cal rating scale,NRS)进行疼痛评估,包括疼痛的部位、持续时间、频率和强度等,并在围手术期各阶段和康复过程中进行多次评估,根据评估结果及时调整治疗方案。采用日本骨科协会(Japanese Ortho⁃paedic Association,JOA)评分和Oswestry 功能障碍指数(Oswestry disability index,ODI)等进行腰椎功能评估。
4.2.2 生活质量评估:推荐使用SF-36[24]或EQ-5D 调查问卷(EuroQol five dimensions questionnaire)[25]评价患者的生活质量。
4.2.3 影像学评估:对于拟行腰椎内镜手术的患者,常规拍摄腰椎正侧位片、动力位片,评估腰椎序列、生理弧度、椎间隙高度、骨赘增生情况,观察有无畸形、横突肥大、高髂嵴等影响经椎间孔穿刺置管的情况,并评估腰椎节段的活动度和稳定性;CT平扫/三维重建用于评估椎间盘钙化、椎体后缘骨赘、关节突增生、骨性椎管、椎间孔及侧隐窝的狭窄情况等;MRI扫描用于评估椎间盘变性或突出、黄韧带增厚、神经根受压情况,必要时进行增强MRI,并结合X线片和CT及其他实验室检查与脊柱感染和肿瘤相鉴别。
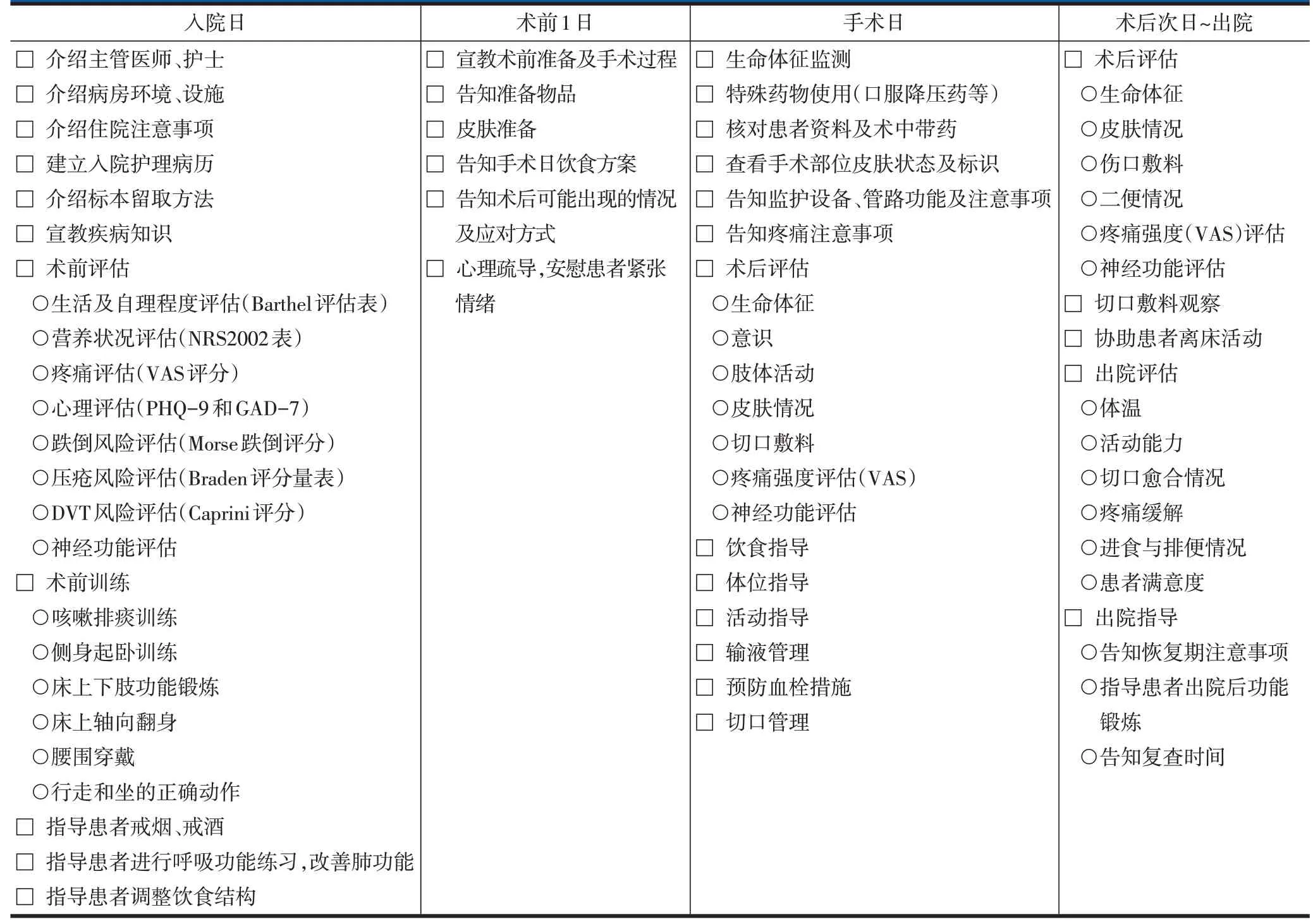
表3 腰椎脊柱内镜手术ERAS实施流程——病房护士表单
4.2.4 体位适应性评估:如果拟行局麻手术,需要对患者进行体位适应性评估。通常需要患者能俯卧不少于1 h 且疼痛可以耐受,没有胸闷和呼吸困难等症状。
4.2.5 心理评估:腰椎间盘突出症和腰椎管狭窄症患者由于疼痛导致的焦虑和抑郁症的发生率较高[26],而且术前抑郁和躯体焦虑程度与患者术后的功能恢复和生活质量呈负相关[27]。因此,如果术前不及时对患者心理状况进行评估和干预,将影响的患者康复过程。入院后可采用患者健康状况问卷-9(Patient Health Questionnaire-9,PHQ-9)[28]和广泛性焦虑自评量表-7(Generalized Anxiety Disorder 7,GAD-7)进行抑郁和焦虑自评,如果发现中度以上的焦虑和抑郁,需要采用汉密尔顿抑郁量表(Hamilton Depression Rating Scale,HAM-D)[29]和汉密顿焦虑量表(Hamil⁃ton Anxiety Rating Scale,HAM-A)进行评估,并咨询精神科医师,进行干预。
4.2.6 康复评估:对于所有患者都应进行康复评估,目的是制定分阶段、个体化的康复治疗方案。评估内容包括:①平衡功能:起坐试验[30]、功能伸展测试(functional reach test,FRT)[31]、起立行走试验(timed up-and-go test,TUG)[32];②日常生活活动(activity of daily living,ADL):改良Barthel 指数(modified Barthel index,MBI);③步态及辅助器械:目测分析法;④腰围类型评估。

表4 腰椎脊柱内镜手术ERAS实施流程——手术室护士表单
5 宣教
腰椎退行性疾病围手术期ERAS 倡导由外科医师、麻醉医师、病房与手术室护士、康复医师组成的多学科协作诊疗,应从患者入院后的综合宣教开始。通过宣教使患者了解腰椎退行性疾病发生发展的过程,开放和微创手术的利弊,腰椎内镜手术围手术期的相关知识及注意事项,康复锻炼的方法,术后可能出现的症状波动,以及复发的可能性、临床表现和相应对策。让患者熟悉手术、麻醉、护理、康复过程,了解可能遇到的困难及相应预案,从而调整患者的期望值,提高患者的依从性[33]。

表5 腰椎脊柱内镜手术ERAS实施流程——康复医师表单
通过宣教使患者学习并掌握包括疼痛自评在内的各种自我评估方法;拟行局麻手术的患者需要进行术中体位练习,以提高手术耐受力;掌握正确呼吸和咳嗽的方法;训练床上轴线翻身、床上移动、上下床、行走和坐的正确动作;学会在床上进行下肢功能锻炼;掌握佩戴和脱卸腰围的正确方法等。通过健康宣教,树立患者的自信心,提高患者参与诊疗过程的积极性,建立对加速康复的愿景。
6 麻醉要点
不论采取何种麻醉方式,均应对患者进行饮食管理,拟行局麻手术的患者亦不例外。麻醉前2 h停止口服清饮料,包括清水、糖水、碳酸饮料、清茶、黑咖啡(无奶)、无渣果汁等;麻醉前6 h 停止进食易消化固体,包括淀粉类食物和牛奶等乳制品,油炸、脂肪及肉类食物需要更长的禁食时间[34,35]。规范的饮食管理可以减少患者术前饥饿、口渴、紧张等不适反应,减少术后胰岛素抵抗,而且不增加麻醉风险[36],防止局麻手术转全麻开放手术时陷入被动。
优化围手术期麻醉管理策略有利于减少全身应激,对于提高围术期安全性、舒适性、降低围术期并发症至关重要[35,37]。对于ASA 评分≥Ⅲ级和(或)≥70岁的患者,临床医师有必要请麻醉医师提前介入,进行手术麻醉风险评估及建议,降低围手术期手术麻醉风险。
PEID 可采取局部浸润麻醉,单次硬膜外麻醉或者全身麻醉,PETD 通常采用局部麻醉,部分术者也采用全身麻醉+神经电生理监护。局麻药通常由短效局麻药(利多卡因)加长效局麻药(罗哌卡因)按一定比例混合而成,结合静脉给予镇痛镇静药物(如帕瑞昔布、氟比洛芬酯、芬太尼、右旋美托咪啶等)可取得较好的镇痛效果。局麻药应逐层给药,特别是皮肤、深筋膜、关节突附近应充分浸润,但应避免椎管内和神经根部位的阻滞麻醉。每次注射局麻药前应回抽,避免将药物直接注入血管内,并控制用药剂量,以防局麻药毒性反应。静脉给药时应密切观察患者反应,避免误吸和呼吸抑制。术毕切口缝合前局部注射长效局麻药物(如罗哌卡因)可有效减轻术后伤口疼痛。
对于年龄较大的腰椎管狭窄症患者,如果采用全身麻醉,宜采用保护性肺通气策略,低Vt(6~8 ml/kg),中度PEEP(5~8 cmH20),FiO2<60%,吸呼比1∶(2.0~2.5),呼吸频率8~12 bpm。间断性肺复张性通气是防止肺不张的有效方法,应该至少在手术结束、气管拔管前实施1 次[35]。高龄患者给予有创循环监测,必要的麻醉深度监测如脑电双频指数(bispectral index,BIS)等。
经皮腰椎脊柱内镜手术出血极少,因此术中输液以晶体液为主,输液速度1~2 ml/(kg·h),避免因容量负荷过多导致组织水肿[38]。对于心肺功能不全的患者,在维持重要器官有效灌注的前提下,应适当减少液体量。
7 手术入路的选择
PETD 适用于腰椎各节段大多数类型的椎间盘突出症以及传统开放手术治疗后椎间盘突出复发[39],但对椎管内巨大型脱出,高度脱垂游离型的椎间盘突出,钙化型椎间盘突出,高髂嵴的L5-S1 椎间盘突出以及严重腰椎间孔骨性狭窄的病例,失败率相应增高[40,41],需要术者具备丰富脊柱内镜手术经验和必要的硬件设备方能开展[42]。
PEID 主要适用于L4-L5 和L5-S1 椎间盘突出症,包括中央型、旁中央型、肩上型和腋下型椎间盘突出,脱垂游离型椎间盘突出[43]。因椎板间隙宽度、椎管容积的限制,一般不适用于L4 以上的椎间盘髓核切除,也不能用来处理椎间孔型、极外侧型椎间盘突出。在脊柱内镜治疗腰椎管狭窄症时,经椎板间入路脊柱内镜手术适用于侧隐窝和中央型狭窄的病例[44,45],以间歇性跛行为主要症状的中央型腰椎管狭窄可采用单侧入路双侧减压[46],双侧均有根性症状的病例建议双侧入路;经椎间孔入路适用于侧隐窝和椎间孔狭窄的病例[47]。
8 手术要点
8.1 手术准备
手术一般采取俯卧位。少数症状重的患者以及心肺功能不佳的高龄患者,对俯卧位不能耐受,则可采取侧卧体位,但须注意侧卧位时术中患者容易改变体位影响穿刺准确性。侧卧位时患侧向上,用圆形靠垫支撑腰部,使患侧椎间孔张开。俯卧位时使用腹垫或Wilson 支架使腹部悬空,消除腰椎生理前凸,使椎间孔或椎板间隙打开[48]。调整球管位置获得手术节段标准的正侧位影像,按术前计划在患者体表画好标志线和穿刺点。PETD 旁开距离需根据患者体型、椎间孔形态、髓核突出位置确定。体型肥胖的患者旁开距离应该相应增大,向尾侧移位的椎间盘突出的穿刺点应更靠近头侧,而极外侧椎间盘突出患者的穿刺点更靠内。
8.2 安全操作技术
穿刺、椎间孔成形和放置工作套管均应在C型臂X 线机引导下进行,反复透视正侧位以确定工具位置。根据患者反馈及时调整手术操作,不要在患者出现明显根性症状的情况下盲视操作。摘除髓核时应在内镜视野范围内进行,避免在视野盲区操作误伤附近的神经结构。发现硬膜撕裂后应在短时间内终止手术,避免长时间的硬膜内水压灌注导致颅内高压等不良后果。手术结束前应妥善止血,防止术后硬膜外血肿形成。
8.2.1 安全穿刺:针对突出/狭窄的部位设计手术入路,避开神经根所在的位置进行穿刺[49]。清晰的术中透视影像是安全穿刺的前提,术前应调整患者体位和C型臂X线机球管的位置,获得手术节段标准的正侧位影像。手术操作时应始终在正侧位透视监视下进行。侧位透视穿刺针到达椎间盘之前,正位透视穿刺针尖通常不应超过椎弓根内缘连线。
8.2.2 预防硬膜和神经根损伤:由于国人椎间孔前后径相对较小,直接将工作套管放入Kambin 三角可能挤压穿出神经根造成损伤,特别是在L4-L5和L5-S1的椎间孔区域[50,51]。因此,经椎间孔入路时,需根据突出或狭窄的部位,切除相应水平的上关节突前缘、侧隐窝或椎弓根上缘的部分骨质,进行椎间孔成形,为工作通道的安全置入创造条件。对于腰椎管狭窄的患者,可以通过多次成形,切除上述区域的骨性狭窄部分,进行椎间孔和侧隐窝的减压。在透视引导下使用逐级环锯对椎间孔扩大成形是目前常用的的方法,但在成形过程中有损伤神经根的风险[52]。通过改进穿刺技术,使用环锯保护套、偏心环锯等设备可以实现安全有效的椎间孔成形[53]。在此基础上开发的直视下椎间孔成形技术,如可视环锯、镜下动力、导航下置管成形等技术,提高了椎间孔成形的安全性,降低了神经根损伤的风险。
如采用经椎板间入路手术,建议在内镜监视下逐层打开黄韧带进入椎管显露神经结构[2],避免在透视下直接将工作套管放入椎管,该方法的硬膜撕裂,神经根损伤的发生率明显高于前者[54]。在进行椎管减压时,应先扩大椎板窗,处理增生内聚的关节突关节,然后再打开黄韧带进入椎管。完整的黄韧带能在处理骨性结构时有效地保护硬膜囊和神经根,避免操作过程中的意外损伤[45,47]。
局麻手术操作过程中,如果患者出现下肢放射性疼痛,应暂停操作,确认通道和器械位置与神经结构的关系,并做相应调整,也可以让台下助手观测相应神经根支配区域的感觉运动功能状况。不应在患者出现严重根性刺激症状的情况下强行操作,必要时候宁可放弃手术,避免术者在错误判断或者神经结构存在解剖异常的情况下盲目操作,从而导致神经根的损伤。
如果术中出现下列情况应及时转开放手术[54-56]:①患者无法耐受疼痛;②各种原因导致的穿刺或置管失败;③发现硬膜撕裂,估计短时间内无法完成手术;④硬膜破口较大或神经根损伤较重,需要手术修补;⑤器械在体内折断,无法通过内镜取出;⑥严重出血影响手术操作;⑦各种因素导致内镜手术无法实现有效的椎管和神经根减压。
8.2.3 避免髓核残留:PELD手术失败表现为术后症状未缓解或者术后6 周以内症状复发[41]。临床报道PELD术后早期再手术率高,不容忽视[57,58]。突出髓核残留和椎间隙处理不彻底是PELD 手术失败的主要原因。中央型巨大髓核突出、腋下型突出、髓核脱垂游离是PELD 术后髓核残留的主要类型[40,41],初学者应谨慎选择此类病例。手术结束前应确认神经根活动度良好,硬膜搏动恢复,术中髓核摘除量与MRI相当,并对盘外(肩上、腋下、神经根走行全程)和盘内(椎间隙)进行全面探查,避免髓核残留。
9 疼痛管理
提倡预防性镇痛的理念[59],对患者术前、术中和术后全程进行疼痛管理,预防外周和中枢敏化,降低术中应激和炎症反应,降低术后疼痛强度,减少急性疼痛向慢性疼痛的转化。术前镇痛措施主要包括使用不影响血小板功能药物,如对乙酰氨基酚、塞来昔布、氟比洛芬酯、帕瑞昔布或普瑞巴林;以及镇静或抗焦虑药物[60]。加强术前疼痛宣教,达成医患共识,使患者积极配合治疗,消除紧张焦虑情绪。术中采用多模式镇痛,联合作用机制不同的镇痛药物或镇痛方法,如采用局部浸润麻醉结合静脉注射镇痛镇静药物,可取得良好的术中镇痛效果,但应注意控制药物剂量和浓度,避免不良反应。术后由于大多数患者疼痛得到迅速缓解,可以减少甚至停用镇痛药物,通常不需要应用镇痛泵和阿片类药物。如果患者术后腰腿痛无明显缓解,应积极查找原因,必要时复查腰椎MRI,排除术中神经根损伤、髓核残留、手术节段定位错误等可能因素。
10 康复
术后早期康复训练有助于减轻患者术后疼痛,增加腰背肌力量,早日回归日常生活和工作[61,62]。通常术后4~6 h,腰椎内镜手术患者即可在医护人员指导下佩戴腰围或支具下床活动,但应注意采取正确的姿势和转移方法。起床活动时患者应保持腰背部挺直,避免弯腰、扭腰和提拎重物。术后早期可以进行神经根滑动练习预防慢性神经性疼痛,中后期可根据评估制定个体化康复锻炼方案,逐渐增加核心力量训练和核心稳定训练等。研究显示,全身躯干训练和特定的躯干肌肉训练(腰部多裂肌和腹横肌)均能改善肌肉功能和临床疗效[63,64]。
11 椎间盘突出复发的预防和处理
腰椎间盘突出症术后复发是指髓核摘除术后疼痛缓解6个月以上,再次出现同一节段同侧或对侧腰椎间盘突出症表现,髓核突出经影像学证实[65]。术后佩戴腰围保护,避免从事弯腰、负重等体力劳动,避免久站久坐等不良生活习惯,加强腰背肌和核心肌群锻炼,有助于减少PELD术后腰椎间盘突出症的复发[66]。症状复发后首先采取保守治疗,如果出现严重的腰腿痛、明显的神经根受压体征及影像表现,经严格保守治疗6~8 周无效,可以考虑手术治疗[65,67]。再次手术的减压范围及程度应根据初次手术及当前影像学显示的神经受压情况而定。如果伴有腰椎不稳或再次手术时切除了较多的骨性结构,可以考虑腰椎融合手术。
专家组成员(按姓氏笔画):
丁 琛 马亚群 王思亮 毛海青 刘西芳 刘 浩 刘 楠 闫 航 孙天胜 孙 宇 孙浩林
孙 维 杜 培 李 放 李 莉 李淳德 李 静 杨惠林 邱贵兴 邹叶芳 沈建雄 宋琳琳
张志成 张 蕾 陈 峰 苑 垒 周非非 周谋望 郑林宏 郑博隆 孟 浩 郝定均 洪 瑛
贺宝荣 殷国勇 郭 航 唐 帅 越 雷 韩 彬 嵇富海 蔡思逸
说明:本共识为《脊柱手术加速康复外科实施流程专家共识》系列共识之一,为了方便读者阅读,系列共识中的部分段落是重复的,不属于学术不端范围,特此说明。

