白首乌酵素发酵工艺的优化
,
(江南大学食品学院,江苏无锡 214122)
白首乌是萝藦科鹅绒藤属植物的块根,主要产于山东、江苏和四川等地。江苏滨海白首乌又称耳叶牛皮消,其含有多种活性成分和人体所有必需氨基酸等[1],具有抗肿瘤、抗衰老和保护肝脏等功效[2]。目前市售滨海白首乌的产品以首乌干片和精制首乌粉为主,该类产品的即食性较差且有明显的药材味。此外有研究表明,白首乌在制粉过程中有大量的营养和功效成分随废渣和废液流失,这种做法既浪费原料,又污染环境,从而导致白首乌资源利用不充分、产品的附加价值降低[3]。
酵素是采用一种或多种原料,经有益菌发酵的含有多种酶和次级代谢产物等成分的发酵产品[4],研究表明[5-7]其具有调节菌群平衡、清除体内垃圾和延缓衰老等功效。Feng等[8]对不同酵素进行了综述,表明植物酵素不仅对人类健康有益,还可以促进工业发展,其相关产品的开发具有潜在的发展前景。蒋增良等[9]从葡萄酵素中分离得到8株优势酵母菌;张梦梅等[10]的研究表明,天然植物酵素的优势菌种为酵母菌、醋酸菌和乳酸菌。乳酸菌发酵可以产生易于人体吸收的氨基酸和乳酸菌素等物质[11],并能提供大量的活菌,有利人体消化和促进肠道健康,此外还可以改善白首乌的药材味道;酵母菌发酵可以产SOD,该酶可以清除体内的超氧离子自由基,具有较强的抗氧化和抗衰老等作用;而醋酸菌发酵产生乙酸,不利于产品的风味,故选用乳酸菌和酵母菌作为本实验的发酵菌种。
本文首次以纯白首乌清汁为发酵基质,利用乳酸菌和酵母菌复合发酵研发了一种含有大量活菌的新型白首乌酵素。将鲜白首乌块根或首乌干片经蒸煮、打浆、双酶法水解和离心得到白首乌清汁,利用乳酸菌和酵母菌发酵制备酵素,此工艺可以有效减少白首乌传统制粉过程中营养和功效成分的损失。另外,乳酸菌和酵母菌发酵分别赋予了产品大量的活性乳酸菌和功效酶,同时也极大地改善了白首乌的不良风味。此外,高附加值产品的研发为江苏滨海白首乌资源的开发利用提供了一定的理论依据,对促进白首乌产业的发展具有重要意义。
1 材料与方法
1.1 材料与仪器
鲜白首乌块根、白首乌干片 江苏盐城陈氏食品有限公司;α-淀粉酶(酶活力2000 U/g)、糖化酶(酶活力100000 U/mL) 北京伊诺凯科技有限公司;嗜酸乳杆菌(Lactobacillusacidophilus,简称LA)、植物乳杆菌(Lactobacillusplantarum,简称LP)、保加利亚乳杆菌(Lactobacillusbulgaricus,简称LB)和嗜热链球菌(Streptococcusthermophilus,简称ST) 食品生物技术实验室提供;安琪酵母1(S1)、安琪酵母2(S2)、新良酵母(S3)、梅山酵母(S4)、尤乐博酵母(EDY) 市售;其余试剂 国药集团化学试剂有限公司。
FA2204B电子天平 上海第二天平厂;九阳料理机 山东九阳小家电有限公司;FA25实验室高剪切分散乳化机 上海弗鲁克科技发展有限公司;501型超级恒温水浴 上海实验仪器厂;JJ-1型定时电动搅拌器 江苏金坛市金城国胜实验仪器厂;WZS-Ⅰ型阿贝折光仪 上海实验仪器厂;CR21GIII高速离心机 天美(中国)科学仪器有限公司;EL20型实验室pH计 梅特勒-托利多仪器(上海)有限公司;ZHJH-C1209C超净工作台 上海智城分析仪器制造有限公司;THZ-85B气浴恒温振荡器 常州翔天实验仪器厂;DHG型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;T722型分光光度计 上海精密仪器厂;血球计数板 丹阳市健陵医疗器械有限公司。
1.2 实验方法
1.2.1 工艺流程

1.2.2 操作要点
1.2.2.1 白首乌浆料的制备 将鲜白首乌清洗干净,去皮并切成块状,厚度为2~3 cm;白首乌干片以1∶3的料水比在50 ℃下复水75 min。切块后的鲜白首乌或复水后的白首乌片于100 ℃下蒸煮30 min后按1∶9的料水比打浆,然后采用高剪切分散乳化机以10000 r/min的转速乳化10 s,重复三次,得到浆料。
1.2.2.2 双酶法水解 采用α-淀粉酶和糖化酶进行水解。液化条件为:α-淀粉酶添加量14 U/g、pH6.0、酶解温度65 ℃、时间60 min;糖化条件为:加酶量160 U/g、pH4.5、温度55 ℃、时间60 min。
1.2.2.3 发酵基质的制备 白首乌浆料酶解液于高速离心机中以8000 r/min离心30 min,得到白首乌清汁,然后调节清汁pH至6.0并灭菌备用。
1.2.2.4 菌种的活化与培养 乳酸菌的活化:取4 ℃下斜面保存的LA、LP、LB和ST于MRS培养基中,37 ℃下活化24 h,菌液待用。酵母菌活化:取一定量的干酵母于十倍体积的葡萄糖溶液(体积分数为5%)中,35 ℃下活化30 min,菌液待用。
1.2.2.5 接种与发酵 乳酸菌发酵:在白首乌清汁中分别接种3%的LA和LP,37 ℃发酵36 h,LB和ST的接种量为2%,其他条件相同。酵母菌发酵:在30 ℃、pH6.0的条件下,接种0.2%的酵母菌于装有40 mL白首乌清汁的250 mL锥形瓶中,以130 r/min振荡发酵24 h。按照1.2.5进行复合发酵,复合发酵结束后在4~8 ℃下低温静置12 h后发酵,使发酵液产香,得到白首乌酵素。
1.2.3 乳酸菌单独发酵 为了更准确地获得乳酸菌在白首乌清汁这种全新体系中的生长特点和基础发酵参数,本实验以LA、LP、LB和ST为乳酸菌发酵的菌种,在白首乌清汁中进行乳酸菌单独发酵实验。因为上述四种菌在白首乌清汁中生长较好,活菌数量较高,所以以活菌数为乳酸菌发酵的主要评价指标,对菌种的发酵时间和接种量进行优化,然后选择两种较优的乳酸菌进行配比发酵,确定最佳的复配比例。
1.2.3.1 发酵时间的确定 调整清汁初始pH为6.0,LA和LP以3%的接种量,在37 ℃下分别发酵6、12、18、24、30、36 h,结束后测定发酵液中乳酸菌活菌数。LB和ST的接种量为2%,其它条件同上。
1.2.3.2 接种量的确定 保证初始pH6.0、发酵温度37 ℃不变,LB、ST、LA和LP分别发酵12、18、18、30 h,探究不同接种量(1%、1.5%、2%、2.5%、3%、3.5%)对活菌数的影响。
1.2.3.3 菌种复配发酵 由于上述得到的LA和LP的最佳发酵时间不同,故以3%的接种量,将LA和LP按照不同的比例(3∶1、2∶1、1∶1、1∶2、1∶3)在37 ℃下分别发酵18、24、30 h,以活菌数为指标,确定复配比例和发酵时间。
1.2.4 酵母菌单独发酵 为了更好地获取酵母菌在白首乌汁中的生长特点和发酵参数,故以白首乌清汁为发酵基质进行酵母菌单独发酵实验。酵母菌是兼性厌氧型微生物,其发酵过程有有氧发酵和无氧发酵两个阶段,本文采用酵母菌发酵主要是为了得到较高的SOD活力,但由于无氧发酵会产生乙醇,而本课题后期会对产品的解酒功效进行研究,发酵液中乙醇含量越低越有利,所以将SOD活力和乙醇含量作为酵母菌发酵的主要评价指标。
1.2.4.1 发酵菌种和发酵时间的确定 以白首乌清汁为发酵基质,选择5种不同来源的酵母菌(S1、S2、S3、S4、EDY)进行实验,在初始pH6.0、装瓶量40 mL、接种量0.2%、发酵温度30 ℃的条件下,于130 r/min的摇床中分别发酵12、16、20、24、28 h,以SOD活力和乙醇含量为评价指标,确定最佳发酵菌种及其发酵时间。
1.2.4.2 接种量的确定 以S4为发酵菌种,在初始pH6.0、装瓶量40 mL,30 ℃下发酵24 h,探究不同接种量(0.05%、0.1%、0.15%、0.2%、0.25%、0.3%)对SOD活力和乙醇含量的影响。
1.2.4.3 初始pH的确定 保证装瓶量40 mL不变,以0.2%接种量,30 ℃下发酵24 h,探究不同初始pH(5.0、5.5、6.0、6.5、7.0)对SOD活力和乙醇含量的影响。
1.2.4.4 装瓶量的确定 酵母菌是需氧型菌种,体系含氧量对产酶能力影响较大,故在初始pH5.0、接种量0.2%、发酵温度为30 ℃和发酵时间24 h不变的条件下,改变装瓶量(30、40、50、60、70 mL),探究其对SOD活力和乙醇含量的影响。
1.2.4.5 蛋白胨添加量的确定 在装瓶量30 mL,初始pH5.0、接种量0.2%不变的条件下,30 ℃下发酵24 h,探究不同蛋白胨添加量(0、0.4%、0.8%、1.2%、1.6%、2.0%)对SOD活力和乙醇含量的影响。
1.2.5 复合发酵 乳酸菌和酵母菌复合发酵有以下三种方法:a. 在初始pH为6.0的白首乌清汁中同时接种3%的复合乳酸菌与0.2%的S4,37 ℃下一起发酵一定的时间;b. 先接种3%复合乳酸菌,37 ℃发酵24 h,再接种0.2%的S4,30 ℃发酵一定的时间;c. 先接种0.2%的S4,30 ℃下发酵24 h,再接种3%复合乳酸菌,37 ℃下发酵至特定的时间。以乳酸菌活菌数、SOD活力、酵母菌活菌数和乙醇含量为评价指标,对上述三种方法进行研究,确定最佳的接种顺序及该顺序下的发酵时间。
1.2.6 指标测定
1.2.6.1 乳酸菌的测定 参照GB 4789.35-2016《食品微生物学检验乳酸菌检验》[12]测定。
1.2.6.2 酵母菌的测定 采用血球计数板法[13],具体操作步骤为:首先,用75%的酒精和蒸馏水擦拭血球计数板(1 mm×1 mm,25×16型计数室),并用擦镜纸擦干待用;其次,用吸管吸取一滴菌液(含亚甲基蓝染色剂)于盖玻片的边缘,使菌液缓缓渗入,多余的菌液用吸水纸吸干,待酵母菌完全沉入计数室后用显微镜找到视野;最后,以计数室左上、左下、右上和右下4个中方格(100个小方格)的酵母菌数计数,每个样品计数三次并取平均值,根据公式:酵母菌数(mL)=每个中方格中酵母菌的平均数×稀释倍数×2.5×105计算酵母菌活菌数量。
1.2.6.3 pH 采用pH计测定发酵液的pH,按照说明书操作。
1.2.6.4 SOD活力的测定 按每克酵母湿菌体加入0.8 mL甲苯,35 ℃下破壁45 min,然后加入5 mL pH7.8的磷酸缓冲液(含0.1 mmol/L EDTA)提取5 h,再以4000 r/min离心5 min,分离出水相,10000 r/min离心15 min,收集上清液即为SOD粗提取液[14]。测定方法按照GB/T 5009.171-2003《保健食品中超氧化物歧化酶(SOD)活性的测定》[15]。
1.2.6.5 乙醇含量的测定 重铬酸钾分光光度法[16],具体操作如下:取两支10 mL的比色管,一支加入0.5 mL的样品,另一支以等量的蒸馏水代替,然后再加入2 mL的5%的重铬酸钾溶液,加水至刻度线,100 ℃水浴10 min,取出后立即冷却,静置5 min,以空白管校零,用1 cm比色皿于波长600 nm处测定吸光值。以无水乙醇为对照品,配制0.2 mg/mL的标准工作液,并绘制标准曲线,回归方程为A=0.3668x+0.0001,相关系数为R2=0.9992。乙醇含量(g/L)=(A-0.0001)/(0.3668×0.5)×稀释倍数。
1.2.7 数据处理 每组实验重复三次,采用Origin 9.0进行数据处理并作图,SPSS 21.0进行统计分析,用单因素方差分析(Duncan)对各组数据之间的差异显著性进行分析,以p<0.05作为差异显著性判断标准。
2 结果与分析
2.1 乳酸菌单独发酵
2.1.1 发酵时间的确定 由图1可知,不同种类的乳酸菌达到最大活菌时的时间不完全相同,这与菌种本身的特性有关。LB发酵12 h时,活菌数达到最大,而且此时的活菌数高于其他三种菌,说明LB迟缓期较短,能尽快进入对数生长期。LA和ST的活菌数均在18 h时达到最大,LA的最大活菌数高于ST。LP发酵30 h时才达到最大活菌数,虽然发酵时间最长,但此时的活菌数与LA相近,高于LB和ST的最大活菌数。综上可知,LB、LA、ST和LP的最佳发酵时间分别为12、18、18和30 h。
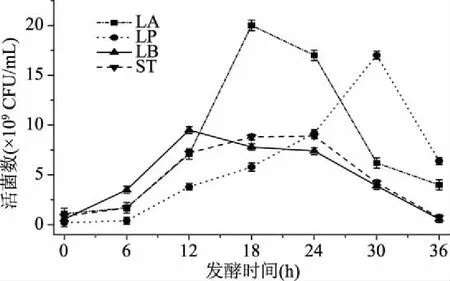
图1 不同菌种的发酵时间对乳酸菌活菌数的影响Fig.1 Effect of fermentation time of different strains on viable LAB counts 注:LA为嗜酸乳杆菌,LP为植物乳杆菌,LB为保加利亚乳杆菌,ST为嗜热链球菌;图2和图3同。
2.1.2 接种量的确定 由图2可知,不同菌种达到最大活菌数时的接种量各不相同,这是不同菌种的特性决定的。当接种量为1.5%时,ST的活菌数最高,说明其最适接种量为1.5%。虽然LB在接种量为2%时活菌数达到最大,但其活菌数仍比LA和LP低。LA和LP的最佳接种量均为3%,而且两种菌的生长趋势相近,活菌数均较高。综上可知,ST、LB、LA和LP的最佳接种量分别为1.5%、2%、3%和3%。
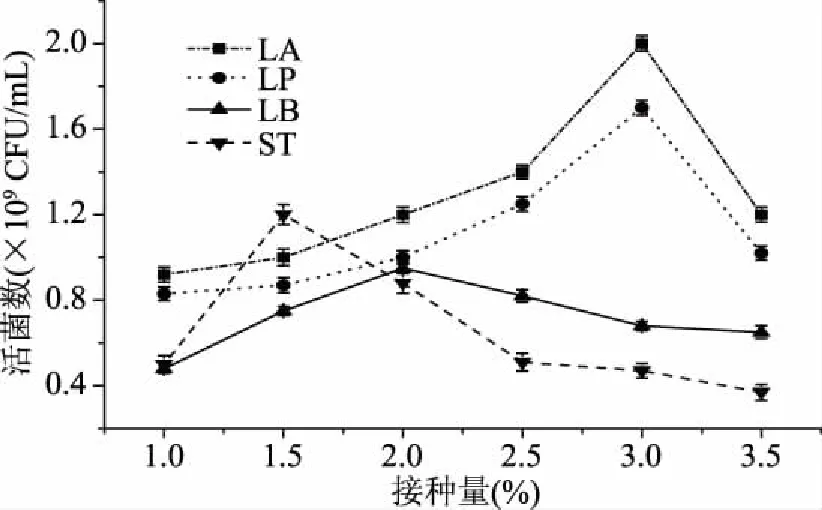
图2 不同菌种的接种量对乳酸菌活菌数的影响Fig.2 Effect of inoculation of different strains on viable LAB counts
由2.1.1和2.1.2的结果可以看出,虽然ST和LB达到最大活菌时的接种量小于LA和LP,这有利于节约成本,但LA和LP的活菌数明显高于LB和ST,活菌越多对产品越有利,考虑到不同乳酸菌之间可能存在共生作用,所以将LA和LP这两种生长较好的乳酸菌进行复配发酵,期望得到较高的活菌数。LA和LP单独发酵时均在3%的接种量下生长最好,接种量增大时活菌数减少,说明白首乌清汁中乳酸菌的总接种量为3%较合适,因此确定3%为复配发酵的总接种量。
2.1.3 复配比例和复配发酵时间的确定 由图3可以看出,当以不同的比例发酵18 h时,LA所占的比例越大,活菌数越高,因为此时LA的生长速率比LP快,活菌数积累较多。当以不同的比例发酵30 h时,LA可能处于稳定期甚至衰退期,此时LP生长速率较快,所以LP所占比例越大,活菌数量越高。当LA∶LP为1∶1时,发酵24 h得到的活菌数高于18 h和30 h时的活菌数,其他比例下24 h的活菌数基本处于两者之间。无论发酵18 h、24 h,还是30 h时,当LA和LP以1∶1发酵时,其活菌数始终是该时间下的最高值,可能是两菌间存在共生作用,所以LA和LP的最佳配比为1∶1,最适发酵时间为24 h。
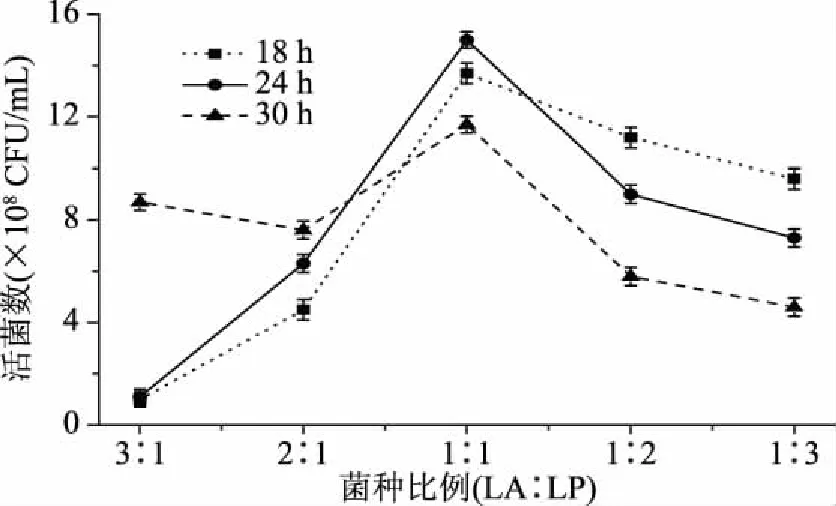
图3 菌种比例和发酵时间对乳酸菌活菌数的影响Fig.3 Effect of strains proportion and fermentation time on viable LAB counts
2.2 酵母菌单独发酵
2.2.1 发酵菌种和发酵时间的确定 由图4可知,同一发酵时间下,不同菌种的SOD酶活力有显著性差异(p<0.05)。随着发酵时间的延长,不同菌种的酶活力均呈一定的增长趋势,其中S4的SOD活力始终高于其他4种酵母菌,故选用S4为本实验酵母菌发酵的菌种。由图5可以看出,当发酵时间小于24 h时,随着发酵时间的延长,发酵液中SOD活力显著增加(p<0.05),在24 h时达到最大值后基本维持不变(p>0.05)。酵母菌发酵过程中会产生乙醇,在0~20 h之间,乙醇含量呈明显上升趋势(p<0.05),可能是因为酵母菌的数量随发酵时间的延长而逐渐增加,致使发酵液中氧气含量减少,从而导致酵母菌无氧发酵产乙醇的速率增加。由于发酵24 h后发酵液中SOD活力不再增加,所以将酵母菌的发酵时间定为24 h。
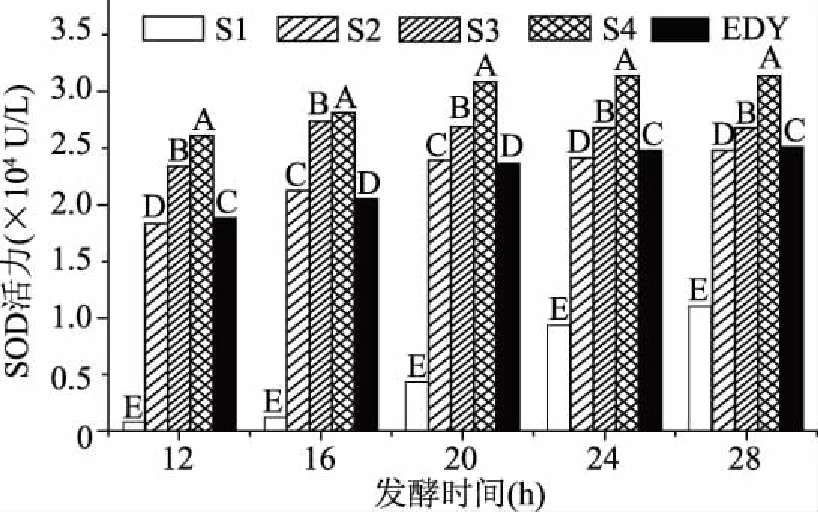
图4 发酵时间对不同菌种SOD活力的影响Fig.4 Effect of fermentation time on SOD activity of different strains注:S1、S2、S3、S4、EDY分别表示安琪酵母1、安琪酵母2、新良酵母、梅山酵母和尤乐博酵母。不同字母为同一时间下不同菌种之间的差异,字母不同表明差异显著,p<0.05。

图5 发酵时间对SOD活力和乙醇含量的影响Fig.5 Effect of fermentation time on SOD activity and ethanol content 注:图中字母不同表示差异显著,p<0.05;图6~图9同。
2.2.2 酵母菌接种量的确定 由图6可知,随着酵母菌接种量的增加,发酵液中SOD活力呈先升后降的趋势,接种量为0.2%时,发酵液中SOD活力显著高于其他组(p<0.05),说明酵母菌发酵产SOD的最佳接种量为0.2%。乙醇含量随接种量的增加逐渐降低(p<0.05),可能是由于接种量增加,酵母菌的生长受到发酵液中营养物质的限制,其死亡速率高于生长速率,酵母菌的活菌数逐渐减少,无氧发酵速率降低,最终导致乙醇含量降低。当接种量为0.2%时,SOD活力最高,故确定酵母菌的接种量为0.2%。
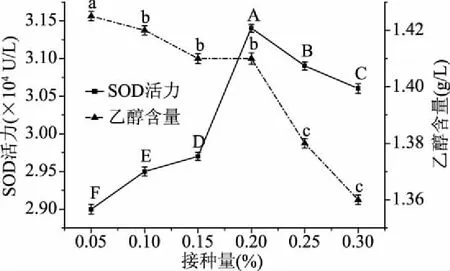
图6 酵母菌接种量对SOD活力和乙醇含量的影响Fig.6 Effect of inoculation quantity on SOD activity and ethanol content
2.2.3 初始pH的确定 由图7可知,发酵液中SOD活力随初始pH的增加呈显著下降趋势(p<0.05),乙醇含量也随之降低(p<0.05),可能是较高的pH抑制了酵母菌的生长,使活菌数减少,产酶能力降低,从而导致发酵液中SOD活力和乙醇含量都逐渐降低。当初始pH为5.0时,发酵液中SOD活力达到最大,由于酵母菌发酵结束后要接种乳酸菌,若初始pH太低则不利于后期乳酸菌发酵,所以确定初始pH为5.0。

图7 初始pH对SOD活力和乙醇含量的影响Fig.7 Effect of initial pH on SOD activity and ethanol content
2.2.4 装瓶量的确定 由图8可知,随着装瓶量的增加,SOD活力显著下降(p<0.05),乙醇含量呈上升趋势(p<0.05),可能是氧气含量的减少抑制了酵母菌的生长,无氧发酵速率加快,从而导致了SOD活力降低和乙醇含量升高。由此可以看出,溶氧量对酵母菌发酵有较大的影响,增加溶氧量即降低装瓶量有利于酵母菌产酶,考虑到经济情况,本实验将装瓶量确定为30 mL。

图8 装瓶量对SOD活力和乙醇含量的影响Fig.8 Effect of bottling capacity on SOD activity and ethanol content
2.2.5 蛋白胨添加量的确定 由图9可以看出,随着蛋白胨添加量的增大,发酵液中SOD活力呈先升后降的趋势(p<0.05),当添加1.2%的蛋白胨时,发酵液中SOD活力达到最大值。添加一定量的蛋白胨有利于酵母菌生长,从而促进其产酶。当蛋白胨添加量大于1.2%时,可能是因为发酵液中C:N降低,抑制了酵母菌的生长和产SOD,使发酵液中SOD活力降低,乙醇含量增加。综上可知,蛋白胨添加量为1.2%较合适。
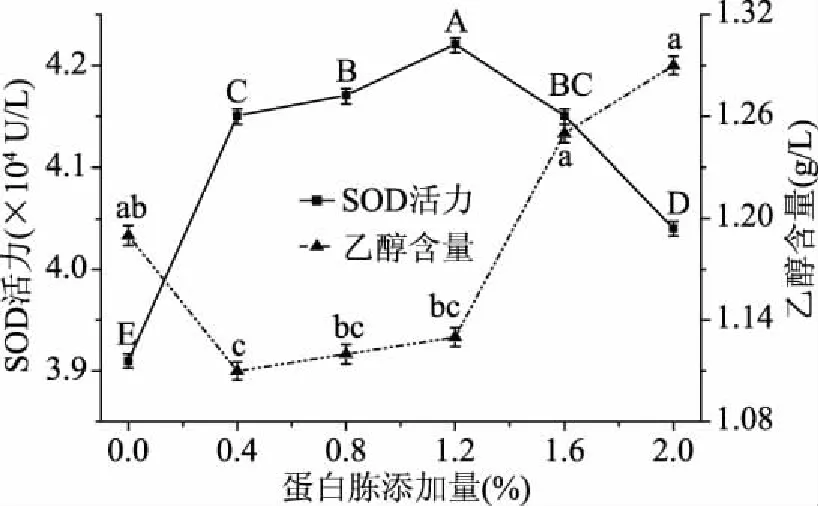
图9 蛋白胨添加量对SOD活力和乙醇含量的影响Fig.9 Effect of peptone addition on SOD activity and ethanol content
2.3 复合发酵
因为乳酸菌和酵母菌的最适生长温度和需氧情况相差较大,所以方法a不合适;又经对比实验发现,按方法b发酵,酵母菌生长明显不良,应该是乳酸菌利用发酵液中的营养物质的速度比酵母菌快,且过度发酵会使乳酸菌死亡。因此,为获得高SOD活力和大量乳酸菌活菌,采用方法c,先接种酵母菌发酵产酶,再接种乳酸菌,使其发酵提供活菌并改善风味。
酵母菌发酵24 h结束后,发酵液pH为4.8,此时再接入乳酸菌发酵。由图10A可知,酵母菌活菌数在0~36 h不断增大,其数量在36 h时达到最大值后呈下降趋势,乳酸菌活菌数量逐渐增加。由图10B可知,SOD活力在24 h时达到最大值后基本维持不变。接入乳酸菌后乙醇含量逐渐下降,有可能是因为乳酸菌发酵产生乳酸和其他物质,促进了乙醇的分解。此外,乙醇是一种亲神经性物质,容易转化成自由基,而SOD是清除自由基的重要酶类[17,18],36 h后酵母菌活菌数减少,其产乙醇的速率随之降低,此时SOD间接促进乙醇分解的速率大于乙醇产生的速率,所以发酵液中乙醇含量降低。由于本课题组后期会对白首乌酵素的解酒护肝功效进行研究,故乙醇含量越低对后面研究越有利。随着总发酵时间的延长,乳酸菌活菌数不断增加,SOD活力保持最大值不变且乙醇含量不断降低,虽然酵母菌活菌数下降,但其含量依然较高,故确定总发酵时间为60 h,乳酸菌的发酵时间为36 h。
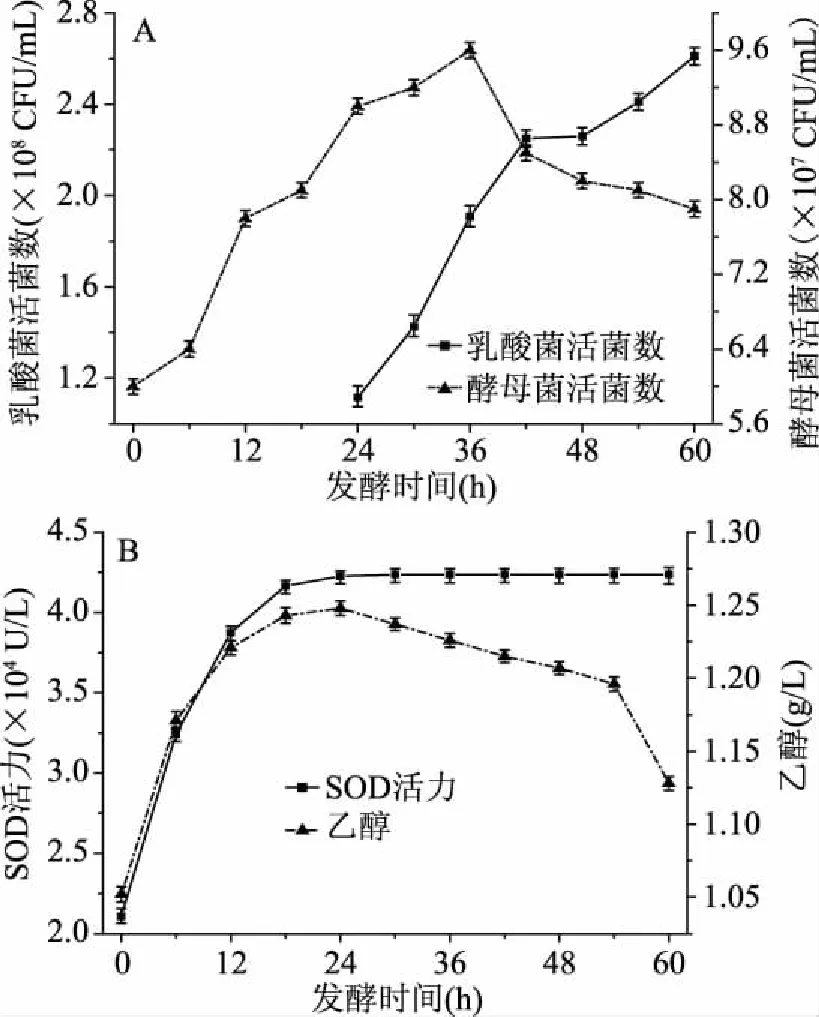
图10 复合发酵对发酵液的影响Fig.10 Effect of complex fermentation on fermentation broth
3 结论
本实验对乳酸菌单独发酵的条件(发酵时间、接种量和菌种复配比例)和酵母菌单独发酵的条件(菌种、发酵时间、接种量、初始pH、装瓶量和蛋白胨添加量)分别进行了优化,确定将LA和LP以1∶1 (v∶v)的比例混合作为乳酸菌发酵的菌种,并确定采用先接种酵母菌后接种乳酸菌发酵的方式得到的乳酸菌活菌数和SOD活力较优,在该顺序下得到的最佳复合发酵条件为:在初始pH5.0、添加1.2%的蛋白胨和装瓶量为30 mL(250 mL)的条件下,先接种0.2%的S4,30 ℃下振荡发酵24 h。酵母菌发酵结束后,再接种3%的复合乳酸菌(LA和LP的比例为1∶1 (v∶v)),37 ℃静置发酵36 h,最后于4~8 ℃低温后发酵12 h产香。在此条件下,最终酵素中乳酸菌活菌为2.61×108CFU/mL,酵母菌活菌数为7.9×107CFU/mL,SOD活力为4.23×104U/L。本文首次以纯白首乌清汁为发酵基质,采用有益菌发酵的方法研制了一款新型的白首乌产品,该产品含有的大量活菌和功效酶,不仅提高了白首乌产品的附加值,还有利于当地产业的发展。

