不同品种山药皮醇提物的抗氧化性能
, , , ,, ,*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064; 2.湖北工业大学生物工程与食品学院,湖北武汉 430064)
山药皮的主要成分与山药相似,含有较丰富的营养成分以及药用价值。山药皮不仅含有淀粉、蛋白质、氨基酸等营养成分,还含有多糖类、黄酮类、皂苷类和多酚类等活性物质[1],食用山药皮有助于其他营养元素吸收,促进消化,并具有滋阴补肾的作用[2-3],研究山药皮活性成分的种类及含量对于进一步研究开发山药皮系列产品具有重大的意义。
山药在鲜食或加工前一般都需进行去皮处理,刮除的皮渣约占其山药质量的1/5,其中绝大部分都作为废料直接丢弃,不仅污染环境,还浪费资源[4]。若将山药皮中活性成分加以利用,既可优化环境,又可加大原料的利用率,增加经济效益[5]。皂苷可提高机体对自由基损害的清除和防御功能[6],延缓衰老[7]。王彦平等[8]采用纤维素酶和果胶酶辅助提取紫山药皮薯蓣皂苷并对其抗氧化活性进行了研究,结果表明,在最佳提取工艺下紫山药皮薯蓣皂苷表现出明显的抗氧化能力;山药皮也富含黄酮化合物,具有降血压、降血脂等作用,还具有抗氧化、抗菌抗炎、增强免疫等药理活性[9],刘青等[10]研究表明,随着提取的黄酮类化合物浓度的增加,羟基自由基和DPPH自由基的清除率均呈增加状态,由此可见,黄酮类化合物具有较强的清除羟基自由基和DPPH自由基的能力。山药皮中还含有丰富的多酚类物质,这些抗氧化物质可以延缓脂质过氧化或者其他分子氧化[11],目前研究认为,山药皮抗氧化能力与其提取物具有的还原能力和抑制氧化酶活性密切相关,无论在体内还是体外,其抗氧化作用均较为明显。
本研究以菜山药皮为原料,采用不同浓度乙醇对其进行浸提处理,通过比较醇提物中活性成分和抗氧化能力,得出最佳浓度的乙醇溶液,用最佳乙醇浓度浸提铁棍山药皮、蕲春山药皮、利川山药皮、佛手山药皮、菜山药皮,主要从不同品种山药皮醇提物间的活性成分和抗氧化能力差异方面展开研究,为今后山药皮制品及其保健食品的开发提供科学的依据。
1 材料与方法
1.1 材料与仪器
山药 品种为菜山药、铁棍山药、蕲春山药、利川山药、佛手山药,由湖北省农业科学院经济作物研究所提供;无水乙醇、没食子酸(分析纯)、薯蓣皂苷(分析纯)、水杨酸(分析纯) 国药集团化学试剂有限公司;芦丁(生化试剂) 上海展元化工有限公司;DPPH(分析纯) 京东化成工业株式会社;亚油酸(分析纯) 上海源叶生物科技有限公司。
UV-3802型分光光度计 上海尤尼科仪器有限公司;CS101-1E型电热鼓风干燥箱 重庆四达试验设备有限公司。
1.2 实验方法
1.2.1 山药皮活性成分的浸提流程 鲜山药→清洗→去皮→山药皮烘干→粉碎→过筛→回流浸提→离心分液→避光低温保存
操作要点:将鲜山药洗净去皮,将山药皮置于70 ℃烘箱中烘18 h,后将其拿出粉碎,过筛(60目)待用。准确称取精山药皮粉10 g于250 mL装有小磁针的圆底烧瓶,加入相应浓度乙醇溶液100 mL(料液比1∶10),置于磁力搅拌水浴锅中50 ℃水浴回流3 h,5000 r/min离心25 min后将上清液倒出,于4 ℃冰箱避光低温保存,将剩余的废渣重新移回圆底烧瓶,加入同等体积同样浓度的乙醇二次回流1 h,5000 r/min离心25 min后将上清液倒出,于4 ℃冰箱避光低温保存。
1.2.2 不同乙醇浓度对菜山药皮浸提物活性成分及抗氧化性的影响 以菜山药皮为原料,分别采用10%、30%、50%、70%、90%的乙醇溶液按照1.2.1的步骤进行浸提处理,比较所得醇提物中多酚、黄酮、皂苷含量,及粗提物清除DPPH、羟基自由基、超氧阴离子的效果和对于铁离子的还原力能力。综合上述指标分析得到最佳乙醇浓度。
1.2.3 不同品种山药皮浸提物活性成分及抗氧化性能的比较 采用1.2.2所得最佳乙醇浓度,对佛手山药皮、铁棍山药皮、蕲春山药皮、菜山药皮、利川山药皮进行浸提处理,比较所得醇提物中多酚、皂苷、黄酮含量,及DPPH自由基、羟基自由基、超氧阴离子清除能力以及铁离子还原能力和抑制亚油酸氧化能力的差异。
1.2.4 山药皮浸提物主要活性成分含量的测定
1.2.4.1 山药皮浸提物中多酚含量的测定 使用福林酚法绘制没食子酸标准曲线。取0.5 mL样液于10 mL具塞比色管中,分别加入1 mL Folim-ciocalfen于比色管中,充分振荡3~4 min,再分别加入1 mL 10%的NaCO3溶液,充分摇匀,用蒸馏水定容至5 mL,25 ℃恒温1 h,在765 nm波长下测吸光值。在相同条件下测定不同质量浓度的没食子酸吸光度,绘制标准曲线,得到回归方程为:y=184.28x+0.0277,R2=0.999。结果以没食子酸当量表示(mg没食子酸/g干重)[12]。
式(1)
式中:M为样品中多酚含量,mg/g;c为通过标准曲线查的多酚浓度,mg/mL;m为山药皮醇提物质量,g;V1为测定时样品提取液体积,mL;V2为定容样液体积,mL。
1.2.4.2 山药皮浸提物中皂苷含量的测定 标准曲线的制作:取5 mg薯蓣皂苷于50 mL容量瓶中,用甲醇溶解,并定容至刻度。取上述溶液0.0、0.4、0.8、1.2、1.6、2.0 mL于具塞试管中,再分别加入0.2 mL 5%香草醛冰醋酸和0.8 mL高氯酸,混匀,密塞,置于60 ℃水浴15 min,取出后用冰水冷却5 min,各加入5.0 mL冰醋酸,摇匀静置10 min,以空白作为参比,在544 nm波长下测吸光值,以薯蓣皂苷浓度为横坐标吸光度为纵坐标绘制标准曲线,得到回归方程为:y=8.791x-0.0249,R2=0.998。
皂苷的含量测定:取0.5 mL样液于具塞比色管中,再分别加入0.2 mL 5%香草醛冰醋酸和0.8 mL高氯酸,混匀,密塞,置于60 ℃水浴15 min,取出后用冰水冷却5 min,各加入5.0 mL冰醋酸,摇匀静置10 min,以空白作为参比,在544 nm波长下测吸光值[13]。
式(2)
式中:M为样品中皂苷含量,mg/g;c为通过标准曲线查的皂苷浓度,mg/mL;m为山药皮醇提物质量,g;V1为测定时样品提取液体积,mL;V2为定容样液体积,mL。
1.2.4.3 山药皮浸提物中黄酮含量的测定 标准曲线的制作:取芦丁标准液(0.1 mg/mL)0.0、2.0、4.0、6.0、8.0、10.0 mL于6只25 mL比色管中,用70%乙醇补充至12.5 mL,加入1.0 mL 5%亚硝酸钠溶液,静置5 min后加入1.0 mL 10%硝酸铝,6 min后加入5 mL 1 mol/L氢氧化钠溶液,摇匀,用70%乙醇稀释至刻度,静置10 min,在510 nm波长下测吸光值,以芦丁浓度为横坐标吸光度为纵坐标绘制标准曲线,得到回归方程为:y=10.775x-0.0026,R2=0.997。
黄酮的含量测定:取1 mL样液于25 mL比色管中,用70%乙醇补充至12.5 mL,加入1.0 mL 5%亚硝酸钠溶液,静置5 min后加入1.0 mL 10%硝酸铝,6 min后加入5 mL 1 moL/L氢氧化钠溶液,摇匀,用70%乙醇稀释至刻度,静置10 min,在510 nm波长下测吸光值[14]。
式(3)
式中:M为样品中黄酮含量,mg/g;c为通过标准曲线查的黄酮浓度,mg/mL;m为山药皮醇提物质量,g;V1为测定时样品提取液体积,mL;V2为定容样液体积,mL。
活性成分总量:多酚、黄酮、皂苷三总活性成分之和。
1.2.5 山药皮醇提物抗氧化能力的测定
1.2.5.1 羟基自由基清除能力 利用Fenton反应检测产生的羟基自由基。在比色管中依次加入9 mmol/L FeSO41 mL、9 mmol/L水杨酸-乙醇溶液 1 mL、样液1 mL、8.8 mmol/L H2O21 mL。其中H2O2的作用是启动整个反应。37 ℃反应0.5 h后,以蒸馏水为参比,在510 nm下测定吸光度。以9 mmol/L FeSO41 mL、9 mmol/L水杨酸-乙醇溶液1 mL、样液1 mL和蒸馏水1 mL作为待测溶液的本底吸收值。以上各管均做三组平行,按公式(4)计算对羟基自由基的清除率K[15]。
K(%)[0-(AX-AX0)]×100/A0
式(4)
式中:A0为不加山药皮醇提物的空白对照液的吸光度;Ax为加入待测溶液后的吸光度;Ax0为无显色剂时提取剂的本底吸光度。
1.2.5.2 DPPH自由基清除能力 在管中依次加入3.5 mL 6.5×10-5mol/L DPPH溶液和0.5 mL 60%的乙醇,总体积为4 mL,混匀20 min后,于比色皿中在517 nm处测定吸光值,记为A0;加入3.5 mL 6.5×10-5mol/L DPPH溶液和0.5 mL待测试样溶液,测定值记为As;加入3.5 mL体积分数为60%的乙醇和0.5 mL待测试样溶液,测定值为Ar,用3.5 mL无水乙醇和0.5 mL 60%乙醇作为参照,以上各管均做三组平行。按公式(5)计算对DPPH自由基清除率R[16]。
R(%)=[1-(AS-Ar)/A0]×100
式(5)
式中:As为加入醇提物的吸光度;Ar为本底吸收的吸光度;A0为空白溶液的吸光度。
1.2.5.3 超氧阴离子自由基清除能力 采用邻苯三酚自氧化法的测定,取4.5 mL,pH8.2,50 mmol/L Tris-HCl缓冲液,4.2 mL超纯水,混匀后在25 ℃水浴中保温20 min。取出后立即加入在25 ℃预热过的3 mmol/L邻苯三酚0.3 mL,加入1 mL超纯水,迅速摇匀后倒入比色杯,325 nm下每隔30s测定吸光度值,计算线性范围内每分钟吸光度的增加。空白管用空白管10 mmol/L HCl代替邻苯三酚的HCl溶液。样品活性测定,在加入邻苯三酚前,先加入1 mL样液,然后按采用邻苯三酚自氧化法测定的方法操作,并计算清除率。以上各管均做三组平行,清除率按公式(6)计算[17]。
I(%)=(ΔA0-ΔA)×100/ΔA0
式(6)
式中:ΔA0为邻苯三酚自氧化速率;ΔA为加入醇提物后邻苯三酚的自氧化速率(单位均为吸光度每min的增值)。
1.2.5.4 铁离子还原能力的测定(FRAP法) 标准曲线的制作:分别取浓度为0.04、0.08、0.12、0.16、0.20 mmol/L FeSO4溶液0.2 mL于比色管中,加入6 mL FRAP工作液(0.3 mol/L醋酸盐缓冲液∶10 mmol/L TPTZ 溶液∶20 mmol/L FeCl3=10∶1∶1),0.6 mL蒸馏水混匀于37 ℃水浴10 min,于593 nm波长下比色读数,用蒸馏水代替FeSO4溶液做空白,制作标准曲线,得到回归方程为:y=0.555x+0.0652,R2=0.995。
取0.2 mL样液于比色管中,加入6 mL FRAP工作液,0.6 mL蒸馏水混匀于37 ℃水浴10 min,于593 nm波长下比色读数,用蒸馏水溶液做空白[18]。
式(7)
式中:C为样品中铁离子浓度,mol/L;c为通过标准曲线查的铁离子浓度,mmol/L;m为山药皮醇提物质量,g;V1为测定时样品提取液体积,mL;V2为定容样液体积,mL。
1.2.5.5 亚油酸氧化能力的测定 取不同体积提取液0.5 mL入25 mL具塞试管中,用乙醇稀释至4 mL,然后加入2.5%亚油酸乙醇溶液4 mL、0.05 mol/L,pH7.0磷酸缓冲液8 mL及蒸馏水4 mL,混匀后放入40 ℃恒温培养箱避光保存。每24 h取反应液0.1 mL,分别加入75%的乙醇9.7 mL和30%的硫氰酸铵溶液0.1 mL,再加入0.02 mol/L的氯化亚铁溶液(含3.5% HCl)0.1 mL启动反应,准确反应3 min,于500 nm处测定形成红色化合物的吸光度直至吸光度达到最大值[19]。
1.3 数据处理
不同品种山药皮醇提物每个样品中的活性成分和抗氧化性能分别测定三次,取平均值±标准差。各活性成分和抗氧化性能采用Excel 2007进行统计分析,利用SPSS 19.0 软件进行相关性分析和差异显著性分析,Origin18.0进行作图。
2 结果与分析
2.1 乙醇浓度对菜山药皮醇提物中活性成分含量的影响
从图1A可以看出,当乙醇浓度从10%升高到70%时,醇提物中多酚呈上升趋势,且差异显著(p<0.05),当乙醇浓度为70%时,山药醇提物多酚含量为0.74 mg/g;乙醇浓度继续升高,多酚含量反而下降,这可能由于乙醇浓度过大,容易挥发,同时其他一些醇溶性物质和脂溶性杂质的溶出或可增加,或者是高浓度的乙醇使蛋白质变性,影响与之结合多酚的溶出[20],从而导致多酚含量的下降,当乙醇浓度为70%时,多酚含量达到最大,这有可能是菜山药皮中多酚的极性与70%乙醇的极性相同[21],刘永等[22]对黄皮果核中多酚提取有相似结论。菜山药皮中皂苷含量也在乙醇浓度为70%时最高,且显著高于其他浓度(p<0.05),其含量为3.71 mg/g,皂苷含量在乙醇浓度为10%~70%的区间上升,70%~90%区间下降。可能是因乙醇浓度过低时,提取液中含有较难分离的蛋白质等杂质等,而乙醇浓度过高可能会增加脂溶性物质的溶出,这与侯丽丽等[23]对人参皂苷提取的结论一致。

图1 乙醇浓度对山药皮醇提物中活性成分含量的影响Fig.1 Effect of ethanol concentration on the content of active components in alcohol extract from yam peel注:小写字母a~e表示组内的显著性差异;图2~图6同。
由图1B可知,在一定条件下,随着乙醇浓度的增加,山药皮细胞壁破裂速度加快[24],当乙醇浓度达到50%时,菜山药皮醇提物黄酮含量最高,达到1.62 mg/g,高于其他组。之后随着乙醇浓度的增大,黄酮含量下降,这可能是由于乙醇浓度的增加使提取液的极性增大,对一些极性较大的黄酮类化合物的提取能力增强,但过高浓度的乙醇会使其他醇溶性的杂质增多,而有效成分的溶出减少[25]。从活性成分总量来看,随着乙醇浓度的增大,活性成分总量先增后降,在乙醇浓度为70%时活性成分总量显著高于其他浓度(p<0.05),其活性成分总含量(多酚、皂苷、黄酮含量总和)为6.04 mg/g,综合分析,乙醇浓度为70%时,菜山药皮中活性成分的损失较少。
2.2 乙醇浓度对菜山药皮醇提物的抗氧化活性的影响
2.2.1 乙醇浓度对菜山药皮醇提物的羟基自由基和DPPH自由基清除率的影响 由图2可知,随着乙醇浓度的增加,菜山药皮中醇提物对羟基自由基的清除率逐渐增大,但当乙醇浓度达到70%时,羟基自由基的清除率达到最大值,达到86.41%,当乙醇浓度达到90%时,其对羟基自由基的清除率显著低于70%乙醇浸提物(p<0.05);当乙醇浓度在10%~70%时,醇提物对羟基自由基的清除率随着乙醇浓度的增加其清除率成线性增加,线性方程为y=0.724x+24.14(R2=0.9845)。羟基自由基的清除率的大小常用半清除率EC50表示,EC50越小表示其抗氧化能力越强[26],乙醇浓度所提取的醇提物对羟基自由基的清除率的EC50为35.72%,说明当乙醇浓度为35.72%时,所提取的浸提物对羟基自由基的清除率为50%。随着乙醇浓度的增加,其对羟基自由基的清除率呈现先上升后下降的趋势,乙醇浓度到70%时达到最大值,其对DPPH的清除率达到64.30%,当乙醇浓度高于70%以后,其对DPPH的清除率逐渐下降;70%乙醇提取的菜山药皮醇提物对羟基自由基清除作用显著高于其他浓度(p<0.05),表明菜山药皮经70%乙醇提取的醇提物对羟基自由基具有较强清除作用,这可能与菜山药皮醇提物中主要活性物质的种类有关,具体原因将有待进一步的研究和分析。
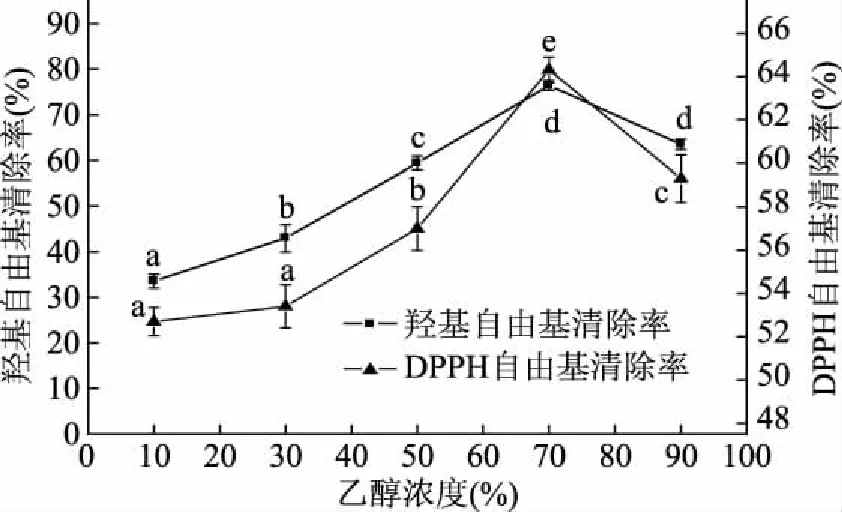
图2 乙醇浓度对山药皮醇提物的羟基自由基 和DPPH自由基清除率的影响Fig.2 Effects of ethanol concentration on purging of hydroxyl radicals and DPPH free radicals of ethanol extracts from yam peel
2.2.2 乙醇浓度对菜山药皮醇提物的超氧阴离子清除率和铁离子还原能力的影响 乙醇浓度对超氧阴离子清除率和铁离子还原能力的影响如图3所示。结果表明,菜山药皮醇提物对超氧阴离子自由基清除能力随着乙醇浓度增加而呈现先减小后增大的趋势,当乙醇浓度从10%增加到30%时,超氧阴离子自由基清除率从4.12%下降到1.21%,之后随着乙醇浓度的增加,超氧阴离子自由基清除率也逐渐增加,当乙醇浓度为70%和90%时,超氧阴离子自由基清除率分别为11.63%和13.59%。当乙醇浓度为50%时,铁离子还原能力达到最大值,而后随着乙醇浓度的增大,铁离子还原能力呈下降趋势,且显著低于50%乙醇提取的菜山药皮醇提物(p<0.05),表明50%提取的菜山药醇提物铁离子还原能力最强,这可能是因为菜山药醇提物中各成之间的含量存在差异,且复杂的活性成分之间的相互协同或拮抗作用导致了醇提物对超氧阴离子清除效果和铁离子还原能力不同[27]。

图3 乙醇浓度对山药皮醇提物的超氧阴离子清除率 和铁离子还原能力的影响Fig.3 Effects of ethanol concentration on superoxide anion clearance and ferric ion reducing ability of ethanol extracts from yam peel
综合乙醇浓度对菜山药皮醇提物抗氧化活性的影响,当乙醇浓度为70%时,所提取的菜山药皮中醇提物抗氧化活性最高。
2.3 不同品种山药皮醇提物活性成分分析
由图4可知,山药皮醇提物中活性成分的含量因为品种的不同而存在显著性差异(p<0.05),且按照差异性大小,皂苷>黄酮>多酚。在多酚含量方面,佛手山药皮醇提物中多酚含量最高,为2.46 mg/g,其次是铁棍山药皮,其含量为2.14 mg/g,略低于佛手山药皮醇提物,菜山药和利川山药皮醇提物中多酚含量较低,分别为0.71、0.69 mg/g,显著低于佛手山药醇提物中的多酚含量(p<0.05)。不同品种山药皮醇提物中皂苷含量存在显著性差异(p<0.05),其中佛手山药皮醇提物中的皂苷含量最高,为12.52 mg/g,菜山药皮醇提物中的皂苷含量最低,其含量为3.21 mg/g。不同品种间黄酮含量也存在显著性差异(p<0.05),范围在1.23~6.12 mg/g之间,佛手山药皮醇提物中黄酮含量显著高于铁棍山药皮,与文献报道一致[28],且佛手山药皮醇提物中黄酮含量最高,菜山药皮醇提物中黄酮含量最低。不同品种山药皮醇提物活性成分总量差异显著(p<0.05),按照活性成分含量高低,佛手山药皮>铁棍山药皮>蕲春山药皮>利川山药皮>菜山药皮,这是由于种植地域、年份、品种基因型等对山药品种中活性成分存在不同程度的影响,且这些因素之间可能存在着交互作用。

图4 不同品种山药皮醇提物活性成分分析Fig.4 Active components of alcohol extracts from different varieties of yam peel注:小写字母a~e表示不同品种间相同指标结果 具有显著性差异;图5~图6同。
2.4 不同品种山药皮醇提物抗氧化活性分析
山药皮醇提物中活性成分能有效地清除体内自由基,从而防止因自由基过剩而产生的生物大分子损伤,具有较强的抗氧化能力[29]。
2.4.1 不同品种山药皮醇提物自由基清除率分析 由图5可知,不同品种山药皮醇提物对自由基的清除率存在显著性差异(p<0.05),山药皮醇提物对羟基自由基和DPPD自由基清除率与山药皮中活性成分(总酚、皂苷、黄酮)的趋势一致,这可能由于山药皮醇提物中的多酚类物质含有大量酚羟基,可通过转移氢原子来阻断自由基链式反应的过程,从而发挥抗氧化活性[30]。不同品种山药皮醇提物对自由基清除能力中,佛手山药皮醇提物对羟基自由基和DPPH自由基清除率显著高于其余山药皮醇提物(p<0.05),清除率分别为94.85%和95.23%,但铁棍山药皮醇提物对超氧阴离子自由基清除能力最高,清除率为50.21%,菜山药皮醇提物对三种自由基清除能力最低,这与其中活性成分含量一致,有研究表明[31],猕猴桃的抗氧化活性成分与抗氧化能力显著相关,相关系数达到0.72以上,充分证明活性成分对抗氧化能力具重要贡献。五种山药皮醇提物具有较高的羟基自由基和DPPH自由基清除能力,而其超氧阴离子自由基清除能力却较低,由此可见,样品的羟基自由基和DPPH自由基清除较高,其对超氧阴离子自由基清除能力不一定高,这可能是因为其抗氧化机理的差异造成的,这与周萌等研究结果相似[32]。

图5 不同品种山药皮醇提物自由基清除率分析Fig.5 Analysis of free radical scavenging rate of alcohol extracts from different varieties of yam peel
2.4.2 不同品种山药皮醇提物铁离子还原能力和亚油酸氧化能力分析 由图6可知,山药皮品种的铁离子还原能力和亚油酸氧化差异较大,不同山药皮醇提物间,佛手山药皮与铁棍山药皮、蕲春山药皮、菜山药皮醇提物亚油酸氧化能力差异显著(p<0.05),但与利川山药皮醇提物无显著差异(p>0.05),五个品种山药皮醇提物亚油酸氧化能力变化范围为0.142~0.167,其中菜山药皮醇提物亚油酸氧化能力最大,铁棍山药皮醇提物亚油酸氧化能力最小,由此可见铁棍山药皮醇提物抑制亚油酸氧化能力最高,其次是佛手山药皮和利川山药皮;五种山药皮醇提物铁离子还原能力差异显著(p<0.05),从高到低排序为:佛手山药皮>菜山药皮>铁棍山药皮>蕲春山药皮>利川山药皮,平均值为0.0762 mol/L,变异系数为44.26%,表明品种差异较大,导致不同品种石榴花色苷含量差异的原因较多,如品种、种植地域、气候、种植技术等[33],总的来说,佛手山药皮醇提物抗氧化能力较高。
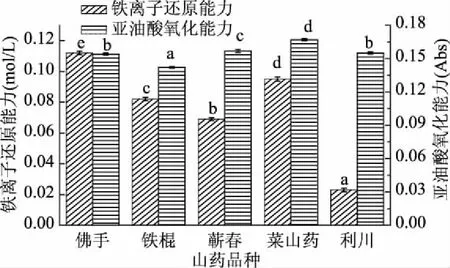
图6 不同品种山药皮醇提物铁离子还原能力 和亚油酸氧化抑制能力分析Fig.6 Iron ion reduction ability and inhibition ability of linoleic acid oxidation in different kinds of yam extracts
2.5 相关性分析
对五种不同品种山药皮醇提物中活性成分以及抗氧化能力进行相关性分析,结果见表1。从表1可知,山药皮醇提物的多酚、皂苷、黄酮及活性成分总含量几个指标之间均极显著相关(p<0.01),而山药皮醇提物的羟基自由基、超氧阴离子自由基清除能力与DPPH自由基清除率、亚油酸氧化能力均分别存在显著正相关和显著负相关性(p<0.05),表明具有相似反应机理的抗氧化法测得的抗氧化性具有一定的相关性;山药皮醇提物多酚、皂苷及活性成分总含量与DPPH自由基清除率存在极显著正相关(p<0.01),黄酮含量与DPPH自由基清除率呈显著正相关(p<0.05),活性成分总含量与羟基自由基、超氧阴离子自由基清除能力呈显著正相关(p<0.05),但与其铁离子还原能力不存在显著相关性。与文献[34]相比,既存在差异,又有相似性,Xue等[34]研究表明,枣果果皮中的总酚与铁离子还原能力和DPPH自由基清除能力有显著正相关。皂苷和活性成分总含量与亚油酸氧化能力呈显著负相关(p<0.05),相关系数分别为-0.733、-0.706,但多酚和黄酮与其无显著相关性(p>0.05)。

表1 相关性分析数据Table 1 Relevance analysis data
3 结论
本实验用不同浓度乙醇对菜山药皮进行浸提,发现70%乙醇浸提的菜山药皮醇提物多酚、皂苷、黄酮等活性成分含量和抗氧化能力均现在显著高于其他浓度提取的醇提物;通过对湖北省内五个山药品种皮醇提物进行了分析,发现多酚、皂苷和黄酮等活性成分和抗氧化能力在不同的品种间存在明显的差异;在活性成分方面,其中佛手山药皮醇提物中多酚、皂苷和黄酮含量以及活性成分总量最高,其次是铁棍山药,菜山药皮醇提物三种活性成分最低;在抗氧化能力方面,铁棍山药皮醇提物对超氧阴离子清除能力最高,其次是蕲春山药皮,利川山药皮醇提物抑制亚油酸氧化能力最大;且不同品种山药皮醇提物的多种活性成分之间相关性极显著,抗氧化活性能力之间也存在一定相关性,而活性成分与抗氧化能力之间呈正相关或负相关;综合活性成分和抗氧化能力,佛手山药活性成分和抗氧化能力最高,其多酚、皂苷、黄酮、活性成分总量分别为2.46、12.52、6.12、21.06 mg/g,对羟基自由基、超氧阴离子和DPPD自由基清除率分别为94.85%、44.81%和95.23%,铁离子还原能力和亚油酸氧化能力分别为0.112 mol/L、0.154。因此,本研究认为,在进行山药皮的开发利用中,首先应对品种进行确定,再有针对性的进行精深加工,根据不同品种的特性,开发不同的精深加工产品类型,满足不同的市场的需求。

